ņä£ ļĪĀ
2000ļģäļīĆ ņ┤łļ░śļČĆĒä░ ņÜ░ļ”¼ļéśļØ╝ņŚÉņä£ ņĪ░ĻĖ░ ņ£äņĢöņØś ņ╣śļŻīļĪ£ Ļ░üĻ┤æņØä ļ░øĻ│Ā ņ׳ļŖö ļé┤ņŗ£Ļ▓ĮņĀÉļ¦ēĒĢśļ░Ģļ”¼ņłĀ(endoscopic submucosal dissection, ESD)ņØĆ ļŗżņ¢æĒĢ£ ļéśņØ┤ĒöäņÖĆ ņĢģņäĖņä£ļ”¼ņØś Ļ░£ļ░£ņØä ĒåĄĒĢśņŚ¼ Ēśäņ×¼ļŖö ņĪ░ĻĖ░ ņ£äņĢö ņ╣śļŻīņØś ĻĘ╝Ļ░äņØä ņØ┤ļŻ©Ļ│Ā ņ׳ļŖöļŹ░[1-5], 2007ļģäņŚÉ ņ▓śņØīņ£╝ļĪ£ ņĪ░ņ¦ü ņĀłņĀ£ņŚÉ ļĀłņØ┤ņĀĆ(light amplication by the sumulated emission of radiation)ļź╝ ņé¼ņÜ®ĒĢ£ Ļ▓āņØ┤ ņ▓śņØī ņåīĻ░£ļÉśņŚłĻ│Ā[6-8], ļ╣äĻĄÉņĀü ņĀüņØĆ ņł½ņ×ÉņØś ĒÖśņ×ÉņŚÉ ņĀüņÜ®ļÉśņŚłņ¦Ćļ¦ī, ļĀłņØ┤ņĀĆļź╝ ņØ┤ņÜ®ĒĢ£ ESD ļ░®ļ▓ĢņØĆ ĻĖ░ņĪ┤ņŚÉ ņé¼ņÜ®ļÉ£ ņĀÉļ¦ēņĀłņĀ£ņłĀ(endoscopic mucosal resection)ņŚÉ ļ╣äĒĢ┤ņä£ ņ┤łņŗ¼ņ×ÉņŚÉĻ▓É ļ╣äĻĄÉņĀü ņ¢┤ļĀżņÜ┤ ņŗ£ņłĀņØ┤ļŗż. ļĀłņØ┤ņĀĆ ņ╣śļŻīļŖö ņĪ░ņ¦üņØś ņ”ēĻ░üņĀüņØĖ ņ”Øļ░£ņØä ņ£ĀļÅäĒĢĀ ņłś ņ׳ļŖöļŹ░. ĒŖ╣Ē׳ thulium ļĀłņØ┤ņĀĆļŖö Ļ░ĆļŖśĻ│Ā, ņ£ĀņŚ░ĒĢ£ ļĀłņØ┤ņĀĆ ņä¼ņ£Āļź╝ ĒåĄĒĢśņŚ¼ ņ¦ĆņåŹņĀüņ£╝ļĪ£ 2-╬╝m ĒīīņןņØś ļĀłņØ┤ņĀĆļź╝ Ēł¼ņé¼ĒĢśņŚ¼ Ļ╣ŖņØĆ ņĪ░ņ¦üņØś ņåÉņāü ņŚåņØ┤ ņĄ£ļīĆ 0.25 mm Ļ╣ŖņØ┤Ļ╣īņ¦Ć ņĪ░ņ¦üņØä ĒåĄĻ│╝ĒĢśņŚ¼ ļ╣äĻĄÉņĀü ņĢłņĀäĒĢśĻ▓ī ņ£äņĢö ņĪ░ņ¦üņØä ņĀ£Ļ▒░ĒĢĀ ņłś ņ׳ļŗż[9-11]. ļ│ĖĻ│ĀņŚÉņä£ļŖö ņØ┤ļ¤¼ĒĢ£ ļĀłņØ┤ņĀĆļź╝ ņØ┤ņÜ®ĒĢ£ ESDņØś ņ╣śļŻī ņä▒ņĀüĻ│╝ Ē¢źĒøä ņĀäļ¦ØņŚÉ ļīĆĒĢ┤ ņØ┤ņĢ╝ĻĖ░ ĒĢśĻ│Āņ×É ĒĢ£ļŗż.
ļ│Ė ļĪĀ
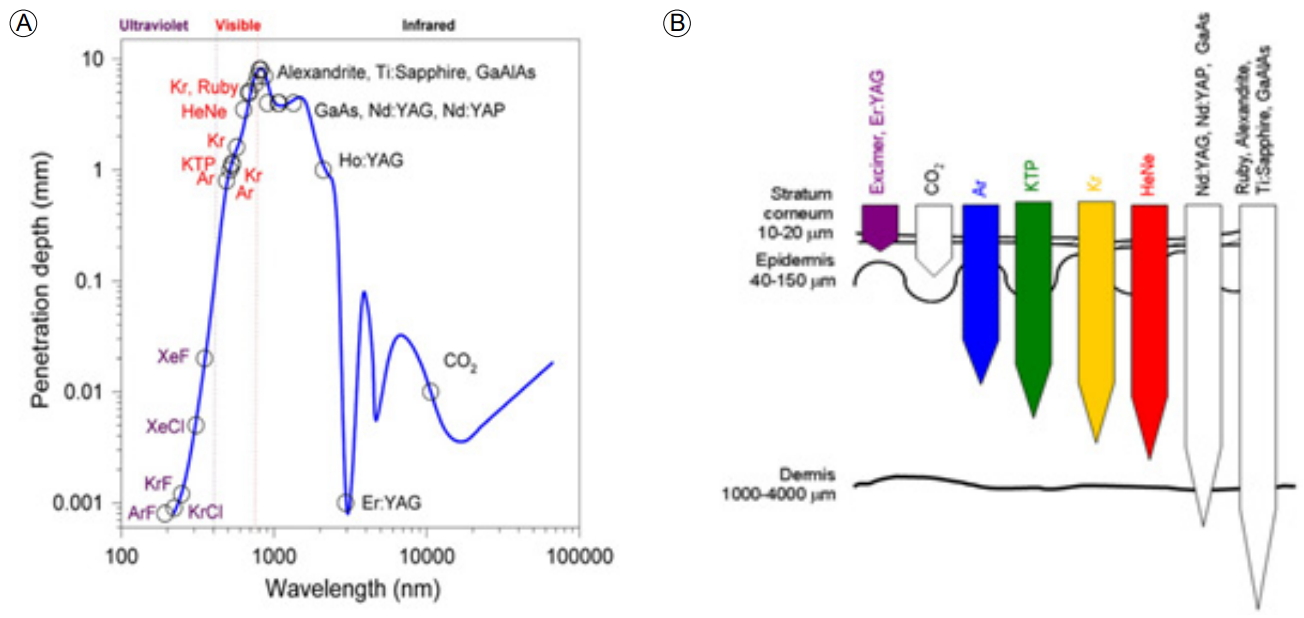
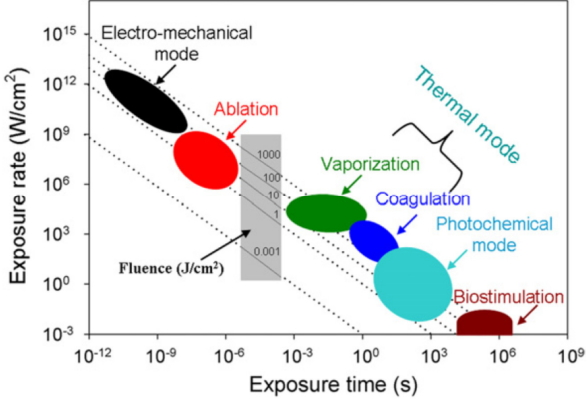
ņ£äņĢöņØĆ ĻĄŁļé┤ņŚÉņä£ ļ░£ņāØļźĀņØ┤ Ļ░Ćņן ļåÆņØĆ ņĢöņ£╝ļĪ£, Ļ▓Ćņ¦äņé¼ņŚģ ļ░Å ņ¦äļŗ©ĻĖ░ņłĀņØś ļ░£ļŗ¼ļĪ£ ņØĖĒĢ┤ ņĀäņ▓┤ ņ£äņĢö ņżæ ņĪ░ĻĖ░ ņ£äņĢöņ£╝ļĪ£ ņ¦äļŗ©ļÉśļŖö ļ╣äņ£©ņØĆ ņĀÉņ░© ņ”ØĻ░ĆĒĢśĻ│Ā ņ׳ņŖĄļŗłļŗż. Ļ│╝Ļ▒░ ņłśņłĀļĪ£ ņ╣śļŻīĒĢśļŹś ņ£äņĢöņØĆ ņ╣śļŻī ļé┤ņŗ£Ļ▓Į ņŗ£ņłĀņØś ļ░£ļŗ¼ļĪ£ ņØĖĒĢ┤ņä£ ļ”╝ĒöäņĀł ņĀäņØ┤Ļ░Ć ņŚåļŖö ņĪ░ĻĖ░ ņ£äņĢöņØś Ļ▓ĮņÜ░ ļé┤ņŗ£Ļ▓Į ņĀÉļ¦ēĒĢśļ░Ģļ”¼ņłĀņØ┤ ņłśņłĀĻ│╝ ļ╣äņŖĘĒĢ£ ņ╣śļŻī ņä▒ņĀüņØä ļ│┤ņŚ¼ ņĪ░ĻĖ░ ņ£äņĢöņØś ņŻ╝ņÜöĒĢ£ ņ╣śļŻīļ▓Ģņ£╝ļĪ£ ĒÖĢļ”ĮļÉśņ¢┤ ņ׳ļŗż[4,5,12]. ļĀłņØ┤ņĀĆļŖö ļ¼╝ļ”¼ĒĢÖņĀü ĒŖ╣ņä▒ņāü ļ│æļ│ĆņØś Ēæ£ņŗ£, ņĀłĻ░£, ņĀłņĀ£, ņ¦ĆĒśł ļō▒ņØś ņŗ£ņłĀņØä ļÅÖņŗ£ņŚÉ ĒĢĀ ņłś ņ׳ļŖö ņןņĀÉņØ┤ ņ׳ļŖö ļČĆņåŹĻĖ░ĻĄ¼ļĪ£ Ļ│╝Ļ▒░ Nd-YAG laser ļō▒ņØ┤ ĒśłĻ┤Ć ĻĖ░ĒśĢ ļ░Å ņóģņ¢æņä▒ ļ│æļ│ĆņØś ņ╣śļŻī ļō▒ņŚÉ ņØ┤ņÜ®ļÉśņŚłĻ│Ā[13,14], ņĄ£ĻĘ╝ņŚÉļŖö ĻĄŁļé┤ ņØśļŻīņ¦äņØ┤thulium ļĀłņØ┤ņĀĆļź╝ ņØ┤ņÜ®ĒĢ£ ļé┤ņŗ£Ļ▓Į ņĀÉļ¦ēĒĢśļ░Ģļ”¼ņłĀ ņŗ£ņłĀ ņä▒ņĀüņØä ļ│┤Ļ│ĀĒĢ£ ļ░ö ņ׳ļŗż[15]. 1916ļģäņŚÉ EinsteinņŚÉ ņØśĒĢ┤ ņ£ĀļÅä ļ░®ņČ£ņŚÉ Ļ┤ĆĒĢ£ Ļ░£ļģÉņØ┤ ņĀĢļ”¼ļÉśĻ│Ā, 1960ļģä MaimanņØ┤ ļŻ©ļ╣ä ļĀłņØ┤ņĀĆļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņĄ£ņ┤łņØś ļĀłņØ┤ņĀĆļź╝ ņåīĻ░£ĒĢśņśĆĻ│Ā, 1970ļģäņŚÉ N. Basov ļō▒ņØ┤ ņŚæņŗ£ļ©Ė ļĀłņØ┤ņĀĆļź╝ ļ░£ļ¬ģĒĢśņŚ¼ ņŗżņĀ£ ņ╣śļŻīņŚÉ ĒÖ£ņÜ®ļÉśņŚłļŗż. ļĀłņØ┤ņĀĆĻ░Ć ņŗżņĀ£ ņ×äņāüņŚÉ ņĀüņÜ®ļÉśļŖö ļČäņĢ╝ļŖö Ēö╝ļČĆļ░ĢĒö╝ņłĀ, ĒśłĻ┤Ćņä▒ ļ│æļ│ĆņØś ņ¦ĆĒśł, ņāēņĪ░ ņ╣©ņ░® ņĀ£Ļ▒░ ļ░Å ņĀ£ļ¬© ļō▒ņŚÉ ļ¦ÄņØ┤ ĒÖ£ņÜ®ļÉśĻ│Ā ņ׳ļŗż. ļĀłņØ┤ņĀĆ ņ╣śļŻīĻ░Ć Ļ░Ćņן ĒÖ£ļ░£ĒĢśĻ▓ī ņĀüņÜ®ļÉśļŖö ļČäņĢ╝ļŖö Ēö╝ļČĆĻ│╝ļéś ņĢłĻ│╝ ņśüņŚŁņØ┤ļØ╝ ĒĢĀ ņłś ņ׳ļŖöļŹ░, ļĀłņØ┤ņĀĆņØś ņóģļźśņÖĆ ņØ┤ņŚÉ ļö░ļźĖ ņ╣śļŻī ņśüņŚŁņØĆ Ēæ£ 1Ļ│╝ Ļ░Öļŗż.
ļĀłņØ┤ņĀĆļŖö ņ£ĀļÅä ļ░®ņČ£ Ļ│╝ņĀĢņŚÉ ņØśĒĢ£ ļ╣øņØś ņ”ØĒÅŁņØ┤ļØ╝ ĒĢĀ ņłś ņ׳ļŖöļŹ░, ņ£ĀļÅä ļ░®ņČ£ļĪ£ ļ╣øņØ┤ ņ”ØĒÅŁļÉśļ®┤ ĒĢ£ Ļ░Ćņ¦Ć Ēīīņןļ¦īņØä Ļ░Ćņ¦ä ļÅģĒŖ╣ĒĢ£ ĒŖ╣ņä▒ņØś ļ╣øņØ┤ ļ¦īļōżņ¢┤ņ¦ĆĻ│Ā, ņØ┤ļŖö ļĀłņØ┤ņĀĆ ņ╣śļŻīĻ░Ć ļŗżļźĖ Ļ││ņŚÉ ņśüĒ¢źņØä ņŻ╝ņ¦Ć ņĢŖĻ│Ā, ņøÉĒĢśļŖö Ļ││ņŚÉ ņ╣śļŻīļź╝ ĒÜ©Ļ│╝ņĀüņ£╝ļĪ£ ĒĢĀ ņłś ņ׳ļŗż. ļĀłņØ┤ņĀĆņØś ņóģļźśņŚÉ ļö░ļźĖ ĒīīņןĻ│╝ Ēł¼Ļ│╝ Ļ╣ŖņØ┤ņŚÉ ļīĆĒĢ£ ļé┤ņÜ®ņØĆ ĻĘĖļ”╝ 1Ļ│╝ Ļ░Öļŗż.
ļĀłņØ┤ņĀĆļź╝ ņØ┤ņÜ®ĒĢ£ ļé┤ņŗ£Ļ▓Į ņ╣śļŻīņØś ņøÉļ”¼ļŖö ņŚ┤ņŚÉļäłņ¦ĆņŚÉ ņØśĒĢśņŚ¼ ņĪ░ņ¦üņØä ņŚ░ņåī, ņØæĻ│Ā, ĒīīĻ┤┤ ļ░Å ņ”Øļ░£ņØä ņ£ĀļÅäĒĢśņŚ¼ ļ│æļ│ĆņØä ĒÜ©Ļ│╝ņĀüņ£╝ļĪ£ ņĀ£Ļ▒░ĒĢĀ ņłś ņ׳ļŖöļŹ░ ĻĘĖ ņøÉļ”¼ļŖö ĻĘĖļ”╝ 2ņÖĆ Ļ░Öļŗż.
Ļ░Ćņן ļ¦ÄņØ┤ ņĢīļĀżņ¦ä ļĀłņØ┤ņĀĆļĪ£ Nd-YAG ļĀłņØ┤ņĀĆļź╝ ļōż ņłś ņ׳ļŖöļŹ░, ĒīīņןņØĆ 1,064 mm ļĪ£ ņĀüņÖĖņäĀ ĻĘ╝ņ£ä ņśüņŚŁņŚÉ ņåŹĒĢśĻ│Ā, ņןĒīīņןņ£╝ļĪ£ ļłłņŚÉ ļ│┤ņØ┤ņ¦Ć ņĢŖņ£╝ļ®┤ņä£, ļ¬®Ēæ£ ļČĆņ£äņŚÉ He-Ne ļĀłņØ┤ņĀĆļź╝ ļ╣äņČöĻ│Ā, ļ░£ĒīÉņØä ļ░¤ņĢä ņł£Ļ░äņĀüņ£╝ļĪ£ Nd-YAG ļĀłņØ┤ņĀĆļź╝ ļ░£ņé¼ĒĢśņŚ¼ ņāØņ▓┤ ņĪ░ņ¦üņŚÉņä£ ņŚ┤ļĪ£ ņĀäĒÖśļÉ£ļŗż[16,17]. 1960ļģä LiptonņØĆ ņóģņ¢æņ╣£ĒÖöņä▒Ļ│╝ Ļ┤æĻ░Éņłśņä▒ņØ┤ ņ׳ļŖö ĒŚżĒīīĒåĀĒÅ┤Ēö╝ļ”░(hepatoporphyrin)ņØä Ļ░£ļ░£ĒĢśņśĆĻ│Ā, 1976ļģä TomsonņØĆ ņźÉņØś Ēö╝ĒĢśņŚÉ ņĢöņäĖĒżļź╝ ņØ┤ņŗØĒĢśĻ│Ā, Ļ┤æĻ░Éņłśņä▒ ļ¼╝ņ¦łņØĖ acridine oragneļź╝ ņźÉņØś ļ│ĄĻ░ĢņŚÉ Ēł¼ņŚ¼ĒĢ£ Ēøä, ņĢäņŻ╝ ņĢĮĒĢ£ ņĢäļź┤Ļ│ż ļŗżņØ┤ ļĀłņØ┤ņĀĆļź╝ ņĪ░ņé¼ĒĢśņŚ¼ ņóģņ¢æļ¦ī ņäĀĒāØņĀüņ£╝ļĪ£ ĒīīĻ┤┤ĒĢśņśĆļŖöļŹ░, ņØ┤ļ¤░ ĒśäņāüņØä Ļ┤æĒÖöĒĢÖļ░śņØæņØ┤ļØ╝ ļ¬ģļ¬ģĒĢśņśĆļŗż. ĻĘĖļ”¼Ļ│Ā 1975ļģä DoughertyļŖö ĒŚżĒīīĒåĀĒÅ┤Ēö╝ļ”░ņØä ņĀäņ▓śņ╣śĒĢ£ ļÅÖļ¼╝ņØś ņóģņ¢æņŚÉ ņłśņØĆņØä ņĪ░ņé¼ĒĢśņŚ¼ ņ╣śļŻīļÉ©ņØä ļ│┤Ļ│ĀĒĢśņśĆļŗż. Thulium ļĀłņØ┤ņĀĆļŖö Ļ░ĆļŖśĻ│Ā, ņ£ĀņŚ░ĒĢ£ ļĀłņØ┤ņĀĆ ņä¼ņ£Āļź╝ ĒåĄĒĢśņŚ¼ ņ¦ĆņåŹņĀüņ£╝ļĪ£ 2-um ĒīīņןņØś ļĀłņØ┤ņĀĆļź╝ Ēł¼ņé¼ĒĢśņŚ¼ Ļ╣ŖņØĆ ņĪ░ņ¦üņØś ņåÉņāüņŚåņØ┤ ņĄ£ļīĆ 0.25 mm Ļ╣ŖņØ┤Ļ╣īņ¦Ć ņĪ░ņ¦üņØä ĒåĄĻ│╝ĒĢśņŚ¼ ļ╣äĻĄÉņĀü ņĢłņĀäĒĢśĻ▓ī ņ£äņĢö ņĪ░ņ¦üņØä ņĀ£Ļ▒░ĒĢĀ ņłś ņ׳ļŗż[6,8].
2015ļģäņŚÉ ņŚŁĒ¢ēņä▒ ļŗ┤ļÅäņĪ░ņśüņ┤¼ņśüņłĀĻ│╝ Ļ▓ĮĻĄ¼ ņĘīļŗ┤ļÅäļé┤ņŗ£Ļ▓ĮņØä ĒåĄĒĢ£ ļĀłņØ┤ņĀĆ lithotripsy ņ╣śļŻīņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼Ļ░Ć ņ׳ņŚłļŖöļŹ░[18], ņØ┤ļŖö ļ»ĖĻĄŁņŚÉ 4Ļ░£ņØś ĻĖ░Ļ┤ĆņØ┤ 2008ļģä 10ņøöļČĆĒä░ 2011ļģä 9ņøöĻ╣īņ¦Ć ĒøäĒ¢źņĀü ļČäņäØ ņŚ░ĻĄ¼ļź╝ ĒåĄĒĢśņŚ¼ ņ¦äĒ¢ēļÉśņŚłļŗż(Table 2). ņ┤Ø 28ļ¬ģņØś ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ĒÅēĻĘĀ ļéśņØ┤ļŖö 51ņäĖņśĆĻ│Ā, ņ┤Ø 28ļ¬ģ ņżæ 3ļ¬ģņŚÉņä£ ļĀłņØ┤ņĀĆ litotripsyĻ░Ć ņŗżĒī©ĒĢśņśĆĻ│Ā, ņŗżĒī©ĒĢ£ ĒÖśņ×ÉļŖö ļ¬©ļæÉ per oral pancreatoscopy-electrohydraulic lithotripsy ļ░®ļ▓Ģņ£╝ļĪ£ ņćäņäØĒĢśņśĆļŗż.
ņØ╝ļ░śņĀüņ£╝ļĪ£, ņĘīņן Ļ▓░ņäØņØĆ ņ▓┤ņÖĖņČ®Ļ▓®ĒīīņćäņäØņłĀņØä ĒåĄĒĢśņŚ¼ 90% ņĀĢļÅäļŖö ņĀ£Ļ▒░Ļ░Ć Ļ░ĆļŖźĒĢśĻ│Ā, ļ│ĄĒåĄņØ┤ļéś Ēö╝ļČĆ ņ×ÉĻĘ╣Ļ│╝ Ļ░ÖņØĆ ļČĆņ×æņÜ®ņØ┤ ņØ╝ļČĆ ņ׳ņ£╝ļéś, Ļ░ĆĻ▓®ņØ┤ ļ╣äņŗĖņä£ ĻĖ░ĻĄ¼ļź╝ ņé¼ņÜ®ĒĢśņ¦Ć ļ¬╗ĒĢśĻ▒░ļéś, ņłśļ®┤ ņ¦äņĀĢ Ēś╣ņØĆ ņĀäņŗĀ ļ¦łņĘ©ļź╝ ĒĢśĻ│Ā, ņŚ¼ļ¤¼ ļ▓łņŚÉ Ļ▒Ėņ│É ņŗ£ņłĀņØä ĒĢ┤ņĢ╝ ĒĢśļŖö ļŗ©ņĀÉņØ┤ ņ׳ļŗż. ĻĘĖļ¤¼ļéś POP-ļĀłņØ┤ņĀĆ lithotripsyļŖö ņāüĒśĖļ│┤ņÖäņĀüņØĖ ņ╣śļŻīļĪ£ ĒÜ©Ļ│╝ņĀüņØ┤ļØ╝Ļ│Ā ĒĢĀ ņłś ņ׳ļŗż. Park ļō▒[19]ņØĆ gastrojejunostomyļź╝ ņŗ£Ē¢ēĒĢśņśĆļŹś ĒÖśņ×ÉņØś ļ¼ĖĒĢ®ļČĆņŚÉ ņāØĻĖ┤ dieulafoy ļ│æļ│ĆņØä 60 watts. 0.5ņ┤łĻ░ä ļĀłņØ┤ņĀĆļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņ¦ĆĒśłĒĢ£ Ļ▓ĮĒŚśņØä ļ│┤Ļ│ĀĒĢ£ ļ░ö ņ׳ļŗż.
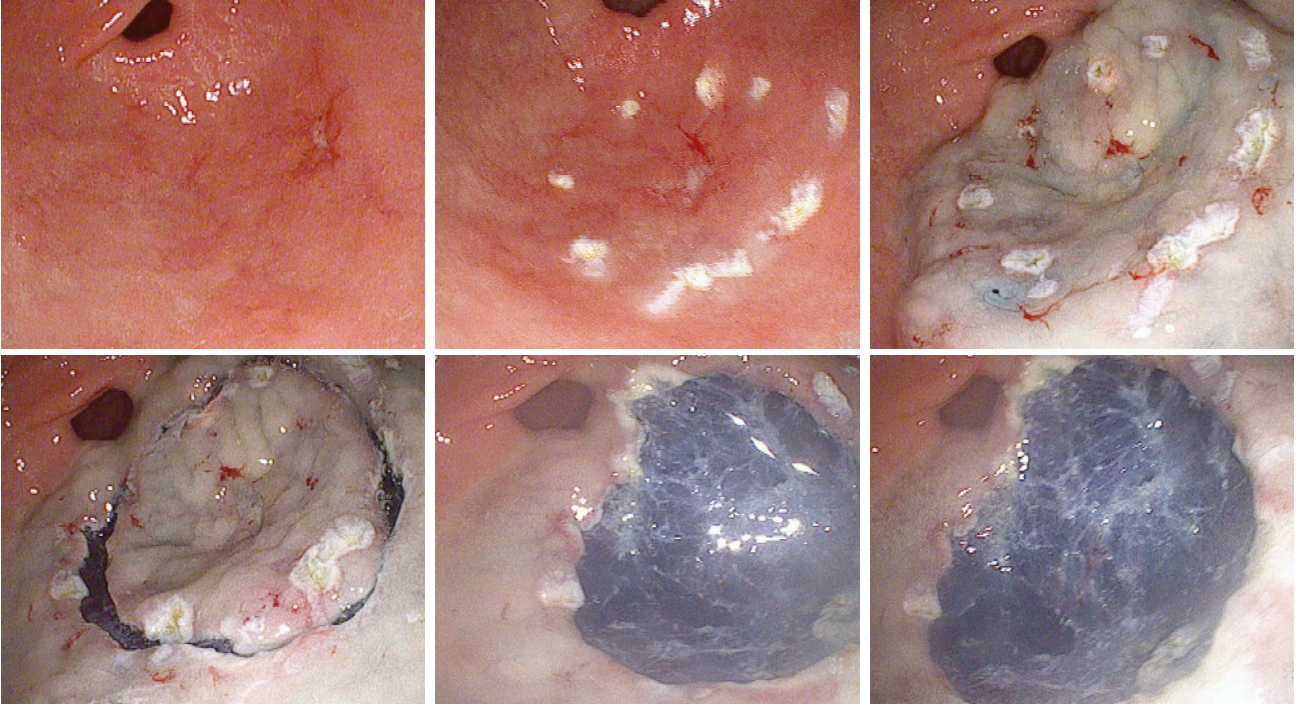
ļŗżņØ┤ņśżļō£ ļĀłņØ┤ņĀĆ(diode laser) [20], thulium ļĀłņØ┤ņĀĆ[21] ļō▒ņØä ņØ┤ņÜ®ĒĢśņŚ¼ ņČ£ĒśłņØś ņ¦ĆĒśł ļ░Å ņĪ░ĻĖ░ ņ£äņĢöņØś ņĀłņĀ£ņŚÉ ņØ┤ņÜ®ļÉśĻ│Ā ņ׳ļŗż. ņØ┤ņĀäņØś ļ│┤Ļ│ĀļŖö ņØ╝ļČĆ ļÅÖļ¼╝ļ¬©ļŹĖņŚÉņä£ ņŗżĒŚśņĀüņ£╝ļĪ£ ņŗ£Ē¢ēļÉśņ¢┤ņĪīļŖöļŹ░, Cho ļō▒[15]ņØĆ, thulium ļĀłņØ┤ņĀĆļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņ£äņāüĒö╝ņóģņ¢æ ĒÖśņ×É 10ļ¬ģ(low grade dysplasia 4ļ¬ģ, differentiated adenocarcinoma 5ļ¬ģ, signet ring cell carcinoma 1ļ¬ģ)ņŚÉņä£ ņ▓śņØīņ£╝ļĪ£ ESDņŚÉ ņĀüņÜ®ĒĢśņŚ¼ ņ╣śļŻīĒĢ£ Ēøä ļ│┤Ļ│Āļź╝ ĒĢśņśĆļŖöļŹ░, ņŗ£ņłĀ ņżæ ļŗżļźĖ ļéśņØ┤Ēöäļź╝ ņĀäĒśĆ ņō░ņ¦Ć ņĢŖĻ│Ā, ņśżņ¦ü thulium ļĀłņØ┤ņĀĆļ¦īņØä ņé¼ņÜ®ĒĢśņŚ¼, ņÖäņĀä ņĀłņĀ£ņ£© 90%ņśĆĻ│Ā, 80%ņŚÉņä£ļŖö ņØśļ»Ė ņ׳ļŖö ņČ£Ēśł ņŚåņØ┤ ĒÅēĻĘĀ 49ļČäĻ░Ćļ¤ēņØś ņŗ£Ļ░ä ļé┤ņŚÉ ņŗ£ņłĀņØä ņóģļŻīĒĢĀ ņłś ņ׳ņŚłļŗż(Fig. 3, Table 3).
ļĀłņØ┤ņĀĆļź╝ ņØ┤ņÜ®ĒĢ£ ESD ņŗ£ņłĀņŚÉņä£ ļ¬ć Ļ░Ćņ¦Ć ņāØĻ░üĒĢ┤ņĢ╝ ĒĢĀ ļČĆļČäņØĆ ņĀłĻ░£(incision)ļź╝ Ļ░ĆĒĢĀ ļĢī ņŗ£Ļ░äņØ┤ ņāØĻ░üļ│┤ļŗż ļ¦ÄņØ┤ Ļ▒Ėļ”┤ ņłś ņ׳Ļ│Ā, ņØ┤ļŖö Ļ╣ŖņØĆ ņĪ░ņ¦üņØś ņåÉņāüņØä ņĄ£ņåīļĪ£ ĒĢśĻĖ░ ņ£äĒĢśņŚ¼ ņóĆ ļŹö ņĪ░ņŗ¼ĒĢ┤ņä£ ĒĢśļĀżĻ│Ā ĒĢ┤ņä£ ļ░£ņāØĒĢĀ ņłś ņ׳ļŗż. ļīĆņŗĀņŚÉ ņĀÉļ¦ēĒĢśņĖĄ Ļ│ĄĻ░äņØ┤ ļģĖņČ£ļÉ£ ņØ┤ĒøäņŚÉļŖö ļ░Ģļ”¼ļź╝ ĒĢĀ ļĢī mucosal flapņØä ļö░ļØ╝ņä£ ņóĆ ļŹö ņēĮĻ▓ī ņ¦äĒ¢ēĒĢĀ ņłś ņ׳ļŗż. ņé¼ņÜ®ĒĢśļŖö ļĀłņØ┤ņĀĆ ņä¼ņ£Ā ļ¦Éļŗ© ļČĆņ£äļŖö needle knifeņÖĆ ņ£Āņé¼ĒĢśĻ▓ī ņāØĻ▓╝Ļ│Ā, ļĀłņØ┤ņĀĆ ļ╣öņØĆ ļ¬®Ēæ£ĒĢśļŖö ļČĆņ£ä, ņĪ░ņ¦üņ£╝ļĪ£ ņØ╝ņ¦üņäĀņ£╝ļĪ£ ņĀäļŗ¼ļÉśĻĖ░ ļĢīļ¼ĖņŚÉ, ņĀłĻ░£ ņĀäņŚÉ ņĀÉļ¦ēĒĢś ņĀÉņĢĪ ņŻ╝ņ×ģņŗ£ ņČ®ļČäĒĢ£ ņ¢æņØä ņĀÉņŻ╝ĒĢśņŚ¼ ņĀüņĀłĒĢśĻ│Ā ņĢłņĀäĒĢ£ ņŗ£ņłĀņØ┤ ļÉśļÅäļĪØ ĒĢ┤ņĢ╝ ĒĢ£ļŗż. ĒĢśņ¦Ćļ¦ī, ņŗżņĀ£ ņŗ£ņłĀĒĢ£ ĒÖśņ×É ņłśĻ░Ć ļäłļ¼┤ ņĀüņ¢┤ ņØ╝ļ░śņĀüņØĖ ļ░®ļ▓ĢņØä ņé¼ņÜ®ĒĢ£ ESD Ļ▓░Ļ│╝ņÖĆ ļ╣äĻĄÉĒĢśĻĖ░ņŚÉļŖö ļ¼┤ļ”¼Ļ░Ć ņ׳Ļ│Ā, Ē¢źĒøä ņČöĻ░ĆņĀüņØĖ ļīĆĻĘ£ļ¬© ļ╣äĻĄÉ ļīĆņĪ░ ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢĀ Ļ▓āņ£╝ļĪ£ ņāØĻ░üĒĢ£ļŗż.
Ļ▓░ ļĪĀ
ņĪ░ĻĖ░ ņ£äņĢöņØś ļé┤ņŗ£Ļ▓ĮņĀü ņ╣śļŻīļĪ£ ESDļŖö ņØ┤ņĀ£ ņĀÉļ¦ēņĢöņŚÉ ĒĢ£ĒĢ┤ņä£ Ļ░Ćņן ĻĘ╝Ļ░äņØ┤ ļÉśļŖö ņ╣śļŻīļĪ£ ņ×Éļ”¼ļź╝ ņ×ĪņĢśņ¦Ćļ¦ī, ņŚ¼ļ¤¼ Ļ░Ćņ¦Ć ļČĆņåŹĻĖ░ĻĄ¼ņØś ņé¼ņÜ®ļ┐Éļ¦ī ņĢäļŗłļØ╝, Ļ│╝Ļ▒░ļČĆĒä░ ņŚ┤ņŚÉļäłņ¦Ćļź╝ ņØ┤ņÜ®ĒĢ£ ļĀłņØ┤ņĀĆļź╝ ņØ┤ņÜ®ĒĢ£ ESDĻ░Ć ļ╣äĻĄÉņĀü ņĢłņĀäĒĢśĻ│Ā, ĒÜ©ņ£©ņĀüņ£╝ļĪ£ ļČĆņåŹĻĖ░ĻĄ¼ļź╝ ļīĆņŗĀ ĒĢĀ ņłś ņ׳ļŖö Ļ░ĆļŖźņä▒ņØ┤ ņŚ░ĻĄ¼ļÉśĻ│Ā ņ׳ļŗż. ĒĢśņ¦Ćļ¦ī ņĢäņ¦üĻ╣īņ¦ĆļŖö ņŗżņĀ£ ņ×äņāüņŚÉņä£ ņŗ£Ē¢ēĒĢ£ ĒÖśņ×É ņłśĻ░Ć ņĀüņ¢┤ ĻĘĖļīĆļĪ£ ņĀüņÜ®ĒĢśĻĖ░ņŚÉļŖö ļ¼┤ļ”¼Ļ░Ć ņ׳ņ¢┤ ņČöĻ░ĆņĀüņØĖ ļīĆĻĘ£ļ¬© ļ╣äĻĄÉ ņŚ░ĻĄ¼ļź╝ ĒåĄĒĢ£ Ļ▓░Ļ│╝ļź╝ ļ░öĒāĢņ£╝ļĪ£ ņ×äņāüņŚÉ ņĀüņÜ®ĒĢĀ ņłś ņ׳ņ£╝ļ”¼ļØ╝ ĻĖ░ļīĆĒĢ£ļŗż.



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






