 |
 |
| Korean J Med > Volume 98(1); 2023 > Article |
|
Abstract
Currently, antimicrobial resistance (AMR) is a major threat to global public health. To overcome this crisis, antimicrobial stewardship programs (ASPs) have been proposed. An ASP supports the optimal use of antimicrobials, including appropriate dosing decisions, as well as the duration and routes of administration. In South Korea, efforts are underway to overcome AMR through a national policy supporting ASPs. This study developed the core elements of an ASP for domestic medical facilities. Two Delphi surveys were conducted to select the core elements through expert consensus. The core elements for ASP implementation included leadership commitment, an operating system, action, tracking, reporting, and education. To ensure that these core elements are present in medical facilities, multiple departments must collaborate to support ASP operations. The establishment of a reimbursement system and workforce for ASPs are prerequisites for ASP implementation. The active implementation of core ASP elements in medical facilities requires the provision of financial support for the ASPs, cultivation of a healthcare workforce to perform ASPs, application of the core elements to healthcare accreditation, and provision of incentives to medical facilities via quality evaluation criteria.
항생제는 의학의 발전에 있어 지대한 영향을 미치고 있다. 항생제의 개발로 많은 감염 질환들을 치료할 수 있게 되었을 뿐 아니라 감염 질환 극복의 단초가 제공됨에 따라 항암요법과 장기이식과 같은 높은 수준의 의학기술도 발전할 수 있게 되었다. 그러나 현재 항생제 내성 문제는 전 세계적으로 심각한 문제로 대두되고 있다.
항생제의 부적절한 사용은 약제 부작용을 유발할 뿐 아니라 항생제 내성을 유발하는 주요 원인으로 제시되고 있다[1]. 2014년 영국에서 발표된 항생제 내성 보고서에서는 2050년까지 항생제 문제가 지속되었을 때 전 세계적으로 매년 1,000만명이 항생제 내성 문제로 사망할 것이라 예측하였는데, 이는 암으로 인한 사망보다 높은 수치이다[2]. 국내의 경우 2019년 전국 의료기관 대상의 항생제 처방 질적 평가에 따르면 전체 항생제 처방 중 26.1%가 부적절한 처방으로 확인되었다[3,4]. 2020년 국내 의료인 대상의 항생제 인식도 조사에서는 의사의 35% 이상이 항생제가 불필요한 상황임을 인지하고 있지만 항생제를 처방하는 경우가 있다고 답하였다[5].
항생제 내성균의 증가를 극복하기 위해서는 부적절한 항생제 사용을 최소화할 수 있는 다양한 전략이 필요하다. 대표적으로 항생제 치료가 필요한 환자에게 최적의 항생제가 적절한 용량과 적절한 기간 동안 투여될 수 있도록 유도하는 통합적 중재 전략들인 항생제 사용관리(스튜어드십) 프로그램(antimicrobial stewardship program, ASP)이 있다[6,7]. 이러한 활동을 통하여 감염 질환을 효과적으로 치료하고, 불필요한 항생제 사용으로 인한 피해로부터 환자를 보호할 뿐 아니라 항생제 내성균의 출현을 최소화할 수 있다[8].
세계보건기구(World Health Organization, WHO)는 2015년 5월 항생제 내성이 인류가 당면한 공중보건 위기라고 선언하였고, 세계보건총회에서는 항생제 내성 글로벌 행동계획(Global Action Plan on Antimicrobial Resistance)이 승인되어 전 세계적인 행동계획을 제시하여 시행하고 있다[9]. 우리나라는 항생제 사용량이 OECD 국가 전체 평균보다 1.6배 높은 국가이다. 2016년부터 정부 주도의 항생제 내성관리 정책이 시작되어 범부처 차원의 국가 정책 조정회의에서 ‘제1기 국가 항생제 내성 관리대책(2016-2020년)’을 발표하여 관리방안을 제시하였으나, 인체 항생제 사용 및 내성의 개선은 당초 기대에 비해 미흡했고 주요 항생제 내성률이 지속적으로 증가하는 현상이 관찰되었다. 현재는 ‘제2기 국가 항생제 내성 관리대책(2021-2025년)’이 시행 중이며 해당 대책에서 항생제 내성 극복을 위한 핵심 전략으로 국내 의료기관에서의 ASP 정착이 제시되었다[10,11]. 이를 위한 첫 단계는 국내 실정에 맞는 ASP 핵심요소를 개발하여 국내 의료기관에서의 ASP를 정의하는 작업이다[6]. 이에 급성기 병원에 해당하는 종합병원 이상 등급의 의료기관에 적용 가능한 ASP 핵심요소를 개발하기 위해 본 연구 과제가 진행되었다. 항생제 사용관리 프로그램을 실행할 수 있는 인력이나 비용에 대한 투자 여력이 의료기관 종별에 따라 현실적으로 큰 차이가 있다는 점을 감안하였을 때 미래에는 각 의료기관 종별 또는 상황별로 수행 가능한 핵심요소로 세분화하여 개발하는 것도 고려해야 할 것이다.
본 연구의 목적은 국내 의료환경의 특성을 반영한 ASP 실행을 위한 핵심요소를 개발하는 것이며, 이를 위해 체계적 문헌 고찰과 최신 문헌들을 정리하고, 감염내과 전문의를 비롯한 다양한 분야의 전문가들의 의견을 체계적으로 수렴하였다.
본 지침은 체계적 문헌 고찰을 기반으로 올바른 항생제 사용을 위한 ASP 실행을 위한 핵심요소의 근거를 제시한다. 2022년 현재 국내 상황을 고려하여 급성기병원에 해당하는 종합병원 이상 등급의 의료기관에 적용 가능한 ASP 핵심요소에 대해서 기술한다. 이 지침은 추후 국내 상황의 변화에 따라 개정될 필요가 있다.
2021년 11월 한국형 ASP 실행을 위한 핵심요소 개발위원회를 구성하였다. 근거 중심 및 다학제 접근을 기반으로 하는 지침 개발을 위해, 대한항균요법학회, 대한감염학회, 대한의료관련감염관리학회, 대한소아감염학회, 한국병원약사회에서 추천된 전문가 15명과 외부자문기관인 의료기관평가인증원과 건강보험심사평가원에서도 집필에 참여하였다.
ASP 관련 문헌과 국내외 ASP 도입 사례를 체계적 문헌 검색을 통해 조사하고, 기존 임상진료 지침도 검토하였다. 본 임상진료 지침 제정을 위한 주요 검색 데이터베이스는 국외 문헌의 경우 PubMed (https://pubmed.ncbi.nlm.nih.gov/), Cochrane Library (https://www.cochranelibrary.com/) 및 EMBASE (https://www.embase.com/)를 이용하였고, 국내 문헌의 경우 한국의학논문데이터베이스(KMBASE, https://kmbase.medric.or.kr/) 와 학술연구정보서비스(Research Information Sharing Service, RISS, http://www.riss.kr/index.do)를 활용하였다. 그 밖에 ASP 도입 사례를 분석하기 위해 해외 국가의 지침을 검토하였고, 본 지침에 총 135개의 참고문헌을 인용하였다.
본 지침은 각 의료기관이 ASP의 실행을 위한 핵심요소 개발과 함께 적용을 확인할 수 있는 체크리스트 작성을 중심으로 개발되었다. 작성된 체크리스트 항목의 수행 가능성, 중요도, 시행 가능 시기에 대해 참여 연구원과 자문위원의 합의를 도출하기 위해 델파이 조사를 시행하였다.
병원 경영진은 ASP를 실행하기 위해 병원의 다양한 부서들이 프로그램에 협조하도록 운영할 책임이 있다. 따라서, 병원 경영진은 항생제 사용관리 프로그램의 중요성을 인식하고 필요한 조직, 인력, 예산 및 정보 기술 등 충분한 자원을 지원해야 한다.
1. 병원은 병원 경영진이 참여하는 항생제 사용관리 위원회를 운영하기 위한 규정을 수립하고, 정기적으로 위원회를 개최한다.
2. 병원 경영진은 항생제 사용관리 프로그램 시행에 필요한 예산을 배정하고 인력을 배치한다.
3. 병원 경영진은 항생제 사용관리 프로그램 시행을 기관의 우선 목표로 정하고, 성과를 측정하기 위한 지표를 정하여 관리한다.
① 항생제 사용관리 활동에 필요한 자원(인력, 조직, 예산)을 지원하고, 결과에 대해서 책임을 질 수 있는 경영진이 항생제 사용관리 위원회에 참여하여야 한다.
② 항생제 사용관리 위원회는 정기적인 회의를 개최하여 ASP의 수행 내용과 결과 및 필요 자원에 대해 심의하고 의결하도록 한다.
③ 항생제 사용관리 위원회는 의료기관의 사정에 맞추어 독립적으로 운영하거나, 의약품관리(약사)위원회, 감염관리위원회, 질향상위원회 또는 환자안전위원회의 하부 위원회 형태로 구성하여 운영할 수 있다. 항생제 사용관리 위원회를 독립적으로 운영하지 않는 경우에는 항생제 사용관리에 대한 안건을 반드시 고정된 별도의 항목으로 구분하여 운영한다.
④ ASP의 성과를 측정하기 위한 지표는 항생제 사용관리 프로그램 실행을 위한 핵심요소 중 추적조사의 구성요소에서 의료기관의 사정에 맞게 선택해 선정할 수 있다.
병원의 고위 경영진, 특히 의료기관장, 간호 책임자 및 약제부서 책임자의 지원은 ASP의 성공에 매우 중요하며, ASP의 목표를 달성하는 데 필요한 인적, 물적 자원을 확보하는데 중요한 역할을 한다[7]. 병원 경영진이 항생제 사용관리의 중요성을 인식하고 필요한 인적, 재정적, 정보기술적 자원을 마련해 주어야 ASP의 역량과 영향력을 증가시킬 수 있기 때문이다. 예를 들어, 기관장은 ASP의 책임자들에게 매일 프로그램을 관리하고 수행할 수 있는 시간을 마련해 주고, 항생제 사용 개선을 위한 병원의 목표를 달성하는데 필요한 자원을 평가하기 위해 정기적으로 회의를 개최하는 등의 노력이 필요하다. 또한 ASP에 종사하는 직원의 직무 기술서에 ASP 관련 업무가 공식적으로 포함되어야 하고 관련 업무에 종사할 충분한 시간이 보장되어야 한다.
의료기관의 경영진이 ASP에 인력과 재정을 투입할 수 있도록 정부에서는 항생제 사용관리 활동에 대한 적정한 수가 책정 등으로 의료기관에 보상을 해 주어야 한다. 항생제 사용관리를 적절하게 수행하면 항생제 사용을 최적화하고, 항생제 내성과 Clostridioides difficile (C. difficile) 감염을 최소화할 수 있다는 것은 이미 잘 알려져 있다[12,13]. 또한, ASP는 병원과 의료자원의 사용을 감소시켜, 궁극적으로는 의료 비용을 절감하기 때문에, 이렇게 절약한 재원은 ASP에 종사하는 직원과 프로그램 운영에 필요한 재정을 지원하는 데에 사용될 수 있으므로, 이런 순기능이 있다는 것을 병원 경영진이 인지하고, 의지를 가지고 추진해야 한다[14]. 또한 지속적인 ASP 활동에 대해서 병원 경영진은 활동 내용과 결과를 주기적으로 보고받아야 하고 시스템을 개선할 수 있도록 지원해야 한다.
병원 경영진은 다학제의 항생제 사용관리 전담팀(이하 ‘전담팀’이라 함)을 구성하여 운영할 책임이 있다. 전담팀은 항생제 사용에 대한 전문지식을 가진 의사를 책임자로 하며, 항생제 사용에 대한 지식을 가진 전담 약사를 포함하고, 기타 의료기관이 필요로 하는 직원으로 구성하여 ASP를 운영 한다.
1. 항생제 사용관리 프로그램을 운영하는 전담 직원과 전담팀이 있고, 역할과 수행 절차에 대한 규정이 있다.
2. 항생제 사용관리 프로그램을 수행하는 전담팀은 의사, 약사, 간호사, 임상미생물 전문가, 감염관리 전문가, 정보기술 전문가 등을 포함하는 다학제로 구성된다.
3. 항생제 사용관리 프로그램의 운영을 책임지는 책임자가 있다.
4. 항생제 사용관리 프로그램에 대한 교육을 수료하고, 활동을 하는 전담 약사가 있다.
① ASP를 운영하는 전담 직원은 항생제 사용관리 업무 이외의 다른 업무는 하지 않는 직원을 이르며, 직무기술서에 관련 업무가 공식적으로 포함되어야 한다.
② 전담 직원은 ASP에 대한 교육을 수료하고 주기적으로 이수하여야 한다.
③ ASP를 성공적으로 구현하기 위해서는 의사, 약사, 간호사, 임상 미생물 전문가, 감염관리 전문가, 정보기술 전문가들이 다학제 팀을 구성하여 협업해야 한다.
④ 임상 경험, 리더십 경험, 폭넓은 다학제 관계 및 수련 과정을 기반으로 감염내과 혹은 소아청소년과 감염분과 전문의를 ASP 다학제 팀을 운영하는 책임자로 권장한다.
⑤ ASP를 운영하는 전담팀의 구성, 역할 및 수행 절차, 업무시간은 공식 문서로 규정되어야 한다.
⑥ 항생제 사용관리에 대한 교육을 받은 약사가 ASP 전담팀의 핵심 구성원이 되어야 한다. 약사는 중재 및 피드백을 통한 전향적 감시, 교육, 항생제 사용에 대한 업무구조 개발 및 추적, 항생제와 감염병 관련 정책 및 지침 수립을 포함하는 적절한 항생제 사용을 지원한다.
의사, 약사, 간호사, 임상 미생물 전문가 및 감염관리 전문가, 정보기술 전문가들의 일상적인 협력은 항생제 사용관리의 핵심 활동이다[7]. ASP를 성공적으로 구현하기 위해서는 이들의 전문지식을 활용할 수 있는 다학제 팀이 필요하며, 병원 경영진과 관련 위원회 구성원들은 항생제 사용관리 전담팀을 지원하고 협력해야 한다(Fig. 1) [15].
내과와 소아청소년과 감염분과 전문의는 복잡한 감염질환의 진단과 치료, 적절한 항생제의 처방, 항생제 사용의 영향을 관리하는 업무를 일상적으로 수행하고 있으며, 많은 기관에서 감염관리 책임자나 질 향상 및 환자 안전 책임자의 역할을 통해 리더십 역량을 인정받고 있다[16]. 감염분과 전문의는 항생제 감수성 자료와 항생제 치료에 대한 연구 결과를 바탕으로 항생제 사용에 대한 지침을 개발하고, 항생제를 처방하는 의사에게 항생제 선택에 대한 직접적인 피드백을 제공하는 중재를 수행한다. 임상 경험, 리더십 경험, 폭넓은 다학제 관계 및 수련 과정을 고려하면, 감염분과 전문의는 ASP 전담팀 구성원의 잠재력을 극대화하여 항생제 사용관리를 효과적으로 수행할 수 있는 ASP 전담팀의 리더로서 적합하다[16].
미국 질병통제 예방센터(Centers for Disease Control and Prevention, CDC)에서는 ASP의 성공적인 수행을 위해 임상 의사나 약사들 중 1명을 책임자 혹은 공동 책임자로 임명하여 프로그램의 운영 및 결과에 대해 책임지게 할 것을 권고한다[17]. 2019년 국가 의료기관 안전 네트워크(National Healthcare Safety Network, NHSN) 조사에 따르면, 미국 내 병원의 59%가 의사와 약사가 공동으로 주도하는 ASP를 운영하고 있다. ASP 책임자들은 병원의 경영진과 위원회에 ASP의 결과에 대해 정기적으로 보고하며 규칙적인 항생제 사용관리 회진과 항생제를 처방하는 의료진과의 논의를 통해 항생제 사용을 개선시킬 수 있다[18,19].
호주에서는 ASP의 적용을 위해 적어도 한 명의 의사와 약사를 책임자로 포함하는 다학제 항생제 사용관리팀을 구성할 것을 권고한다. 전문 인력과 재정적 자원이 부족한 의료기관들을 위해 의료기관 종류와 규모에 따라 ASP 전담팀을 구성하는 인력과 역할을 다르게 제시하고 있다. ASP의 책임자는 감염분과 전문의나 감염약료 전문 약사(pharmacist specializing in infectious diseases), 임상 미생물학자가 하도록 되어있으나, 의료기관 내 전문 인력이 부족한 경우에는 의료기관의 관리자가 책임자 역할을 하면서 지역 네트워크를 통해 지역 내 약사나 감염분과 전문의 또는 임상 미생물학자의 조언을 받아 ASP를 운영하거나 방문 진료가 가능한 의사나 약사의 도움을 받아 운영하게 한다[20].
캐나다에서는 ASP의 운영 책임자 혹은 공동 책임자로 임상의와 함께 약사를 임명할 것을 권고하나 기관 내에 전문 인력이 없는 경우, 지역 내 외부 전문가의 참여를 통해 운영할 수 있다[21]. 캐나다의 73개 항생제 사용관리 프로그램 시행 병원을 대상으로 한 관찰 연구에서는 전문 인력이 책임자의 역할을 맡은 경우에 항생제 사용량이 감소하는 경향을 보였으나 보정분석에서는 유의한 차이를 보이지 않았다. 임상의와 약사와 같은 전문 인력이 ASP의 책임자를 맡는 것이 ASP의 효과적인 운영에 필요하나, 항생제 사용관리 업무를 수행할 수 있는 시간과 재정적 지원이 보장되어야 한다[22].
미국감염학회(Infectious Disease Society of America)의 ASP 적용 지침에서는 항생제 관리에 대한 전문지식과 경험을 가진 감염분과 전문의나 감염약료 전문 약사가 ASP의 운영에서 핵심적인 역할을 할 것을 권고한다[23]. 국내보다 먼저 ASP를 도입하여 적용 중인 여러 선진국에서도 운영에 필수적인 전문 인력 확충의 필요성을 강조하고 있다[24-28]. 일본에서는 2018년 전국적 조사(nationwide survey)를 바탕으로 ASP 관련 의료인력 자원의 상황을 파악하였고, 항생제 사용관리 전문 인력(full time equivalent, FTE)의 수가 ASP의 시행 및 향상과 독립적인 상관관계가 있음을 확인하였다[28,29]. 또한, 2018년 ASP에 참여하는 다학제 의료인력을 바탕으로 산출한 항생제 사용관리 시행 수가를 기존의 감염관리 수가에 가산하도록 의료비 지급 시스템(medical reimbursement system)을 개선하였다[28].
우리나라에서는 2020년 8개 의료기관에서 ASP 운영을 위해 필요한 인적 자원을 산출한 결과, 100병상당 필요한 FTE의 중앙값은 1.2명(사분범위, 1.02-1.38)이었고, 항생제를 사용하는 환자 100명당 필요한 FTE의 중앙값은 2.28명(사분범위, 1.93-2.62)이었다[30]. 이러한 국내의 현실을 감안한다면 종합병원 이상의 의료기관에서도 전문성을 가진 항생제 사용관리 책임자를 임명하는 것 자체가 어려우며, 해외 사례와 같이 지역 내 의료 네트워크의 도움을 받기도 힘들 정도로 전문 인력의 상황 자체가 열악하다. 국내 의료기관에서 ASP를 효과적으로 시행하기 위해서는 핵심적인 역할을 하는 전문 인력부터 확충해야 하므로 이를 위해서는 장기적으로 교육적, 경제적 지원이 바탕이 되어야 한다. 전문 인력의 부족은 일시적 지원이나 각종 평가만을 이용하는 단기적 방식으로는 해결할 수 없으며 오히려 의료기관에서 실질적인 책임자의 역할을 수행할 수 없는 비전문 인력을 형식적으로 동원하는 부적절한 변화를 유도할 위험이 있다. ASP에 전문 인력들이 적극적으로 활동하도록 참여를 유도하기 위해서는 책임자의 역할을 하는 감염분과 전문의의 항생제 사용관리 활 동에 대한 수가를 인정해 주고, 의사들이 전문 과목을 선택할 때 감염분과를 선택할 수 있도록 유도하는 합리적인 제도와 경제적 보상이 필요하다. 또한, 감염약료 전문 약사에 대해서도 항생제 관리 수가와 같은 보상 제도 등을 마련해 인력 양성을 유도해야 한다.
ASP팀에 참여하는 전담 약사는 항생제 사용량관리 업무, 항생제 사용 지침 개발, 항생제 사용관리 위원회 참여, 회진 및 컨퍼런스 참여, 항생제 부작용 모니터링 및 보고, 최신 치료 경향 파악 및 정보 제공, 교육 및 학술 연구 수행, 질 향상 활동 수행 등의 역할을 할 수 있다(Table 1) [31].
미국에서는 약사들이 책임자 또는 공동 책임자로 적극적으로 참여함으로써 병원에서 ASP가 효과적으로 운영될 수 있다고 보고하였다[32]. Waters의 연구에서 감염약료 전문 약사가 ASP의 책임자가 되어 다른 의료진들과 함께 팀 회진 등을 하며 활동한 결과 33개월 동안 2,457건의 처방 중재를 하였고, 처방 중재 수용률은 91.8%였다. 또한 이런 활동 덕분에 지역사회 폐렴으로 입원한 환자의 재원 기간을 통계적으로 유의하게 감소시키고, 2년여 동안 355,000달러(58%)의 비용 절감 효과가 있었다[33]. 일본에서는 약사들의 활동을 통해 적절한 항생제 사용 도모, 비용 절감 효과, 재원 기간 감소 효과를 보인 연구를 발표하였다[34]. 태국에서 수행한 연구에 따르면 감염약료 전문 약사를 교육 후 자문 업무를 수행하게 하여 자문을 실시한 군과 자문을 실시하지 않은 군을 비교한 결과, 실시한 군에서 부적절한 항생제의 사용, 재원 기간이 통계적으로 유의하게 감소한 결과를 보였다[35]. 중동지역에서 약사가 주도적으로 참여하는 항생제 사용관리 프로그램 효과를 알아보기 위한 메타분석 결과 ASP를 시행한 그룹에서 유의하게 부적절한 항생제 처방이 감소하는 것으로 분석되었다(relative risk, 0.36) [36].
최적의 항생제 처방을 지원하기 위해서는 다양한 중재 활동이 필요하다. 중재 활동으로는 항생제 투약의 필요성 여부, 적절한 항생제의 선택, 올바른 용법 및 적절한 투여 기간 등에 대한 평가 및 피드백 등이 있다.
1. 항생제 사용에 대한 감시와 피드백을 시행하고 있다.
2. 특정 항생제를 대상으로 처방 제한 및 승인 프로그램을 시행하고 있다.
3. 의료기관 내 항생제 관리 지침에 근거하여 항생제 사용을 추천하고 항생제 처방을 지원하는 항생제 처방 서식 또는 전산화된 항생제 처방 지원 시스템이 있다.
4. 의료기관 내 주요 감염 질환 대상 혹은 부수적인 항생제 사용관리 중재 활동을 하고 있다.
- 주요 감염 질환에는 요로감염, 지역사회 폐렴, 혈류감염, C. difficile 감염 등이 있다.
- 부수적인 항생제 사용관리 중재 활동에는 항생제 병합 치료 최소화, 항생제 하강(de-escalation) 치료, 항생제 최적 투약 기간 권고, 주사 항생제의 경구전환, 특정 항생제에 대한 치료 약물 모니터링(therapeutic drug monitoring, TDM) 활용, 미생물 검사 결과의 신속한 보고 등이 있다.
① 핵심 중재
- 특별히 관리가 필요한 항생제의 경우 사전 승인을 통해 항생제가 적절한 적응증에 올바르게 투약이 되는지 확인한다.
- 관리를 요하는 항생제에 대한 처방 제한과 승인 프로그램 활용한다.
- 국내 지침이나 해당 지역의 항생제 감수성 자료에 근거하여, 해당 의료기관에서 활용 가능한 항생제 치료 지침을 개발한다.
- 해당 의료기관에서 특정 임상 증후군별 표준화된 항생제 처방 서식을 개발하고 활용한다.
- 대한항균요법학회 홈페이지를 통해 안내되고 있는 Korean Society for Antimicrobial Therapy (KSAT) 항생제 처방 지원 프로그램(http://ksc.thepowerbrains.com/search/main.do)을 활용한다.
- 주요 감염 질환 환자에 대한 최적화된 항생제 처방 프로토콜 개발을 위해 관련부서들 간에 협력(예, 항생제 관리팀과 중환자실 협력)한다.
- 항생제 관리팀은 개별 의료진과 환자 치료에 대해 대면하여 협의한다.
② 추가 중재
- 항생제 투약 전 알레르기 여부를 평가한다.
- 항생제 초기 처방 48-72시간 후 처방된 항생제의 적절성을 평가하는 과정을 도입한다.
- 항생제 치료 지침에 따라 주사 항생제를 경구제로 변경한다.
- 환자의 체중, 신장 혹은 간 기능 등에 맞추어 용량을 권유하는 지침을 만들어 활용한다.
- 원인 미생물의 항생제 감수성에 맞추어 항생제 간소화 혹은 하강 치료(de-escalation)를 권유하는 지침과 시스템을 만들어 활용한다.
- 중복된 스펙트럼의 항생제 혹은 약물 상호작용에 근거한 자동 경보 시스템을 만들어 활용한다.
- 일정 기간 처방된 항생제에 대한 자동 중지 프로그램(예, 수술 예방적 항생제, 경험적 항생제)을 만들어 활용한다.
- 특정 항생제에 대한 TDM을 수행한다.
- 미생물 검사 결과의 신속한 보고를 위한 신속 진단 시스템을 구축하고 선택적 항생제 감수성 보고를 도입한다.
- 프로칼시토닌 등의 바이오마커를 도입하여 항생제 투약 기간 단축에 활용한다.
- 배양 검체는 항생제 투약 전에 적절한 방법으로 수집할 수 있도록 지침을 만들고 실시간으로 운송될 수 있는 시스템을 구현한다.
- 특정 감염 질환 및 의료기관별로 약속한 상황에서 항생제 사용을 개선하기 위한 방안에 대해 사전에 공유한다(예, 지역사회획득 폐렴, 요로 감염, 피부 및 연조직 감 염, 복강 내 감염증, 패혈증, 혈류감염[중심 정맥관 감염], 수술 예방적 항생제, 수술 부위 감염, 메티실린 내성황색포도알균[Methicillin-resistant Staphylococcus aureus, MRSA] 감염증이 의심되는 상황, 새로운 C. difficile 감염증 환자에서 다른 목적으로 사용되던 항생제 치료에 대한 평가, 오염된 검체나 집락 상태에 대한 부적절한 항생제 사용).
항생제 관리의 핵심 전략은 크게 두 가지가 있다. 전향적 감시와 피드백(prospective audit with feedback; back-end program) 프로그램과 처방 항생제 제한과 사전 승인(formulary restriction and preauthorization; front-end program) 프로그램으로 나눌 수 있다. 전향적 감시와 피드백은 항생제가 처방된 후 일정 시간이 지나서 관리자가 항생제 종류, 용량, 용법 등의 적정성을 평가하는 프로그램이고, 처방 항생제 제한과 사전 승인은 의료진이 환자에게 항생제를 처방하기 전에 특정 항생제에 대한 승인을 받아 사용함으로써 항생제 사용을 개선하는 프로그램이다(Fig. 2) [15].
전향적 감시와 피드백 프로그램의 장점은 처방하는 의료진의 자율성이 일부 보장되며 관리자와 처방 의료진이 서로 소통하며 긍정적인 관계 형성과 교육의 효과를 기대할 수 있다는 것이다. 항생제 관리 시점과 대상 항생제 종류의 조절 등을 통해, 관리자의 업무량을 활용 가능한 자원 수준으로 조절할 수 있다. 배양 검사 결과를 기반으로 중재가 이루어 질 수 있어 처방 의료진의 수용도를 높일 수 있고, 하강 치료와 투약 기간에 대한 논의가 가능하다. 반면, 관리자가 의료진들과 얼마나 효과적으로 소통하는지에 따라 의료진들의 적절한 항생제 처방 권고에 대한 순응도가 달라질 수 있고, 관리자의 노동 집약적인 작업이 될 수 있다[7,23,37,38]. 최근 알려진 악수 사용관리(handshake stewardship) 프로그램은 회진 기반의 개별적인 접근을 통해 의료진들에게 직접적이고 개별적인 피드백을 즉시 제공하는 접근 방식이다[19].
처방 항생제 제한과 사전 승인 프로그램은 의료진이 환자에게 항생제를 처방하기 전에 특정 항생제에 대한 승인을 받아 처방하는 전략이다. 반면, 전향적 감시와 피드백 프로그램은 항생제가 처방된 후 일정 시간이 지나서 관리자가 항생제 처방의 적정성을 평가하는 전략이다.
처방 항생제 제한과 사전 승인 프로그램의 장점은 불필요한 항생제 투약의 빈도를 감소시켜 항생제 사용량을 줄일 수 있으며, 초기부터 올바른 경험적 항생제가 투약될 가능성을 높일 수 있고, 짧은 시간 내에 항생제 처방 양상의 변화를 일으킬 수 있다는 점이고, 단점은 항생제 관리팀이 항생제 사용의 전반을 직접 조절하면서 의료진의 자율성이 상실될 수 있다는 점이다. 항생제 관리자의 숙련도에 따라 다양한 중재가 시행될 가능성이 있지만, 처방한 의사와 관리자 사이에 상호 대립 관계에서 기인하는 부정적인 상호작용이 일어날 수 있다. 또한 관리자들의 업무량이 증가되고, 근무 외 시간에 발생되는 사전 승인 요청의 처리가 문제가 되며, 꼭 필요한 항생제 투약이 지연될 수 있다[7,23,37]. 이러한 단점을 극복하기 위해, 미생물 검사 결과가 확인되고 경험적 항생제의 임상적인 반응 평가가 가능한 시점인 처방 후 3-5일에 항생제 사용을 제한하는 방법으로 운영되기도 한다[39].
두 가지 항생제 관리 전략은 서로 상호 배타적인 프로그램으로 둘 중 하나를 반드시 선택해야 하는 것이 아니라, 병원의 특성과 고유 문화, 의료진들의 태도, 활용 가능한 자원 그리고 핵심 전략 각각의 장점과 단점을 고려하여 대상 항생제나 환자 그룹에 따라 선별적으로 혼합하여 시행할 수 있다[40].
항생제 간소화(streamlining) 혹은 하강 치료는 불필요한 항생제 병합 요법을 줄이고, 더 좁은 항균 범위의 항생제로 변경하는 전략이다[41]. 대부분 광범위 항생제 혹은 항생제 병합 치료의 사용은 중증 감염증 환자를 대상으로 시작되는 경험적 항생제에서 흔하기 때문에 항생제 간소화 및 하강 치료를 지원하기 위해서는 원인균과 항생제 감수성 결과를 적극적으로 규명해야 한다[42,43]. 이를 위해서 가능하다면 항생제 투약 전 배양 검체를 적절한 방법으로 수집하고 실시간 운송 시스템이 구현되어야 한다.
교육(education)은 항생제 관리 중재의 중요한 요소로, 항생제 처방 행위에 직접적인 영향을 준다[44]. 강의를 하거나 인쇄물이나 이메일을 회람하는 수동적인 활동보다는 항생제 처방에 관한 대면 논의를 통한 교육 등의 능동적인 활동이 상대적으로 더 지속적인 효과를 보인다고 알려져 있다[45]. 교육의 대상은 의료진, 약사, 의사 보조인력(physician assistant), 간호사 등 다양한 의료 인력을 포함해야 한다. 특히, 의과대학생이나 간호대학생에 대한 교육의 필요성이 강조되고 있다[46].
의료기관의 특성에 맞춘 질환별 임상 진료 지침이나 치료 방침(practical guidelines and clinical pathways)은 질환별 임상 진료 지침을 다면적으로 공유하여, 해당 의료기관의 진료 행위를 지침에 맞게 개선하고 적절한 초기 경험적 항생제 투약의 빈도를 향상시킬 수 있다[47-49]. 진료 지침이나 치료 방침을 처방 과정에 반영하기 위해서, 처방 세트와 모범사례 경보(best practice alert)에 대한 체크리스트 등을 활용할 수 있다[50]. 진료 지침이나 치료 방침을 만들 때는 항생제 관리팀과 다양한 의료진들이 적극적으로 소통하며 함께 작성해야 한다. 그리고 의료기관 내 자체 지침을 활용하기 어려운 경우 대한항균요법학회 홈페이지를 통해 안내되고 있는 KSAT에 따라 임상 질환 증후군, 의심되는 감염 상황에 따른 경험적 항생제 추천을 의료기관에서 사용할 수 있다. 최근 이런 지침들을 활용한 특정 증후군 기반(syndrome-based)의 항생제 관리가 전향적 감시와 피드백 프로그램을 통한 중재보다 항생제 사용량 감소 혹은 C. difficile 감염 감소에 더 효과적일 수 있다는 보고가 있다[51-53].
다양한 감염 질환에 대한 항생제 용량과 투약 기간의 최적화(dosage and duration optimization for infectious syndromes) 는 항생제 치료 효과를 극대화하고 부작용 발생을 최소화하는 데 매우 중요하다[7,23,37]. 이를 위해 의료진들은 진료 지침을 기반으로 항생제를 투약하며 TDM을 적극적으로 활용해야 한다[59]. 또한, 항생제 처방 시 감염 부위, 항생제 감수성, 환자의 신장이나 간 기능을 고려한 용량 최적화 소프트 웨어를 유용하게 활용할 수 있다. 최근 다양한 감염 질환에서 항생제 투약 기간의 단축이 치료 결과에 긍정적인 영향을 미친다는 연구 결과들이 폐렴, 피부 및 연조직 감염, 요로감염, 복강 내 감염증, 그람음성균 균혈증을 대상으로 나타나고 있다[60-64]. 항생제 투약 기간을 최적화하기 위해 일정 기간 항생제가 투약된 경우 전산화 항생제 처방 프로그램 등을 활용하여 처방을 중지하거나 경보 프로그램을 활용할 수 있다.
주사 항생제에서 경구 항생제로 전환(conversion from parenteral to oral therapy)은 병원의 특성이나 대상 환자에 적절한 항생제 사용에 대한 프로토콜을 수립하여, 일원화된 치료 방침(clinical pathway)을 적용하는 중재 방법의 일부로 적절한 시기에 주사 항생제를 경구 항생제로 전환할 수 있다[65]. 경구 항생제의 사용은 재원 기간과 비용 및 주사제로 인한 부작용을 줄일 수 있다[66,67]. 그리고 하루 한 번 투약할 수 있는 ertapenem이나 teicoplanin 등을 활용하여 외래 주사 치료를 장려하거나[68,69], MRSA 감염증 환자에서 vancomycin 이나 teicoplanin의 주사제 사용 대신 linezolid 경구제로 전환하는 전략에 대한 고려가 필요하다[70]. 그러나 현재 국내에서는 linezolid 경구제 사용은 보험급여인정기준에 따라 사용에 제한이 있을 수 있다.
미생물 검사 결과의 신속한 보고(rapid diagnostic testing)는 항생제 관리팀과 미생물 검사실 사이의 협력적인 관계를 더욱 발전시킬 수 있다. 미생물 배양 검사 결과가 신속하게 보고될수록 조기에 적절한 항생제가 처방될 수 있다[71-74]. 호흡기 바이러스에 대한 신속 진단법이나 호흡기 바이러스 중합효소 연쇄반응법은 부가적인 검사 처방을 피할 수 있고, 불필요한 항생제 사용을 줄이며, 항바이러스제 등의 적절한 치료제 선택을 돕는다[75,76]. 한편, 인공호흡기관련 폐렴 환자의 호흡기 검체를 대상으로 다중 중합효소연쇄반응법을 활용하여 원인균 검사를 시행한 결과 항생제 처방이 개선될 수 있었다[77]. 또한 GeneXpert MRSA/SA (Cepheid, Sunnyvale, CA, USA), Verigene nucleic acid microarray assay (Nanosphere, Northbrook, IL, USA) 혹은 matrix-assisted laser desorption/ionization time-of-flight (MALDI-TOF) mass spectrometry의 사용으로 인하여 병원체에 대한 조기 동정이 가능하기 때문에 이를 항생제 관리에 활용하면 올바른 항생제의 조기 투약이 가능할 수 있다[71,78,79].
항생제 처방 서식(antimicrobial order forms)은 항생제 처방을 위해 약품명, 용량, 용법, 투약 기간, 감염 질환명을 기입하는 표준화된 서식으로, 특정 임상 증후군별 표준화된 항생제 처방 서식을 활용하여 적절한 항생제를 처방하는 비율을 개선할 수 있다. 또한, 투약 전 항생제 알레르기 여부를 평가하는 지침으로 활용할 수 있다[7,23].
전산화된 항생제 처방 시스템을 통한 컴퓨터 임상적 결정 지원 시스템(electronic medical records tools with clinical decision support system)은 연령과 신장 기능, 특정 감염 질환에 맞춘 용량의 투약을 돕고, 항생제 내성 양상에 적합한 항생제 처방을 도울 수 있다[87]. 의무기록을 전산화하여 의료진이 컴퓨터를 통해 항생제 처방을 입력하게 되면, 특정 항생제 처방의 적절성 평가를 더 효과적으로 할 수 있고, 관리에 소요되는 시간을 단축할 수 있다[88]. 최근에는 모바일 기기가 항생제 관리에 활용되어[78,79] 맞춤형 스마트폰 임상결정지원 소프트웨어가 개발되고, 인트라넷 기반의 지침으로 접근성을 높였다[89-91].
추적조사는 항생제 사용 현황을 파악하고, ASP를 평가하기 위해 수행하는 일련의 조사 활동이다. 추적조사를 통하여 항생제 처방 관련하여 개선이 필요한 부분을 도출하고, 항생제 처방 중재 활동의 효과를 평가한다.
1. 의료기관 내 항생제 사용량을 정기적으로 추적 관찰하고 있다.
2. 의료 관련 감염병에 포함된 다제 내성균 6종(MRSA, vancomycin-intermediate/resistant Staphylococcus aureus [VISA/VRSA], vancomycin-resistant Enterococci [VRE], multidrug-resistant Acinetobacter baumannii [MRAB], multidrug-resistant Pseudomonas aeruginosa [MRPA], and carbapenem-resistant Enterobacteriaceae [CRE]) 발생 현황을 정기적(분기별 1회 이상)으로 추적 관찰하고 있다.
3. C. difficile 감염증 발생 현황을 정기적으로 추적 관찰하고 있다.
4. 다빈도로 검출되는 세균들에 대한 항생제 감수성 현황을 정기적으로 추적 관찰하고 있다.
5. 항생제 이상 반응 발생 현황을 정기적으로 추적 관찰하고 있다.
6. 항생제 사용에 대한 감시와 피드백에 따른 권고사항 수용 정도를 정기적으로 추적 관찰하고 있다.
7. 특정 항생제를 대상으로 처방 제한 및 승인 프로그램에 포함된 항생제의 제한과 승인 정도를 정기적으로 추적 관찰하고 있다.
8. 의료기관 내에서 시행하고 있는 주요 감염 질환을 대상으로 수행한 항생제 중재 활동 혹은 그 외 부수적인 항생제 중재 활동에 대해 정기적으로 추적 관찰하고 있다.
- 주요 감염 질환에는 요로감염, 지역사회획득 폐렴, 혈류감염, C. difficile 감염 등이 있다.
- 부수적인 항생제 사용관리 중재 활동에는 항생제 병합 치료 최소화, 항생제 하강 치료, 항생제 최적 투약 기간 권고, 주사 항생제의 경구 전환, 특정 항생제에 대한 TDM 활용, 미생물 검사 결과의 신속한 보고 등이 있다.
전향적 감시 및 피드백 활동의 수용 정도 측정, 항생제 제한과 사전 승인 활동에 포함된 항생제 제한과 승인 정도 측정, 기관 내 항생제 치료 지침 순응도 측정, 주사용 항생제에서 경구용 항생제로의 전환 정도 측정, 불필요한 항생제 병용 투여 여부 측정, 항생제 투여 기간 측정 등으로 항생제 처방 중재 활동 과정을 평가할 수 있다.
국외 사례를 검토해 보았을 때 의료기관의 항생제 사용량 감시는 국가 전체 의료기관의 항생제 사용량을 평가하는 것을 기본으로 하고 있었으며, 이를 위해 의료보험 청구 자료, 병원 전산 자료, 약제 유통 자료 등 다양한 자료를 이용하는 것으로 확인되었다[92-95]. 미국을 비롯한 일부 선진국에서는 국가 전체 의료기관의 항생제 사용량 평가와 함께 개별 의료기관에서 항생제 사용량 정도를 평가하고 개선 목표를 효율적으로 설정하기 위하여 외부 병원과의 비교, 병원 내부에서 시간에 따른 항생제 사용량 변화를 측정하여 환류하는 벤치마킹 시스템을 국가 차원에서 운영하고 있는 것으로 확인되었다[93]. 국내에서는 2019-2021년 질병관리청 학술연구 용역과제로 수행한 “국가차원의 항생제 스튜어드십 프로그램 개발 및 운영평가” 연구를 통하여 개별 기관이 기관 내의 항생제 사용량을 측정하고, 타 기관의 항생제 사용량과 비교 분석할 수 있는 벤치마킹 체계인 ‘전국 의료기관 항생제 사용량 분석 및 환류 시스템(Korea National Antimicrobial Use Analysis System, KONAS)’이 구축되어 있기 때문에 국내 의료기관에서는 해당 시스템을 적극 활용할 필요가 있다[96]. 이 시스템은 개별 병원이 KONAS 참여 신청을 하고 이를 위한 자료 제공에 동의할 경우 건강보험심사평가원에는 해당 기관의 항생제 관련 보험 청구자료를 이용하여 계열별 항생제 사용량을 일당 치료 일수(days of therapy, DOTs)와 일일 복용량(daily defined dose, DDDs)의 형태로 제공하고 있다. 이와 동시에 비슷한 특성을 가진 기관의 평균 항생제 사용량과 예상 항생제 사용과 실제 해당 기관의 항생제 사용을 비교하는 지표인 SAAR를 제공함으로써 해당 기관 내 항생제 사용량 정도를 효율적으로 파악할 수 있다[96,97].
2021년에 질병관리청 정책용역연구사업으로 수행된 ‘국내 의료기관에 적용 가능한 항생제 사용량 감시체계 로드맵 개발’에 따르면 ‘항생제 사용량 벤치마킹을 위한 감시체계’에 포함시킬 의료기관은 우선 상급종합병원, 종합병원부터 시작하여 5-10년 후 중소병원(병원, 요양병원)과 의원까지 확대하는 방안이 바람직할 것이라고 하였다[98]. 적합한 자료원은 건강보험 청구 자료와 병원 처방 자료로 조사되었는데, 현재 KONAS의 자료원으로 사용 중인 건강보험 청구 자료의 경우 국내의 거의 모든 의료기관을 아우를 수 있으며 현 시점에서 이를 이용한 감시체계 운영이 가능하다는 장점이 있으나 자료가 실제 항생제 처방 자료와 다소간의 차이가 있으며 무엇보다 처방 시점부터 자료 생성 시점까지 오랜 시간(약 1년-1년 6개월)이 소요된다는 문제가 있다[98]. 병원 전산 자료가 실제 항생제 처방량을 가장 잘 반영한다고 알려져 있지만 국내에서는 아직 병원 간 전산 체계가 통일되어 있지 않고, 대부분의 병원에 병원 내 항생제 사용량을 측정하기 위한 시스템이 구축되어 있지 않고 사용량 분석을 위한 인력이 부재한 상태이기 때문에 당장은 이를 이용하기 어려울 것으로 보인다. 장기적인 관점에서는 미국 CDC처럼 질병관리청 주도로 병원 처방 자료를 이용하여 항생제 사용량을 분석하고 감시할 수 있는 체계를 구축하는 것이 바람직할 것이다[93,98].
ASP를 통해 항생제 내성률과 C. difficile 감염 발생률을 감소시킬 수 있을 뿐 아니라, 의료비와 항생제 이상 반응 빈도도 줄이며, 감염병 환자 예후를 개선시킬 수 있다[15]. 미국 CDC에서 2019년에 발간한 ‘The core elements of hospital antibiotic stewardship programs 2019’에 따르면 항생제 내성률, C. difficile 감염 발생률 그리고 항생제 사용관리 프로그램의 의료 비용에 대한 효과를 측정 가능한 ASP의 결과 지표로 제시하고 있다[99].
국내 연구를 포함한 다수의 연구에서 항생제 사용량의 증가는 항생제 내성균의 집락 또는 감염의 중요한 위험 인자로 보고하고 있다[100-102]. 그리고 최근 발표된 여러 연구에 따르면 ASP는 항생제의 사용량과 선택 압력(selection pressure)을 감소시키는 효과가 있으며, 특히 항생제 처방에 대한 전향적 감시와 피드백을 시행하거나 감염관리 활동을 함께 시행하는 경우 개별 의료기관에서 유의한 항생제 내성률 감소를 유도할 수 있음을 보여주었다[103,104]. 국내 800병상 규모의 대학병원에서 수행한 연구에 의하면 감염 전문가가 주도하는 carbapenem, glycopeptide 계열을 포함한 광범위 항생제의 처방 제한 프로그램과 항혐기균 항생제의 중복 처방 모니터링을 시행한 결과, 중환자실에서 S. aureus의 ciprofloxacin, oxacillin 내성률과 P. aeruginosa의 carbapenem 내성률이 감소하는 경향이 있었음을 입증한 바 있다[105]. 현재 국내에는 항생제 내성균 감시를 위하여 Korea Global Antimicrobial Resistance Surveillance System (Kor-GLASS), Korean Antimicrobial Resistance Monitoring System (KARMS) 등의 국가 차원에서의 항생제 내성균 감시 체계가 존재하지만 아직 이를 통해 개별 기관의 항생제 내성 현황을 파악하기는 어려운 현실이다. 법정 감염병으로 지정되어 있는 MRSA, VISA/VRSA, MRAB, MRPA, VRE, CRE의 경우 질병관리청에 의무적으로 신고해야 하기 때문에 개별 기관에서 정기적으로 자료를 수집하고 있으므로 이를 이용하여 기관 내 항생제 사용관리 프로그램의 결과 평가에 활용하는 것을 고려할 수 있겠다.
항생제 노출력은 대부분 C. difficile 감염의 위험 인자로 작용하며, 특히 3세대 cephalosporins, fluoroquinolone, clindamycin이 C. difficile 감염 발생과 밀접하게 연관되어 있다[106,107]. ASP 적용을 통해 이러한 고위험 항생제에 대한 노출을 제한하는 것이 C. difficile 감염을 예방하는 효과적인 방법이다[108-110]. C. difficile 감염에 대한 진단적 도구는 다양하지만 진단을 위한 단일 테스트는 권장하지 않으며 국내 대형병원들에서도 C. difficile 감염 진단을 위한 검사 기법이 병원별로 다소 상이하다[110]. 미국에서는 비단 ASP의 효과 측정 목적뿐 아니라 원내 C. difficile 감염 유행 감시를 위해 병원 획득 C. difficile 감염 현황을 감시할 것이 권고되며 CDC의 NHSN에 따르면 입원 후 4일째 혹은 그 이후 발생한 C. difficile 감염을 병원 획득 C. difficile 감염으로 정의하고 있다[111,112]. 국내에서도 이와 같은 체계적인 C. difficile 감염 감시를 위한 시스템 구축이 필요하다.
미국 CDC에서는 비용 절감을 ASP 성공의 중요한 결과 척도로 설정하는 것은 적절하지 않지만 비용을 절감해서 ASP의 필요한 자원으로 활용한다면 도움이 될 수 있다고 제시하고 있다[99]. ASP의 의료 비용 절감 효과는 주로 항생제 사용량 감소에 기인한다. 전향적 감시와 피드백 활동이나 항생제 제한과 사전 승인 활동 수행 시에 중재 대상 항생제의 사용량 감소가 두드러지게 나타났고, 이는 비용 절감으로 이어졌다[113-115]. Fluoroquinolone 주사제를 투여받는 입원 환자 중 특정 조건에 부합하는 환자에서 경구제로 전환을 권고하는 프로그램을 진행한 국내 연구에서는 권고를 받아들인 환자군의 fluoroquinolone 약제 비용이 그렇지 않은 환자군에 비해 약 35% 낮았다는 것을 보고한 바 있다[116]. 약제 비용 감소 외에도 의료 비용을 절감시킬 수 있는 요인들이 다수 존재하지만 현실적으로 이러한 요인을 쉽게 측정할 수 있는 방안은 아직 존재하지 않기 때문에, 현 시점에서 해당 지표를 원활하게 현장에 적용하기는 어려울 것으로 보인다.
항생제 처방과 관련한 질 향상을 위한 항생제 처방 중재 활동 과정의 평가는 병원에서 수행하는 특정한 중재에 초점을 맞출 수 있다[15,99]. 전향적 감시 및 피드백의 유형과 수용 여부를 추적하여 더 많은 교육과 추가적인 중재가 유용할 수 있는 영역을 찾아낼 수 있다. 사전 승인과 제한 정도를 평가하고 이로 인해 치료가 지연되지 않는지 모니터링할 수도 있다. 그 외에도 기관별 치료 지침 순응도, 항생제 타임아웃제 수행 여부, 주사용 항생제에서 경구용 항생제로 전환, 불필요한 항생제 병용 투여 여부를 추적 조사할 수 있으며 항생제 투여 기간이 적절한지 검토할 수도 있다.
병원의 경영진에게 정기적으로 항생제 사용, 항생제 내성, 항생제 처방 중재 활동 내용 등을 보고하고, 항생제 처방과 관련 있는 모든 의료진에게 공유하여 적절한 항생제 처방을 도모한다.
1. 항생제 사용에 대한 정보(항생제 사용량, 항생제 사용 관리 프로그램에 따른 항생제 사용량 및 패턴 변화)를 경영진과 항생제 사용 관리위원회에 보고하고 관련 직원과 공유하고 있다.
2. 항생제 내성 정보를 보고 및 공유하고 있다.
3. 개인별 혹은 그룹별 처방된 항생제가 의료기관 내의 감염 질환 치료 지침에 부합되는지 보고 및 공유하고 있다.
4. 항생제 처방 제한과 승인 프로그램 대상 항생제에 대한 내용을 처방 의료진과 공유하고 있다.
5. 항생제 사용에 대한 감시와 피드백 프로그램의 권고에 대한 순응도를 처방 의료진과 공유하고 있다.
① 항생제 사용 현황 보고 및 직원 공유: 병원 전체 혹은 그룹(예, 응급실, 중환자실, 항생제 다빈도 사용 분과, 패혈증 등과 같은 특정 질환 등) 및 개인별 항생제 사용량을 보고한다. 항생제 사용 관리 프로그램에 따른 항생제 사용량과 패턴을 항생제 사용 관리위원회에 보고하고 관련 직원과 공유한다.
② 항생제 내성 보고 및 직원 공유: 특정 세균의 항생제 내성 정보를 보고하며, 병원 전체 혹은 그룹(예, 중환자실, 항생제 다빈도 사용 분과)의 항생제 내성 정보를 관련 직원과 공유한다. ASP 적용에 따른 특정 세균의 항생제 내성률과 패턴을 항생제 사용 관리위원회에 보고하고 관련 직원과 공유한다.
③ 의료기관 내의 항생제 치료지침 순응도 보고 및 직원 공유: 그룹(예, 응급실, 중환자실, 항생제 다빈도 사용 분과, 패혈증 등과 같은 특정 질환 등) 및 개인별 항생제가 항생제 치료 지침과 부합되는지 등을 공유한다.
④ 항생제 처방 중재 활동 내용 보고 및 직원 공유: 항생제 제한과 승인 프로그램 혹은 전향적 감시 및 피드백을 통해 활동 중인 항생제 목록을 전체 의료진과 공유하고 활동 내용을 항생제 처방 의료진과 공유한다. 또한 항생제 처방 권고에 대한 순응도를 처방 의료진과 공유한다.
항생제 사용에 대한 정보(ASP에 따른 항생제 사용량 및 패턴 변화)를 보고하고 공유함으로써 병원 전체 및 관련 직원에게 동기를 부여하고 행동을 변화시켜 항생제 처방을 향상시키는 것이 목적이다. 이 활동은 개인 및 그룹의 자율성을 최대한 존중하고 어떠한 제한도 하지 않기 때문에 손쉽고 간단하게 항생제 처방을 향상시킬 수 있는 방법 중 하나이다[6,15]. 병원 내에서 항생제 사용량을 보고하고 공유하는 것이 의료기관의 항생제 사용을 개선시킬 수 있는지 확인한 연구는 아직까지 드물다. 하지만 일차 의료기관에서 개인별 항생제 사용량에 대한 정보를 서로 공유하는 것은 벤치마킹 할 수 있는 기회를 제공하고 항생제 사용을 개선시킬 수 있다는 것이 확인된 바 있어 병원에서도 같은 효과를 기대해 볼 수 있겠다[117,118].
병원에 따라 자원이나 재원의 부족으로 항생제 사용과 관련된 데이터 수집이나 자료 분석이 어려워 적절한 항생제 사용 현황 보고 활동 진행이 불가능할 수 있다. 이러한 경우 KONAS와 같은 시스템을 이용한다면 병원 전체의 항생제 사용량에 대한 자료 정도는 손쉽게 얻어 보고할 수 있을 것이다. 항생제 사용 데이터 수집 및 분석이 충분히 가능한 병원인 경우 좀 더 높은 수준의 보고 활동을 진행할 수 있다. 이러한 병원들에서는 항생제를 처방한 의사가 이전 항생제 처방에 대해 기억해 낼 수 있도록 단기간 수집된 항생제 사용 현황 정보들을 최대한 자주 공유하는 것이 좋다. 만약 단기간 보고가 어려운 경우는 연 1-2회 보고를 고려해 볼 수 있다. 다음으로 항생제 사용 현황을 개인별로 보고해 주는 것이 효과적일 수 있다. 하지만 개인별 항생제 사용 현황 보고가 징벌적 개념으로 오인되어 처방 의사의 반감을 유발하거나, 담당 의사의 변경이나 순환 근무 등으로 개인별 보고가 불가능할 경우 그룹별 보고를 진행할 수 있다. 끝으로, 항생제 사용 현황 보고는 맞춤형 자료를 제공해야 한다. 예를 들어, 외과계 의사들에게는 전체 항생제 사용에 대한 자료를 제공하기보다는 수술 예방적 항생제 사용에 대해 보고해 주는 것이 항생제 사용 개선에 더욱 효과적일 수 있다[119].
세균의 항생제 내성 정보는 항생제 선택에 중요한 영향을 미치기 때문에 의료 기관 내 항생제 내성 정보가 주기적으로(분기 또는 연 2회 등) 반드시 제공되어야 한다[7,120]. 항생제 관리팀은 미생물 검사실 담당자와 협업하여 분석 가능한 균주들의 항생제 감수성 양상 및 ASP 적용에 따른 세균의 항생제 내성 변화를 보고할 수 있다. 한 의료기관 내에서도 병상의 위치(예, 중환자실), 환자의 나이(예, 소아), 감염 종류(예, 혈류 감염), 감염 발생 유형(예, 지역사회 감염) 등에 따라 항생제 감수성 양상이 매우 다를 수 있다. 이와 같이 환자들을 그룹화하여 항생제 감수성 결과를 보고하는 것은 기관의 항생제 치료 가이드를 만드는 데 중요한 정보를 제공할 수 있다.
항생제 제한과 승인 활동 중 요청한 항생제의 처방 중재 내용, 전향적 감시와 피드백 활동 중 권고에 대한 순응도, 의료기관 내 항생제 치료 지침 순응도 등을 검토하고 이 과정에서 발견되는 문제점들을 처방 의료진과 공유하는 것은 항생제 처방 향상에 도움이 될 수 있다.
국가 항생제 내성 관리대책 2기에서 그동안 관리가 부족했던 중소 및 요양병원에 집중하여 항생제 적정 사용을 강조하였던 만큼 이들 기관에서 항생제 사용을 향상시키기 위해 해당 병원들이 활용할 수 있는 보고 시스템 정비가 필요하다. 따라서 Duke Antimicrobial Stewardship Outreach Network (DASON) 모델과 같은 대형병원-중소병원 네트워크 구축 시범사업을 운영하여 중소병원의 항생제 관리를 지원하려는 계획에서 보고 시스템 지원에 대한 부분도 고려하는 것이 필요하다[122,123]. 다만 국내 의료기관에서 시행된 항생제 보고의 효과에 대한 자료가 거의 없어 향후 이에 대한 근거 마련 연구가 필요하다.
항생제의 올바른 처방과 항생제 내성균에 대한 의료진 교육, 사용하고 있는 항생제에 대한 환자 교육을 포함하는 모든 활동으로, 항생제 사용을 개선하기 위한 포괄적인 노력의 핵심 요소이다.
1. 의료진의 적절한 항생제 처방을 위해 임상 진료 지침이나 항생제 처방 지침에 대한 교육을 주기적으로 제공하고 있다.
2. 경영진과 병원 종사자에게 항생제 사용관리 교육을 주기적으로 제공하고 있다.
3. 의료진 및 임상 미생물 검체와 관련된 병원 직원들에게 임상 미생물 검체의 확보(혈액배양 등) 및 운반, 관리, 해석에 대한 교육을 주기적으로 제공하고 있다.
4. 적절한 항생제 사용을 위한 환자 및 보호자의 참여(speak up)를 위해 환자와 보호자 대상의 항생제 사용관리 프로그램의 홍보와 교육을 제공하고 있다.
활용 방법으로는 자료를 통한 교육(예, 국내 지침을 포함한 항생제 사용 지침, 강의, 포스터, 전단 및 뉴스레터, 이메일을 통한 경보 등), 대면 교육이나 회진(악수 사용관리, handshake stewardship), 사례 중심의 교육 등이 있다. 이 때 교육은 학생을 포함하는 의료진, 환자와 보호자를 대상으로 한다.
교육은 중재와 결과의 평가가 함께 이루어질 때 가장 효과적이다. 사례 중심의 교육이 특히 효과가 강력하며, 전향적 감시와 피드백 그리고 사전 승인 전략도 항생제 사용에 대한 교육을 제공하기 위한 좋은 방법이다. 강의, 지침 관련 인쇄물 배포, 이메일을 통한 경보(alert) 제공 등은 수동적인 교육 활동에 해당하며, 이러한 교육은 ASP의 중재와 결과 측정과 결합될 때 가장 효과적이다[23,44,124]. 교육은 병원에서 항생제 사용을 개선시키기 위해 필수적인 구성요소이나 교육만으로는 효과적이지 않다[7]. 한 메타분석 결과를 보면, 캠페인 등을 통해 교육 책자를 배포하거나 강의를 하는 형태의 수동적 교육은 일부 효과를 보일 수 있으나[125], 중재 기간 중에 나타나는 일시적인 효과일 뿐 1년 이상 그 효과가 지속되지 못하기도 하였다[126].
자료를 통한 교육(지침, 강의, 포스터, 전단 및 뉴스레터, 이메일을 통한 경보 등)은 의료진에게 임상 진료 지침이나 항생제 처방 지침을 제공하거나 간호사에게 배양 기술에 대한 교육을 제공하거나, 환자에게 본인이 투여받고 있는 항생제 부작용의 징후 및 증상에 대한 교육을 제공하는 것을 포함한다. 강의나 미팅, 이메일과 전화를 통한 전문가 조언 상담을 포함하는 교육적 중재를 시행한 군과 그렇지 않은 군을 비교한 연구에 따르면, 교육 중재를 받은 군에서 연간 항생제 처방률이 큰 폭으로 감소하였고 이 효과가 4개월까지는 지속되는 것을 확인하였다[127]. 또한 캐나다 퀘벡주에 의사, 치과의사를 위한 사용자 친화적인 지침이 배포되었을 때 캐나다 다른 지역에 비해 항생제 처방량이 줄어드는 것을 확인한 연구도 있었다[128]. 그리고 미팅이나 세미나, 캠페인을 통한 교육에 참여한 소아과 의사와 그렇지 않은 의사를 비교했을 때 참여한 의사가 항생제 총 처방량이 줄어드는 것을 보여주는 연구도 있었다[129].
중재 방법의 교육으로 대면 교육이나 회진(악수 사용관리)을 들 수 있다. 대면 교육이나 회진은 의사와 약사로 구성된 항생제 관리팀이 처방된 모든 항생제를 검토하며, 회진을 통해 직접적이고 개별적인 피드백을 제공하면서 교육하는 방법을 말한다. 한 개인에게 악수 사용관리를 통한 피드백을 제공할 때 특히 효과적이다.
사례 중심의 교육은 비식별화된 사례를 의료진과 함께 검토하며 토의하는 교육 방법으로 항생제 요법의 변경 과정을 쉽게 인지할 수 있게 한다. 검토하는 사례는 환자의 징후, 증상과 검사 결과, 치료 과정, 임상적 결과 등을 포함하며, 사례 발표는 정기적으로 기관내 다른 부서와 함께, 회의와 토론을 반복하는 방법으로 하는 것이 좋다.
교육의 대상은 의료진, 약사, 의사 보조인력(physician assistant), 임상 간호사, 간호 학생이나 수련의 등 다양한 의료 인력을 포함해야 한다. 특히, 의과대학 학생에 대한 교육의 필요성이 강조되고 있다[46].
환자 교육 또한 ASP에 있어서 중요한 역할을 할 수 있는데, 환자는 본인이 어떠한 이유에서 어떤 항생제를 사용하고 있는지 아는 것이 중요하고 제공자와 공유해야 하는 항생제 부작용의 징후 및 증상에 대해서도 교육을 받아야 한다. 또한, 퇴원 후 항생제 복용이 중단된 이후라도 일어날 수 있는 부작용에 대해서 알고 있어야 한다. 이는 의료질 향상 부서의 “환자의 참여(speak-up)” 운동에 해당하며 입원 및 외래 환자와 모든 규모의 의료기관에서 강조될 수 있고, 의료질 향상 담당자와 함께 활동하면 좋다. 환자 교육의 노력에는 간호사들의 역할이 중요하다. 그리고 적절한 항생제 사용을 위한 환자 대상 교육 자료를 개발할 때도 환자 참여로 만들어진 교육 자료가 더욱 효과적이므로, 환자의 참여를 유도해야 한다.
그러나 국내 의료기관에서 시행된 항생제 사용에 있어 교육의 효과에 대한 자료가 거의 없어 향후 이에 대한 근거 마련 연구가 필요하다.
ASP 관련 주요 영역을 살펴보면 미국과 캐나다는 의약품 관리(medication management) 영역, 호주와 대만은 감염 예방/관리(prevention and control of infection) 영역이었다. 공통적으로 적절한 ASP 구현 및 실행을 위해서는 의료기관의 리더십, 감염 예방/관리 체계의 긴밀한 연계와 직원과 환자의 참여가 중요함을 강조하고 있다.
ASP 관련 기준은 의약품 관리에 독립되어 마련되어 있다. ASP 관련 7가지 핵심요소를 구체적으로 언급하여 문서로 명시하도록 요구하고 있으며, 리더가 ASP를 조직의 우선순위로 두도록 요구하는 항목은 최고의사결정기구가 필요한 자원을 제공하도록 요구하는 리더십 기준과 연결되어 있다. 또한, 의료기관이 승인한 다학제 프로토콜을 사용하도록 요구하고 있 으며, 다학제팀 구성도 언급하고 있다. ASP 운영과 관련하여 개선이 필요한 부분에 대한 수행 결과를 확인하는 항목은 의약품 관리 시스템의 효율성을 평가하는 기준과 연계되어 있다. 핵심요소 중 교육은 감염관리 기준과 연결되어 ASP 적용이 감염 예방/관리 활동의 중요한 부분임을 명시하고, 감염관리 기준과 연계하여 ASP 실행이 다제 내성균(multidrug-resistant organisms), 중심 정맥관 관련 혈류 감염(central line-associated bloodstream Infections), 카테터 관련 요로 감염(catheter-associated urinary tract infections), 피부 연조직 감염(surgical site infection) 등의 위험을 줄이는 성과에 반영되었는지 여부를 모니터링하도록 요구하고 있다.
미국 TJC가 세운 국제기구로 TJC의 기준과 매우 유사하다. ASP 관련 기준은 의약품 관리 및 사용(medication management and use) 기준으로 독립되어 마련되어 있다. 항생제 내성균의 발생과 확산을 줄이고 환자 상태를 개선하기 위해서 병원은 항생제의 최적 사용을 보장하는 조치를 이행하고 효과적인 ASP를 보장하기 위해 리더십에 의한 지원(인력 배치, 재정 자원, 근거기반 자료, 정보기술 등)이 반드시 필요하며, 감염 예방/관리 전문가 외에도 의사, 간호사, 약사, 기타 직종이 참여하는 조정기구(mechanism)를 운영하고 교육생/환자/가족 등이 참여해야 함을 강조하고 있다. 다만, ASP 운영 담당자로서 약사 지명에 관한 구체적인 언급은 없다.
ASP 관련 기준은 ‘의료 관련 감염 예방과 관리’ 항목에 별도로 구분하여 마련되어 있다. ‘의료 관련 감염 예방과 관리’기준(criteria)은 크게 4개로 구성되어 있다. 첫 번째는 의료 관련 감염 예방 및 통제, 항생제 사용관리 지원을 위한 임상거버넌스 및 품질 개선, 두 번째는 감염 예방 및 관리체계, 세 번째는 재사용 가능한 의료기기의 재처리, 마지막으로 네 번째가 항생제 사용관리 프로그램이다. 본 기준에서 의료기관은 항생제 사용 관리를 개선하기 위한 시스템을 구축할 것을 요구하면서 이를 위해서는 특히 임상 거버넌스, 의약품 관리 및 의료 소비자와의 파트너십과 같이 적용되어야 함을 강조하고 있다. NSQHS 기준에 따른 인증 획득이 병원의 의무이기 때문에, 본 기준에 대한 지침을 통해 기준을 충족시키기 위한 핵심 업무(key tasks), 개선 전략(strategies for improvement) 을 제시하는 것은 의료기관에게 매우 유용할 것으로 생각된다.
메르스 사태 이후 급성기 병원 감염관련 기준을 개정(ver. 2.1)하면서 The International Society for Quality in Health Care(ISQua)의 인증기준에 대한 국제기준에 ASP 관련 내용이 포함되어 있어 우리나라도 포함시키고자 하였으나, 항생제 내성을 줄이기 위한 정부나 학계의 준비가 부족한 시기였다.
국가 항생제 내성 관리대책이 우리나라에서 처음으로 마련된 것이 2016년 8월인데, 그 시기는 급성기병원에 대한 2주기 인증 조사가 진행되고 있었다. 내성 관리대책 중 항생제 적정 사용을 위한 세부 추진 방안에 항생제 사용 지침 개발 및 확산이 포함되어 있었으나 구체적으로 ASP가 언급된 것은 아니었고, ASP 적용을 위한 국내 지침이 준비되어 있지 않았다. 따라서, ASP에 관련된 ISQua 기준을 충족하기 위해서는 2018년도 3주기 급성기병원 인증기준에 ‘적절한 항생제 사용을 위한 관리체계(8.1 ME. 5)’의 수준으로 시범 적용하는 내용으로 개정하였다.
2022년 9월경부터 시작되는 4주기 급성기병원 인증 조사에 적용하는 기준이 2021년에 공표되었는데, ASP 관련 내용은 크게 달라지지 않았다. 그 이유는 3주기와 비슷하다. 아직 적용하려는 지침이 확정되지 않았고, 의료기관의 준비도 매우 미흡하다. 특히, 전문인력(약사, 감염 전문가 등)이 턱없이 부족한 것이 현실이다.
향후 항생제 사용관리 프로그램을 반영한 기준 개정을 염두에 둘 때 가장 먼저 검토할 부분은 현재와 같이 감염관리 영역으로 둘 것인지 의약품 관리 영역으로 변경할지의 여부이다. 핵심요소를 살펴보면 미국의 지침과 유사하므로, 미국 인증기준의 구성을 따르는 것이 편리할 것으로 보인다. 다만, 대부분의 국가에서 공통적으로 강조하듯이 적절한 ASP 구현 및 실행을 위해서는 의약품관리, 리더십과 품질개선 시스템, 감염 예방/관리 체계의 긴밀한 연계 및 환자 참여 방안을 포함시켜야 한다. 만약 ASP와 관련하여 급성기 병원 인증기준을 개정하게 된다면 5주기에 반영될 가능성이 있지만, 당국과 주요 이해관계자들의 합의, 적용을 위한 기반 마련(특히 프로그램 적용 관련 보상 방안 마련) 등의 현안이 해결된다면 4주기 중간이라도 개정될 수 있다. 항생제 사용관리 프로그램 적용 시범사업을 통해 인증기준에 포함시킬 세부 내용과 판정 기준을 마련하는 것이 바람직할 것으로 사료된다.
ASP는 의료기관 내 적절한 항생제 사용 관리 활동을 통해 감염병의 치료 경과에 대한 악영향 없이 불필요한 항생제의 오남용을 줄이고 적절한 사용을 유도, 유지함으로써 항생제 내성과 약제 관련 이상 반응의 발생, 재원 기간 단축 등 감염성 질환에 대한 의료의 질 향상, 환자의 안전을 유지하고자 하는 목적을 가지고 있다. 감염 전문가들 중심으로 국내 항생제 사용관리 프로그램 활동 지원을 위한 수가인 항생제 관리료 신설의 필요성은 높아지고 있지만, 기존 감염예방 관리료의 운영 목적, 업무 담당자의 중복에 대한 우려 역시 함께 제기되고 있다. 이에 따라 두 관리료의 차이에 대해 살펴보고자 한다.
2016년 9월 의료기관 내 감염 발생/확산을 사전에 예방할 수 있도록 감염병 관리를 실시하는 데 소요되는 비용을 보상하고 감염 관리 인프라 구축을 지원하기 위해 감염 예방 관리료가 신설되었다. 감염 예방 관리료는 의료관련 감염 등 효율적인 감염 예방/관리 프로그램 운영을 위하여 병원 내 감염관리실 및 감염관리위원회를 설치/운영하고, 허가 병상당 전담인력을 배치한 요양기관에서 감염 예방 관리 활동(infection prevention and control, IPC)을 실시하는 경우 등급별로 수가를 적용받을 수 있다. 감염 예방 관리료는 IPC 활동을 지원하기 위한 것으로, 1) IPC team 구성 및 운영, 2) 병원 내 IPC 정책 및 운영체계 개발, 3) IPC를 위한 병원 내 행정 지원, 4) 핵심적인 IPC 수행, 5) 의료관련 감염 발생 조사 및 보고 등의 활동을 포함하고 있다.
의료의 질 향상 및 환자 안전 보장이라는 목표를 이루기 위한 여러 가지 활동 중 IPC는 의료관련 감염을 관리하고 예방하는 활동 지원, ASP는 항생제 사용에 대한 질 관리 활동 지원이라는 서로 다른 목적으로 시행되고 있다. IPC와 ASP는 활동의 영역이 의료와 관련되고, 특히 항생제 내성균 관리에 대한 두 활동 간의 업무 중복은 불가피하지만 서로 상호 배타적 또는 상하관계는 아니다. 오히려 감염 예방 관리와 항생제 사용관리는 상호 보완적인 관계로 ASP를 통한 항생제 내성균 발생의 원인 관리와 더불어 IPC를 통해 항생제 부적절 사용의 결과물인 다제 내성균의 의료기관 내, 의료기관 간 그리고 지역사회로의 확산 예방을 상호 협력하는 관계를 가지고 있다.
미국 CDC에서는 ASP 활동에 필요한 핵심 요소로 다음 7가지 사항을 제시하고 있으며, 이를 통해 감염 예방 관리 활동과의 차이를 살펴볼 수 있다. 7가지 핵심요소는 1) 리더십의 책무(leadership commitment), 2) 책임자 임명(accountability), 3) 담당 약사 임명(pharmacy expertise), 4) 중재의 실행(action), 5) 추적 조사(tracking), 6) 보고(reporting), 7) 교육(education)이다.
각 활동의 목적을 도달하기 위해 감염관리팀과 별도로 항생제 사용관리 전담팀을 구성하여 ASP를 운영하는 것이 필수적이다. 항생제 사용관리 전담팀은 자격이 인정되는 임상의 및 약사의 책임하에 임상 미생물학자, 감염관리 간호사 등의 다학제적 전담팀으로 구성되어야 하며, 국내보다 먼저 ASP를 도입하여 적용 중인 여러 선진국에서 운영에 필수적인 전문 인력 확충의 필요성을 강조하고 있다. 미국 CDC, 미국 감염학회의 ASP 적용 지침에서는 항생제 관리에 대한 전문 지식과 경험을 가진 감염분과 전문의나 감염약료 전문 약사가 ASP 운영에서 핵심적인 역할을 할 것을 권고한다. 감염 관리팀 구성 역시 일정 자격을 갖춘 임상의 및 감염관리 간호사, 임상 미생물학자, 전문 행정요원 등 다학제적 의료인력으로 구성되며, 이러한 인력 구성의 중복으로 인해 중복 업무로 잘못 이해할 수 있다. 그러나 실제 대부분의 의료기관은 기관 내 감염관리실에서 감염관리 활동을 담당하고 있으며, 항생제 사용관리 프로그램 활동은 주로 감염내과/감염 소아과 임상의가 약제 부서와 협업하여 시행하고 있으며, 이처럼 각 활동별 팀 책임자와 핵심 실무자는 서로 다르다.
무엇보다 ASP 운영의 핵심적인 문제는 국내 의료기관에서 ASP를 효과적으로 이끌어 나갈 프로그램 책임자, 담당 약사 등의 관련 전문 인력이 매우 부족하다는 점이다. 핵심적인 역할을 하는 관련 전문 인력을 확충하기 위해서는 장기적 안목의 교육적, 경제적 지원이 바탕이 되어야 한다. 지원 방법 등에는 협의 진찰료 등의 행위별 수가, 다양한 평가지표를 활용한 평가에 따른 인센티브, 별도의 항생제 관리료 신설 등을 고려할 수 있으며, 장기적 측면에서는 종합병원, 그리고 병원의 참여를 고려한다면 전문 인력의 확보를 위한 항생제 관리료 신설이 가장 효과적일 것이다. 감염병관리 실시에 필요한 비용을 보상하고 감염관리 인프라 구축을 지원하기 위해 감염 예방 관리료가 신설되었듯이 항생제 관리 활동 수가 신설은 감염병을 치료하고 항생제 오남용을 줄이는데 필요한 인프라 구축, 특히 관련 전문 인력 확충 지원을 위해 필요하다. 여기서 추가로 고려해야 할 사항은 현재 감염 예방 관리료가 적용되고 있는 국내 감염관리 활동 역시 인력 확보와 활동 수행 면에서 아직 어려움을 겪고 있다는 점이다. 전문 인력을 늘리는 것이 병원의 수입으로 연결되지 않기 때문에 병원의 평가 항목에 항생제사용관리위원회, 항생제 관리 의사, 감염약료 전문 또는 전담 약사, 제한 항생제 승인 시스템 등의 항목을 추가 및 강화하여 병원마다 전문 인력을 충원하는 필요성을 느끼도록 하는 방안이 함께 필요할 것이다.
2018년 조사에 따르면 미국 급성기 병원의 85%에서 7가지 핵심요소를 갖추고 있었으며 이 수치는 2014년의 41%보다 증가한 것이다[99]. 미국의 한 연구에 따르면 핵심요소를 수행하는 병원의 비율이 1% 증가하는 것이 미국 내 병원 획득 C. difficile 감염증의 빈도를 0.3% 낮추는 것과 연관성이 있었다[130]. 해당 연구에서 핵심요소 수행과 MRSA 감염증의 연관성도 분석하였으나 통계적으로 유의한 결과를 얻지 못하였다[130]. 핵심요소를 갖출 경우 외래 환자에 대한 급성 상기도 감염에 대한 항생제 사용이 줄어들고, 사용 적정성도 향상될 뿐 아니라, 비용 효과적이기도 하다는 연구도 존재한다[131]. 해당 연구에 따르면 핵심요소를 갖추고 ASP를 수행할 경우를 그렇지 않을 경우와 비교했을 때, 환자당 처치 비용을 37달러(7%) 낮출 수 있었고, quality-adjusted life years (QALYs)를 0.001 (1.2%) 증가시킬 수 있었으며, 입원 환자 비율을 0.3% 낮출 수 있었다. 미국의 Veterans Health Administration 대상으로 수행한 또 다른 연구에 따르면, 핵심요소를 갖추고 ASP를 수행한 기관은 그렇지 않은 기관에 비해 외래 급성 상기도 감염에서의 항생제 사용 비율을 효율적으로 낮추었고, 항생제 처방 적정성을 효율적으로 증가시켰으며, 입원 환자 비율도 효과적으로 줄이는 효과가 있었다[132].
우리나라는 국가 차원에서 항생제 내성 문제를 극복하기 위해 국가 항생제 내성 관리 대책을 마련하고 있고, 2021년부터 시작되어 2025년까지 진행될 예정인 ‘제2기 국가 항생제 내성관리 대책’에는 국내 의료기관에서의 ASP 정착이 핵심 전략으로 제시되어 있다. 이의 실현을 위해 한국형 ASP 지침 개발이 추진되고 있고, 이러한 노력의 결과로 국내 의료기관에서의 ASP를 정의하는 작업인 한국형 ASP 실행을 위한 핵심요소를 개발하기 위하여 본 연구가 진행되었다. 본 연구를 통하여 총 6개의 핵심요소(리더십의 책무, 운영체계, 중재의 실행, 추적 조사, 보고, 교육)를 확정하고 각각의 핵심 요소를 평가하기 위한 28가지 구성 항목을 개발하였다(Fig. 3). 미국 CDC의 ASP 핵심요소와 가장 큰 차이가 있는 핵심요소는 운영체계(operating system)로, 이는 미국의 핵심요소인 책임자 임명 및 전문 약사 임명에 해당하는데, 이는 기존의 전문 인력이 풍부한 외국 사례에 적용되던 핵심요소로 국내에서는 외국과는 다르게 적용해야 한다고 판단하여 ASP 적용을 위한 구조적 측면으로 제시하고자 하였다. 국내 의료기관의 ASP 활성화를 위해 의료기관 인증평가에 ASP 수행을 포함시키려는 노력이 진행되고 있는데, 현재까지 ASP가 인증 기준에 적극적으로 반영되지 않은 가장 큰 이유는 미비한 국내 ASP 관련 지침과 전문 인력의 부족이다[133]. 빠른 시일 내에 앞서 제시한 문제점들이 극복되어 향후 시행 예정인 5주기 의료기관 인증기준에 ASP 항목이 적극적으로 반영될 수 있기를 기대한다. 그리고 ASP가 국내 의료기관에 온전히 자리 잡기 위해서는 재정적 보조를 통한 인력 확보가 반드시 필요한 상황으로, ASP 활동에 대한 별도의 수가 산정 등의 적절한 보상책의 마련이 적극 고려되어야 할 것이다. 본 연구에서 도출한 핵심요소는 여러 국가의 문헌들을 검토한 후 전문가 논의를 거쳤고, 각 핵심요소 평가를 위해 만든 항목은 국내 실정에 맞게 적용하여 만든 항목들이다. 비록 이번 연구에서는 주로 종합병원 이상 등급의 급성기병원의 상황에 적용 가능한 핵심요소가 개발되었으나 동일한 급성기병원이라도 각 의료기관이 가지고 있는 인력 자원과 재정적 여력에 차이가 존재한다는 점을 고려하여 자원이 한정적인 의료기관에서도 적절히 적용할 수 있도록 각 핵심요소들을 가다듬었다. 중소병원과 의원급 의료기관에서의 높은 항생제 처방률, 높은 부적절 항생제 처방 비율[134]과 중소병원과 요양병원의 항생제 다제 내성균 검출률이 높음을 감안했을 때, 장기적으로는 중소병원이나 의원을 대상으로 한 별도의 핵심요소 지침 마련을 고려해야 할 것이다.
이 분야의 연구들이 근거 중심적 측면에서 우수한 연구가 매우 적어 지침 개발과정에 어려운 점이 있었다. 이 권고 지침의 근거가 되는 대부분의 임상 연구들은 국외에서 수행되었고, 일부 적용된 국내 연구 결과도 극히 적은 상황에서 마련되었으므로, 이를 실제 의료기관에서 적용할 때 이러한 사항이 충분히 고려되어야 한다. 이번 연구를 통해 개발된 핵심요소는 우선적으로 종합병원 수준 이상의 급성기병원을 대상으로 한다. 향후 중소병원, 장기 요양시설, 일차 의료기관을 위한 ASP 핵심요소 개발도 반드시 이루어져야 할 과제이다. 또한 개발된 핵심요소를 국내 의료기관에서 적용하여 ASP를 적용하게 될 시에 효과를 검증하기 위한 연구도 진행될 필요가 있다.
Notes
AUTHOR CONTRIBUTIONS
Conceptualization: KTK, HSC, KP; Funding acquisition: KTK; Investigation: BK, CM, MSL, YKY, SJJ, YCK, BWE, HK, ISH, CP, HL; Methodology: KTK, JS; Supervision: HBK, SK, MSL; Writing - original draft: HSC, KP; Writing - review & editing: HSC, KP, HBK, SK, BK, CM, MSL, YKY, SJJ, YCK, BWE, HK, ISH, CP, KTK.
REFERENCES
1. Fridkin S, Baggs J, Fagan R, et al. Vital signs: improving antibiotic use among hospitalized patients. MMWR Morb Mortal Wkly Rep 2014;63:194–200.


2. O’Neill J. Tackling Drug-Resistant Infections Globally: Final Report and Recommendations [Internet]. London (UK): The Review on Antimicrobial Resistance, c2016 [cited 2022 Dec 12]. Available from:
https://amr-review.org/sites/default/files/160525_Final%20paper_with%20cover.pdf
3. World Health Organization (WHO). World Antimicrobial Awareness Week: Campaign Guidance 2021 [Internet]. Geneva (CH): WHO, c2021 [cited 2022 Nov 15]. Available from:
https://www.who.int/publications/m/item/world-antimicrobial-awareness-week-campaign-guidance
4. Park SY, Moon SM, Kim B, et al. Appropriateness of antibiotic prescriptions during hospitalization and ambulatory care: a multicentre prevalence survey in Korea. J Glob Antimicrob Resist 2022;29:253–258.


5. Choi SM, Choo SY. Antimicrobial awareness week. Public Health Wkly Rep 2021;14:3318–3319.
6. Hwang S, Kwon KT. Core elements for successful implementation of antimicrobial stewardship programs. Infect Chemother 2021;53:421–435.



7. Barlam TF, Cosgrove SE, Abbo LM, et al. Implementing an antibiotic stewardship program: guidelines by the Infectious Diseases Society of America and the Society for Healthcare Epidemiology of America. Clin Infect Dis 2016;62:e51–e77.



8. Kwon KT. Implementation of antimicrobial stewardship programs. J Korean Med Assoc 2022;65:498–504.

9. World Health Organization (WHO). Global action plan on antimicrobial resistance [Internet]. Geneva (CH): WHO, c2016 [cited 2022 Sep 9]. Available from:
https://www.who.int/publications/i/item/9789241509763
10. Ryu S. The new Korean action plan for containment of antimicrobial resistance. J Glob Antimicrob Resist 2017;8:70–73.


11. Related Ministry. National Action Plan on Antimicrobial Resisatnce (2021-2025) [Internet]. Sejong (KR): Ministry of Health and Welfare, c2021 [cited 2022 Nov 15]. Available from:
http://www.mohw.go.kr/react/al/sal0301vw.jsp?PAR_MENU_ID=04&MENU_ID=0403&page=1&CONT_SEQ=368388
12. Baur D, Gladstone BP, Burkert F, et al. Effect of antibiotic stewardship on the incidence of infection and colonisation with antibiotic-resistant bacteria and Clostridium difficile infection: a systematic review and meta-analysis. Lancet Infect Dis 2017;17:990–1001.


13. Karanika S, Paudel S, Grigoras C, Kalbasi A, Mylonakis E. Systematic review and meta-analysis of clinical and economic outcomes from the implementation of hospital-based antimicrobial stewardship programs. Antimicrob Agents Chemother 2016;60:4840–4852.



14. Cunha CB. The pharmacoeconomic aspects of antibiotic stewardship programs. Med Clin North Am 2018;102:937–946.


15. Yoon YK, Kwon KT, Jeong SJ, et al. Guidelines on implementing antimicrobial stewardship programs in Korea. Infect Chemother 2021;53:617–659.



16. Ostrowsky B, Banerjee R, Bonomo RA, et al. Infectious diseases physicians: leading the way in antimicrobial stewardship. Clin Infect Dis 2018;66:995–1003.


17. Pollack LA, Srinivasan A. Core elements of hospital antibiotic stewardship programs from the Centers for Disease Control and Prevention. Clin Infect Dis 2014;59 Suppl 3:S97–S100.



18. Nhan D, Lentz EJM, Steinberg M, Bell CM, Morris AM. Structure of antimicrobial stewardship programs in leading US hospitals: findings of a nationwide survey. Open Forum Infect Dis 2019;6:ofz104.



19. Hurst AL, Child J, Pearce K, Palmer C, Todd JK, Parker SK. Handshake stewardship: a highly effective rounding-based antimicrobial optimization service. Pediatr Infect Dis J 2016;35:1104–1110.

20. Australian Commission on Safety and Quality in Health Care. Antimicrobial Stewardship in Australian Health Care [Internet]. Sydney (AU): Australian Commission on Safety and Quality in Health Care, c2022 [cited 2022 Dec 12]. Available from:
https://www.safetyandquality.gov.au/publications-and-resources/resource-library/antimicrobial-stewardship-australian-health-care
21. The Communicable and Infectious Diseases Steering Committee Task Group on Antimicrobial Use Stewardship. Antimicrobial Stewardship: Final Reprot to the Public Health Network Council [Internet]. Ottawa (CA): Pan-Canada Public Health Network, c2016 [cited 2022 Dec 12]. Available from:
https://www.phn-rsp.ca/en/docs/antimicrobial-stewardship.pdf
22. Langford BJ, Wu JH, Brown KA, et al. Assessing the impact of antibiotic stewardship program elements on antibiotic use across acute-care hospitals: an observational study. Infect Control Hosp Epidemiol 2018;39:941–946.


23. Dellit TH, Owens RC, McGowan JE Jr, et al. Infectious Diseases Society of America and the Society for Healthcare Epidemiology of America guidelines for developing an institutional program to enhance antimicrobial stewardship. Clin Infect Dis 2007;44:159–177.


24. Le Coz P, Carlet J, Roblot F, Pulcini C. Human resources needed to perform antimicrobial stewardship teams' activities in French hospitals. Med Mal Infect 2016;46:200–206.


25. Doernberg SB, Abbo LM, Burdette SD, et al. Essential resources and strategies for antibiotic stewardship programs in the acute care setting. Clin Infect Dis 2018;67:1168–1174.


26. de With K, Allerberger F, Amann S, et al. Strategies to enhance rational use of antibiotics in hospital: a guideline by the German Society for Infectious Diseases. Infection 2016;44:395–439.



27. Ten Oever J, Harmsen M, Schouten J, et al. Human resources required for antimicrobial stewardship teams: a Dutch consensus report. Clin Microbiol Infect 2018;24:1273–1279.


28. Maeda M, Muraki Y, Kosaka T, et al. Essential human resources for antimicrobial stewardship teams in Japan: estimates from a nationwide survey conducted by the Japanese Society of Chemotherapy. J Infect Chemother 2019;25:653–656.


29. Maeda M, Muraki Y, Kosaka T, et al. The first nationwide survey of antimicrobial stewardship programs conducted by the Japanese Society of Chemotherapy. J Infect Chemother 2019;25:83–88.


30. Park SY, Chang HH, Kim B, et al. Human resources required for antimicrobial stewardship activities for hospitalized patients in Korea. Infect Control Hosp Epidemiol 2020;41:1429–1435.


31. Ji W, Hayat K, Ye D, et al. Antimicrobial stewardship programs in Northwest China: a cross-sectional survey of perceptions, involvement, and perceived barriers among hospital pharmacists. Front Pharmacol 2021;12:616503.



32. Heil EL, Kuti JL, Bearden DT, Gallagher JC. The essential role of pharmacists in antimicrobial stewardship. Infect Control Hosp Epidemiol 2016;37:753–754.


33. Waters CD. Pharmacist-driven antimicrobial stewardship program in an institution without infectious diseases physician support. Am J Health Syst Pharm 2015;72:466–468.


34. Fukuda T, Watanabe H, Ido S, Shiragami M. Contribution of antimicrobial stewardship programs to reduction of antimicrobial therapy costs in community hospital with 429 beds --before-after comparative two-year trial in Japan. J Pharm Policy Pract 2014;7:10.



35. Apisarnthanarak A, Lapcharoen P, Vanichkul P, Srisaeng-Ngoen T, Mundy LM. Design and analysis of a pharmacist-enhanced antimicrobial stewardship program in Thailand. Am J Infect Control 2015;43:956–959.


36. Mahmood RK, Gillani SW, Alzaabi MJ, Gulam SM. Evaluation of inappropriate antibiotic prescribing and management through pharmacist-led antimicrobial stewardship programmes: a meta-analysis of evidence. Eur J Hosp Pharm 2022;29:2–7.



37. Apisarnthanarak A, Kwa AL, Chiu CH, et al. Antimicrobial stewardship for acute-care hospitals: an Asian perspective. Infect Control Hosp Epidemiol 2018;39:1237–1245.


38. Seok H, Jeon JH, Park DW. Antimicrobial therapy and antimicrobial stewardship in sepsis. Infect Chemother 2020;52:19–30.



39. Kim HI, Kim SW, Chang HH, Kim HB. A survey of antimicrobial stewardship programs in Korean hospitals. Korean J Med 2014;87:173–181.

40. Mehta JM, Haynes K, Wileyto EP, et al. Comparison of prior authorization and prospective audit with feedback for antimicrobial stewardship. Infect Control Hosp Epidemiol 2014;35:1092–1099.



41. Song YJ, Kim M, Huh S, et al. Impact of an antimicrobial stewardship program on unnecessary double anaerobic coverage prescription. Infect Chemother 2015;47:111–116.



42. De Waele JJ, Schouten J, Beovic B, Tabah A, Leone M. Antimicrobial de-escalation as part of antimicrobial stewardship in intensive care: no simple answers to simple questions-a viewpoint of experts. Intensive Care Med 2020;46:236–244.



43. Briceland LL, Nightingale CH, Quintiliani R, Cooper BW, Smith KS. Antibiotic streamlining from combination therapy to monotherapy utilizing an interdisciplinary approach. Arch Intern Med 1988;148:2019–2022.


44. Bantar C, Sartori B, Vesco E, et al. A hospitalwide intervention program to optimize the quality of antibiotic use: impact on prescribing practice, antibiotic consumption, cost savings, and bacterial resistance. Clin Infect Dis 2003;37:180–186.


45. Davey P, Marwick CA, Scott CL, et al. Interventions to improve antibiotic prescribing practices for hospital inpatients. Cochrane Database Syst Rev 2017;2:CD003543.



46. Abbo LM, Cosgrove SE, Pottinger PS, et al. Medical students' perceptions and knowledge about antimicrobial stewardship: how are we educating our future prescribers? Clin Infect Dis 2013;57:631–638.


47. Ibrahim EH, Ward S, Sherman G, Schaiff R, Fraser VJ, Kollef MH. Experience with a clinical guideline for the treatment of ventilator-associated pneumonia. Crit Care Med 2001;29:1109–1115.


48. Hauck LD, Adler LM, Mulla ZD. Clinical pathway care improves outcomes among patients hospitalized for community-acquired pneumonia. Ann Epidemiol 2004;14:669–675.


49. Choi H, Ahn H, Lee R, Cho SY, Lee DG. Bloodstream infections in patients with hematologic diseases: causative organisms and factors associated with resistance. Infect Chemother 2022;54:340–352.



50. Gulliford MC, Prevost AT, Charlton J, et al. Effectiveness and safety of electronically delivered prescribing feedback and decision support on antibiotic use for respiratory illness in primary care: REDUCE cluster randomised trial. BMJ 2019;364:l236.



51. Patterson PP, Ellingson KD, Backus D, Schmitz E, Matesan M. A syndrome-based approach to antimicrobial stewardship in an Arizona skilled nursing facility-moving the needle through quality improvement. Am J Infect Control 2020;48:1537–1539.


52. Haas MK, Dalton K, Knepper BC, et al. Effects of a syndrome-specific antibiotic stewardship intervention for inpatient community-acquired pneumonia. Open Forum Infect Dis 2016;3:ofw186.



53. Mediwala KN, Kohn JE, Bookstaver PB, et al. Syndrome-specific versus prospective audit and feedback interventions for reducing use of broad-spectrum antimicrobial agents. Am J Infect Control 2019;47:1284–1289.


54. Coates ARM, Hu Y, Holt J, Yeh P. Antibiotic combination therapy against resistant bacterial infections: synergy, rejuvenation and resistance reduction. Expert Rev Anti Infect Ther 2020;18:5–15.


55. Harbarth S, Garbino J, Pugin J, Romand JA, Lew D, Pittet D. Inappropriate initial antimicrobial therapy and its effect on survival in a clinical trial of immunomodulating therapy for severe sepsis. Am J Med 2003;115:529–535.


56. Kalil AC, Metersky ML, Klompas M, et al. Management of adults with hospital-acquired and ventilator-associated pneumonia: 2016 clinical practice guidelines by the Infectious Diseases Society of America and the American Thoracic Society. Clin Infect Dis 2016;63:e61–e111.



57. Baddour LM, Wilson WR, Bayer AS, et al. Infective endocarditis in adults: diagnosis, antimicrobial therapy, and management of complications: a scientific statement for healthcare professionals from the American Heart Association. Circulation 2015;132:1435–1486.

58. Tamma PD, Cosgrove SE, Maragakis LL. Combination therapy for treatment of infections with gram-negative bacteria. Clin Microbiol Rev 2012;25:450–470.



59. Williams P, Cotta MO, Roberts JA. Pharmacokinetics/pharmacodynamics of β-lactams and therapeutic drug monitoring: from theory to practical issues in the intensive care unit. Semin Respir Crit Care Med 2019;40:476–487.


60. Chastre J, Wolff M, Fagon JY, et al. Comparison of 8 vs 15 days of antibiotic therapy for ventilator-associated pneumonia in adults: a randomized trial. JAMA 2003;290:2588–2598.


61. Hepburn MJ, Dooley DP, Skidmore PJ, Ellis MW, Starnes WF, Hasewinkle WC. Comparison of short-course (5 days) and standard (10 days) treatment for uncomplicated cellulitis. Arch Intern Med 2004;164:1669–1674.


62. Sandberg T, Skoog G, Hermansson AB, et al. Ciprofloxacin for 7 days versus 14 days in women with acute pyelonephritis: a randomised, open-label and double-blind, placebo-controlled, non-inferiority trial. Lancet 2012;380:484–490.


63. Sawyer RG, Claridge JA, Nathens AB, et al. Trial of short-course antimicrobial therapy for intraabdominal infection. N Engl J Med 2015;372:1996–2005.



64. Chotiprasitsakul D, Han JH, Cosgrove SE, et al. Comparing the outcomes of adults with enterobacteriaceae bacteremia receiving short-course versus prolonged-course antibiotic therapy in a multicenter, propensity score-matched cohort. Clin Infect Dis 2018;66:172–177.



65. Omidvari K, de Boisblanc BP, Karam G, Nelson S, Haponik E, Summer W. Early transition to oral antibiotic therapy for community-acquired pneumonia: duration of therapy, clinical outcomes, and cost analysis. Respir Med 1998;92:1032–1039.


66. Siegel RE, Halpern NA, Almenoff PL, Lee A, Cashin R, Greene JG. A prospective randomized study of inpatient iv. antibiotics for community-acquired pneumonia. the optimal duration of therapy. Chest 1996;110:965–971.


67. Carratalà J, Garcia-Vidal C, Ortega L, et al. Effect of a 3-step critical pathway to reduce duration of intravenous antibiotic therapy and length of stay in community-acquired pneumonia: a randomized controlled trial. Arch Intern Med 2012;172:922–928.

68. Yoon YK, Yang KS, Lee SE, Kim HJ, Sohn JW, Kim MJ. Effects of group 1 versus group 2 carbapenems on the susceptibility of Acinetobacter baumannii to carbapenems: a before and after intervention study of carbapenem-use stewardship. PLoS One 2014;9:e99101.



69. Zequinão T, Telles JP, Gasparetto J, Tuon FF. Carbapenem stewardship with ertapenem and antimicrobial resistance-a scoping review. Rev Soc Bras Med Trop 2020;53:e20200413.



70. McCollum M, Rhew DC, Parodi S. Cost analysis of switching from i.v. vancomycin to p.o. linezolid for the management of methicillin-resistant Staphylococcus species. Clin Ther 2003;25:3173–3189.


71. Huang AM, Newton D, Kunapuli A, et al. Impact of rapid organism identification via matrix-assisted laser desorption/ionization time-of-flight combined with antimicrobial stewardship team intervention in adult patients with bacteremia and candidemia. Clin Infect Dis 2013;57:1237–1245.


72. Bauer KA, West JE, Balada-Llasat JM, Pancholi P, Stevenson KB, Goff DA. An antimicrobial stewardship program's impact with rapid polymerase chain reaction methicillin-resistant Staphylococcus aureus/S. aureus blood culture test in patients with S. aureus bacteremia. Clin Infect Dis 2010;51:1074–1080.


73. Banerjee R, Teng CB, Cunningham SA, et al. Randomized trial of rapid multiplex polymerase chain reaction-based blood culture identification and susceptibility testing. Clin Infect Dis 2015;61:1071–1080.



74. Park DH, Chang E, Kang CK, et al. A direct rapid phenotypic antimicrobial susceptibility test enables early selection of optimal antibiotics to treat bacteremia in COVID-19 patients. Infect Chemother 2021;53:776–785.



75. Bonner AB, Monroe KW, Talley LI, Klasner AE, Kimberlin DW. Impact of the rapid diagnosis of influenza on physician decision-making and patient management in the pediatric emergency department: results of a randomized, prospective, controlled trial. Pediatrics 2003;112:363–367.


76. Srinivas P, Rivard KR, Pallotta AM, et al. Implementation of a stewardship initiative on respiratory viral PCR-based antibiotic deescalation. Pharmacotherapy 2019;39:709–717.


77. Peiffer-Smadja N, Bouadma L, Mathy V, et al. Performance and impact of a multiplex PCR in ICU patients with ventilator-associated pneumonia or ventilated hospital-acquired pneumonia. Crit Care 2020;24:366.



78. Bukowski PM, Jacoby JS, Jameson AP, Dumkow LE. Implementation of rapid diagnostic testing without active stewardship team notification for gram-positive blood cultures in a community teaching hospital. Antimicrob Agents Chemother 2018;62:e01334–18.



79. Avdic E, Wang R, Li DX, et al. Sustained impact of a rapid microarray-based assay with antimicrobial stewardship interventions on optimizing therapy in patients with gram-positive bacteraemia. J Antimicrob Chemother 2017;72:3191–3198.


80. Coupat C, Pradier C, Degand N, Hofliger P, Pulcini C. Selective reporting of antibiotic susceptibility data improves the appropriateness of intended antibiotic prescriptions in urinary tract infections: a case-vignette randomised study. Eur J Clin Microbiol Infect Dis 2013;32:627–636.


81. Tan TY, McNulty C, Charlett A, Nessa N, Kelly C, Beswick T. Laboratory antibiotic susceptibility reporting and antibiotic prescribing in general practice. J Antimicrob Chemother 2003;51:379–384.


82. McNulty CA, Lasseter GM, Charlett A, et al. Does laboratory antibiotic susceptibility reporting influence primary care prescribing in urinary tract infection and other infections? J Antimicrob Chemother 2011;66:1396–1404.


83. Bouadma L, Luyt CE, Tubach F, et al. Use of procalcitonin to reduce patients' exposure to antibiotics in intensive care units (PRORATA trial): a multicentre randomised controlled trial. Lancet 2010;375:463–474.


84. Prkno A, Wacker C, Brunkhorst FM, Schlattmann P. Procalcitonin-guided therapy in intensive care unit patients with severe sepsis and septic shock--a systematic review and meta-analysis. Crit Care 2013;17:R291.



85. Voiriot G, Fartoukh M, Durand-Zaleski I, et al. Combined use of a broad-panel respiratory multiplex PCR and procalcitonin to reduce duration of antibiotics exposure in patients with severe community-acquired pneumonia (MULTI-CAP): a multicentre, parallel-group, open-label, individual randomised trial conducted in French intensive care units. BMJ Open 2021;11:e048187.



86. Moradi T, Bennett N, Shemanski S, Kennedy K, Schlachter A, Boyd S. Use of procalcitonin and a respiratory polymerase chain reaction panel to reduce antibiotic use via an electronic medical record alert. Clin Infect Dis 2020;71:1684–1689.



87. Mullett CJ, Evans RS, Christenson JC, Dean JM. Development and impact of a computerized pediatric antiinfective decision support program. Pediatrics 2001;108:E75.


88. Patel J, Esterly JS, Scheetz MH, Bolon MK, Postelnick MJ. Effective use of a clinical decision-support system to advance antimicrobial stewardship. Am J Health Syst Pharm 2012;69:1543–1544.


89. Bochicchio GV, Smit PA, Moore R, et al. Pilot study of a web-based antibiotic decision management guide. J Am Coll Surg 2006;202:459–467.


90. Fralick M, Haj R, Hirpara D, et al. Can a smartphone app improve medical trainees' knowledge of antibiotics? Int J Med Educ 2017;8:416–420.



91. Hoff BM, Ford DC, Ince D, et al. Implementation of a mobile clinical decision support application to augment local antimicrobial stewardship. J Pathol Inform 2018;9:10.



92. Australian Commission on Safety and Quality in Health Care. AURA 2019: Third Australian report on antimicrobial use and resistance in human health [Internet]. Sydney (AU): Australian Commission on Safety and Quality in Health Care, c2019 [cited 2022 May 20]. Available from:
https://www.safetyandquality.gov.au/publications-and-resources/resource-library/aura-2019-third-australian-report-antimicrobial-use-and-resistance-human-health
93. National Healthcare Safety Network. Use and Resistance (AUR) Module [Internet]. Atlanta (GA): CDC, c2021 [cited 2022 May 18]. Available from:
https://www.cdc.gov/nhsn/pdfs/pscmanual/11pscaurcurrent.pdf
94. Public Health England. English surveillance programme for antimicrobial utilisation and resistance (ESPAUR) report [Internet]. London (UK): Public Health England, c2021 [cited 2022 Dec 12]. Available from:
https://webarchive.nationalarchives.gov.uk/ukgwa/20211022024510/https://www.gov.uk/government/publications/english-surveillance-programmeantimicrobial-utilisation-and-resistance-espaur-report
95. Public Health Agency of Canada. Canadian Antimicrobial Resistance Surveillance System Report [Internet]. Ottawa (CA): Public Health Agency of Canada, c2020 [cited 2021 May 25]. Available from:
https://www.canada.ca/en/public-health/services/publications/drugs-health-products/canadian-antimicrobial-resistance-surveillance-system-2020-report.html
96. Kim B, Ahn SV, Kim DS, et al. Development of the Korean standardized antimicrobial administration ratio as a tool for benchmarking antimicrobial use in each hospital. J Korean Med Sci 2022;37:e191.



97. O'Leary EN, Edwards JR, Srinivasan A, et al. National Healthcare Safety Network Standardized Antimicrobial Administration Ratios (SAARs): a progress report and risk modeling update using 2017 data. Clin Infect Dis 2020;71:e702–e709.



98. Korea Disease Control and Prevention Agency (KDCA). A Report on the Development of a Roadmap for Monitoring Antibiotic Usage Applicable to Medical Institutions in Korea [Internet]. Cheongju (KR): KDCA, c2021 [cited 2022 Nov 15]. Available from:
https://www.medric.or.kr/Uploads/Project/20210218547-00_1613358277485_%EC%A0%95%EC%B1%85%EC%97%B0%EA%B5%AC%EC%9A%A9%EC%97%AD%EC%82%AC%EC%97%85%20%EC%A0%9C%EC%95%88%EC%9A%94%EC%B2%AD%EC%84%9C(%ED%95%AD%EC%83%9D%EC%A0%9C%20%EC%82%AC%EC%9A%A9%EB%9F%89%20%EA%B0%90%EC%8B%9C%EC%B2%B4%EA%B3%84).hwp
99. Centers for Disease Control and Prevention (CDC). Core Elements of Hospital Antibiotic Stewardship Programs [Internet]. Atlanta (GA): CDC, c2019 [cited 2022 Aug 22]. Available from:
https://www.cdc.gov/antibiotic-use/core-elements/hospital.html
100. Tacconelli E, De Angelis G, Cataldo MA, et al. Antibiotic usage and risk of colonization and infection with antibiotic-resistant bacteria: a hospital population-based study. Antimicrob Agents Chemother 2009;53:4264–4269.



101. Kim B, Kim Y, Hwang H, et al. Trends and correlation between antibiotic usage and resistance pattern among hospitalized patients at university hospitals in Korea, 2004 to 2012: a nationwide multicenter study. Medicine (Baltimore) 2018;97:e13719.


102. Kim YA, Park YS, Youk T, Lee H, Lee K. Trends in South Korean antimicrobial use and association with changes in Escherichia coli resistance rates: 12-year ecological study using a nationwide surveillance and antimicrobial prescription database. PLoS One 2018;13:e0209580.



103. Cisneros JM, Neth O, Gil-Navarro MV, et al. Global impact of an educational antimicrobial stewardship programme on prescribing practice in a tertiary hospital centre. Clin Microbiol Infect 2014;20:82–88.


104. Molina J, Peñalva G, Gil-Navarro MV, et al. Long-term impact of an educational antimicrobial stewardship program on hospital-acquired candidemia and multidrug-resistant bloodstream infections: a quasi-experimental study of interrupted time-series analysis. Clin Infect Dis 2017;65:1992–1999.

105. Hwang H, Kim B. Impact of an infectious diseases specialist-led antimicrobial stewardship programmes on antibiotic use and antimicrobial resistance in a large Korean hospital. Sci Rep 2018;8:14757.



106. Owens RC Jr, Shorr AF, Deschambeault AL. Antimicrobial stewardship: shepherding precious resources. Am J Health Syst Pharm 2009;66 Suppl 4:S15–S22.


107. Kim B, Kim J, Pai H. Association between antibiotic consumption and incidence of Clostridioides difficile infection in a hospital. J Korean Med Sci 2020;35:e407.



108. Talpaert MJ, Gopal Rao G, Cooper BS, Wade P. Impact of guidelines and enhanced antibiotic stewardship on reducing broad-spectrum antibiotic usage and its effect on incidence of Clostridium difficile infection. J Antimicrob Chemother 2011;66:2168–2174.


109. Price J, Cheek E, Lippett S, et al. Impact of an intervention to control Clostridium difficile infection on hospital- and community-onset disease; an interrupted time series analysis. Clin Microbiol Infect 2010;16:1297–1302.


110. Kallen AJ, Thompson A, Ristaino P, et al. Complete restriction of fluoroquinolone use to control an outbreak of Clostridium difficile infection at a community hospital. Infect Control Hosp Epidemiol 2009;30:264–272.


111. McDonald LC, Gerding DN, Johnson S, et al. Clinical practice guidelines for clostridium difficile infection in adults and children: 2017 update by the Infectious Diseases Society of America (IDSA) and Society for Healthcare Epidemiology of America (SHEA). Clin Infect Dis 2018;66:987–994.


112. Kim SH, Wi YM. Current strategy and perspective view for preventing Clostridioides difficile infection in acute care facilities. Korean J healthc assoc Infect Control Prev 2021;26:70–82.

113. Honda H, Murakami S, Tagashira Y, et al. Efficacy of a postprescription review of broad-spectrum antimicrobial agents with feedback: a 4-year experience of antimicrobial stewardship at a tertiary care center. Open Forum Infect Dis 2018;5:ofy314.



114. Akazawa T, Kusama Y, Fukuda H, et al. Eight-year experience of antimicrobial stewardship program and the trend of carbapenem use at a tertiary acute-care hospital in Japan-the impact of postprescription review and feedback. Open Forum Infect Dis 2019;6:ofz389.



115. Al-Omari A, Al Mutair A, Alhumaid S, et al. The impact of antimicrobial stewardship program implementation at four tertiary private hospitals: results of a five-years pre-post analysis. Antimicrob Resist Infect Control 2020;9:95.



116. Park SM, Kim HS, Jeong YM, et al. Impact of intervention by an antimicrobial stewardship team on conversion from intravenous to oral fluoroquinolones. Infect Chemother 2017;49:31–37.



117. Meeker D, Linder JA, Fox CR, et al. Effect of behavioral interventions on inappropriate antibiotic prescribing among primary care practices: a randomized clinical trial. JAMA 2016;315:562–570.



118. Kiefe CI, Allison JJ, Williams OD, Person SD, Weaver MT, Weissman NW. Improving quality improvement using achievable benchmarks for physician feedback: a randomized controlled trial. JAMA 2001;285:2871–2879.


119. Patel SJ, Saiman L, Duchon JM, Evans D, Ferng YH, Larson E. Development of an antimicrobial stewardship intervention using a model of actionable feedback. Interdiscip Perspect Infect Dis 2012;2012:150367.



120. Lee H, Yoon EJ, Kim D, et al. Establishment of the South Korean national antimicrobial resistance surveillance system, Kor-GLASS, in 2016. Euro Surveill 2018;23:1700734.



121. Kim D, Ahn JY, Lee CH, et al. Increasing resistance to extended-spectrum cephalosporins, fluoroquinolone, and carbapenem in gram-negative bacilli and the emergence of carbapenem non-susceptibility in Klebsiella pneumoniae: analysis of Korean Antimicrobial Resistance Monitoring System (KARMS) data from 2013 to 2015. Ann Lab Med 2017;37:231–239.



122. Korea Disease Control and Prevention Agency. One Health Antimicrobial resistant organism [Internet]. Cheongju (KR): Korea Disease Control and Prevention Agency, c2022 [cited 2022 Dec 12]. Available from:
http://www.kdca.go.kr/nohas/
123. Duke Antimicrobial Stewardship Outbreak Network (DASON). Duke Antimicrobial Stewardship Outreach Network homepage. [Internet]. Durham (NC): DASON, c2016 [cited 2022 Dec 12]. Available from:
https://dason.medicine.duke.edu/
124. Belongia EA, Knobloch MJ, Kieke BA, Davis JP, Janette C, Besser RE. Impact of statewide program to promote appropriate antimicrobial drug use. Emerg Infect Dis 2005;11:912–920.


125. Carling P, Fung T, Killion A, Terrin N, Barza M. Favorable impact of a multidisciplinary antibiotic management program conducted during 7 years. Infect Control Hosp Epidemiol 2003;24:699–706.


126. Landgren FT, Harvey KJ, Mashford ML, Moulds RF, Guthrie B, Hemming M. Changing antibiotic prescribing by educational marketing. Med J Aust 1988;149:595–599.


128. Weiss K, Blais R, Fortin A, Lantin S, Gaudet M. Impact of a multipronged education strategy on antibiotic prescribing in Quebec, Canada. Clin Infect Dis 2011;53:433–439.


129. Regev-Yochay G, Raz M, Dagan R, et al. Reduction in antibiotic use following a cluster randomized controlled multifaceted intervention: the Israeli judicious antibiotic prescription study. Clin Infect Dis 2011;53:33–41.


130. Garcia Reeves AB, Lewis JW, Trogdon JG, Stearns SC, Weber DJ, Weinberger M. Association between statewide adoption of the CDC's core elements of hospital antimicrobial stewardship programs and rates of methicillin-resistant Staphylococcus aureus bacteremia and Clostridioides difficile infection in the United States. Infect Control Hosp Epidemiol 2020;41:430–437.


131. Yoo M, Madaras-Kelly K, Nevers M, et al. A Veterans' Healthcare Administration (VHA) antibiotic stewardship intervention to improve outpatient antibiotic use for acute respiratory infections: a cost-effectiveness analysis. Infect Control Hosp Epidemiol 2022;43:1389–1395.


132. Madaras-Kelly K, Hostler C, Townsend M, et al. Impact of implementation of the core elements of outpatient antibiotic stewardship within veterans health administration emergency departments and primary care clinics on antibiotic prescribing and patient outcomes. Clin Infect Dis 2021;73:e1126–e1134.


A multidisciplinary team responsible for implementing antimicrobial stewardship. Adapted from Yoon et al. [15]. ASP, antimicrobial stewardship program; ID, infectious disease.
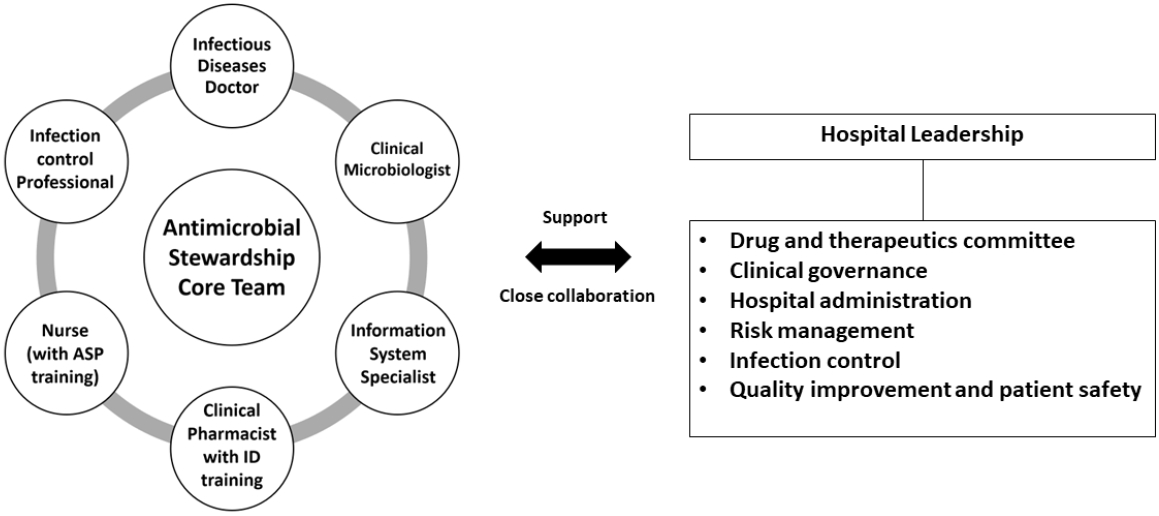
Figure 1.
Core strategies of antimicrobial stewardship. Comparison of formulary restriction and preauthorization to a prospective audit with feedback.
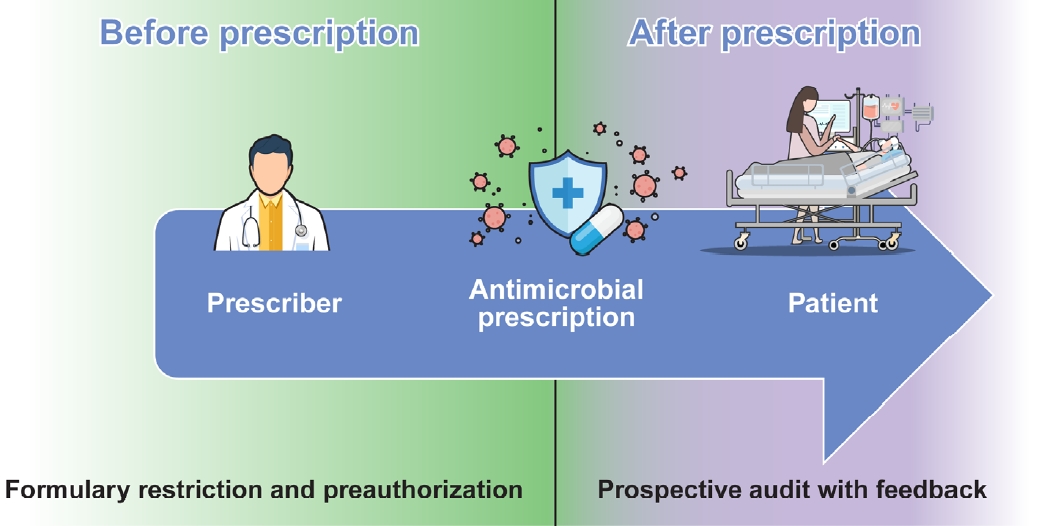
Figure 2.
Core elements of an antimicrobial stewardship program. ASP, antimicrobial stewardship program; MDRO, multi-drug resistant organism.
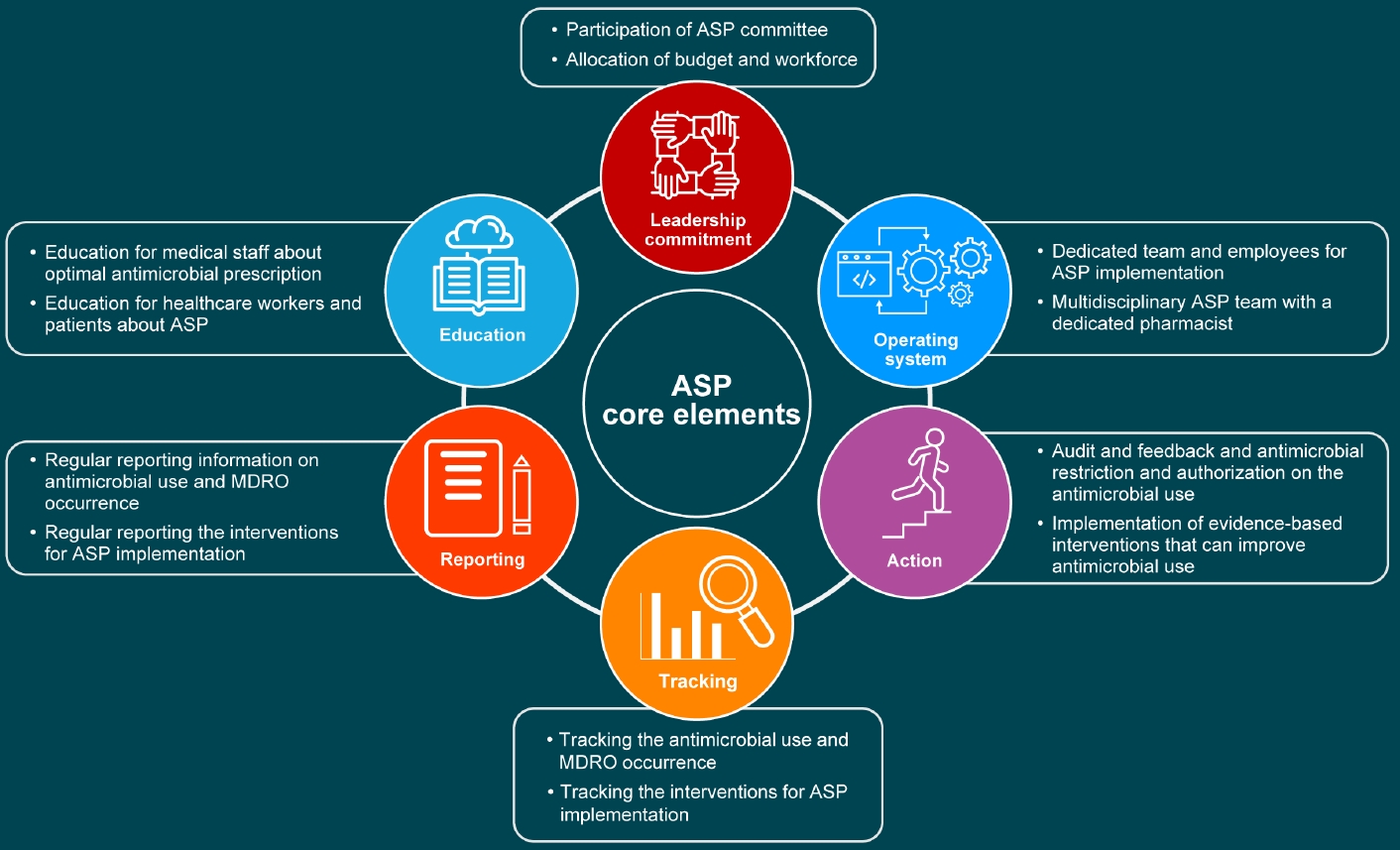
Figure 3.
Table 1.
Role of the dedicated pharmacist in charge of antimicrobial stewardship programs
Table 2.
Comparison of Korea Global Antimicrobial Resistance Surveillance System and Korean Antimicrobial Resistance Monitoring System
항생제 사용관리 프로그램 체크리스트




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




