|
 |
| Korean J Med > Volume 80(2); 2011 > Article |
|
요약
목적:
췌장이식은 인슐린 의존형 당뇨병에서 1966년 미네소타대학 병원에서 처음 시행된 수술로써 인슐린을 끊을 수 있는 유일한 치료법으로 이식수술 후 합병증의 감소, 면역억제제 및 수술 후 관리의 개선으로 널리 시행되고 있다. 국내에서는 1992년 첫 췌장이식이 시행된 이래 점차 늘어가고 있지만 아직 활발히 이루어지고 있지는 못하다. 이에 저자들은 1992년 7월부터 2009년 12월까지 국내 단일기관에서 시행한 췌장이식의 임상 결과를 분석하여 보고하고자 한다.
방법:
본원에서는 1992년 7월 이후 2009년 12월까지 18년간119명의 당뇨병 환자에서 췌장이식을 시행한바 이를 후향적으로 분석하여 췌장 이식의 임상적인 결과를 분석하였다.
결과:
이식수혜자의 당뇨병 분류로 총 119명 중 인슐린 의존형이 93명(78.2%)이었고, 16명(13.4%)에서는 Type II형 이었다. 기증자는 뇌사자가 107명(89.9%), 그리고 12명(10.1%)에서는 가족간 생체기증이었다. 당뇨합병증으로 신ㆍ췌장 동시 이식이 67명(56.3%)이었고, 42명(35.3%)에서는 췌장단독이식, 10명(8.4%)에서는 이미 신장이식을 받은 환자에서 췌장이식이 시행되었다. 수술 후 췌장 이식편 생존율은 81.6%(1년), 63.4% (5년), 그리고 57.1% (10년)이었다. 면역억제제로 tacrolimus와 MMF를 사용한 1999년 이후(n=96) 췌장 이식편 생존율은 89.1% (1년), 72.9% (5년), 그리고 66.2% (10년)이었고, 환자의 생존율은 93.0% (1년), 86.0% (5년), 그리고 86%(10년)이었다.
Abstract
Background/Aims:
Pancreas transplantation (PT) as the ultimate treatment for insulin-dependent diabetes has been the subject of debate clinically. Marked improvements in patient and graft survival, and decreases in postoperative morbidity have been achieved due to technical refinements, improved immunosuppressants, and better postoperative management. Here, we report our 18-year experience with PT performed at our institute.
Methods:
All recipients who underwent deceased donor or living donor PT between July 1992 and December 2009 were included. We reviewed the medical records, including operation records, progress, and laboratory findings during follow-up. Graft and patient survival were analyzed using the Kaplan-Meier method.
Results:
In total, 119 cases of pancreas transplantation were performed between July 1992 and December 2009 at our institute. Indications for pancreas transplantation were type I diabetes in 93 (78.2%) patients and type II diabetes in 16 (13.4%) patients. The transplanted pancreas was obtained from a deceased donor in 108 cases (90.8%) and a living donor in 11 cases (9.2%). Median follow-up duration was 39.3 months posttransplantation (range 0~176 months). Overall graft survival rates at 1, 5, and 10 years were 81.6%, 63.4%, and 57.1%, respectively. Following the introduction of tacrolimus as an immunosuppressant in 1999, graft survival at 1, 5, and 10 years was 89.1%, 72.9%, and 66.2%, and overall patient survival at 1, 5, and 10 years was 93.0%, 86.0%, and 86.%, respectively.
당뇨병이 서구에서의 통계에 의하면 전 인구의 5~9%에서 발생되며 매년 그 수가 증가되고 있고, 그 중 인슐린 분비장애로 인한 당뇨병은 10% 전후로 알려지고 있다[1,2]. 국내에서의 당뇨병 현황도 전 인구의 5.92%이며 전체 당뇨병 유병률 또한 증가 추세다[3].
이러한 당뇨병은 전반적인 말초혈관 병변을 야기하여 거의 모든 장기에 병소를 야기한다. 당뇨병에서의 망막병변은 성인에서의 실명유발에 가장 큰 요인이 되며 심근경색은 정상인에 비해 2~3배 높은 빈도를 보이고 당뇨병에서의 하지 혈액 순환장애로 인한 하지 절단은 10%에 이른다. 특히 췌장이식의 대표적인 적용대상인 인슐린 의존형 당뇨병 환자에서는 말초혈관 질환의 조기 진행으로 젊은 나이에 신부전증, 신경병변, 실명 등의 합병증이 야기되어 이로 인해 조기사망의 원인이 된다[4]. 이러한 당뇨병의 치료는 1921년 Banting, Best에 의해 인슐린 치료법으로 합병증을 줄이는 기여를 해 왔으나 이러한 인슐린 치료는 당뇨병의 합병증 예방에 있어서 한계점을 보이고 있다. DCCT (The Diabetes Control and Complications Trial)에서의 보고에 의하면 혈당을 정상 가까이 유지할수록 당뇨병성 2차 합병증을 줄일 수 있어서 고혈당이 당뇨합병증의 원인으로 간주된다[5]. 그러나 이러한 적극적인 인슐린 치료에는 환자 스스로의 엄격한 관리와 사용 인슐린의 부작용 특히 빈번한 저혈당증의 부작용을 감수해야 하며 이러한 치료에도 불구하고 HbA1c의 정상 유지와 당뇨합병증의 완전한 예방이 불가능하다. 또한 하루에 2~3회의 인슐린 주사요법을 평생 해야 하는 환자나 그 가족의 심적, 육체적 고충과 어려움은 의학적 합병증 이상의 부담이 되고 있다.
당뇨병에서의 췌장이식술은 이러한 인슐린 치료의 한계점을 극복하고 정상의 장기로 대체하는 치료법으로서 1966년 미네소타 대학의 Kelly 등이 사체 공여자에서 부분췌장이식술을 시행한 이후[6] 장기이식 후 사용하는 면역억제제의 개발과 수술 술기의 발전, 그리고 수술 후 환자관리의 개선 등으로 International Pancreas Transplantation Registry (IPTR)의 자료에 의하면 오늘날 전 세계적으로 300여 개 이상의 이식센터에서 30,000예 이상의 췌장이식이 시행되었고, 그 중 미국에서 22,000예, 유럽에서 8,000예가 시행되었다[7].
우리나라에서는 1992년 7월 울산의대 서울아산병원에서 저자들에 의해 처음으로 신부전증을 수반한 제1형 당뇨병환자에게 뇌사자로부터 신장, 췌장 동시이식이 성공적으로 시행되었고[8,9] 2009년까지 119예를 시행하였으며 기타 7개의 이식센터에서 시행된 예를 포함하여 국내에서 총182예의 췌장이식이 시행되었으나[10] 아직 서구에 비해 활성화 되어있지 않다. 이것은 공여 뇌사자의 절대적 부족과 췌장 이식에 관한 인식 부족 등이 그 원인으로 개선이 필요하겠다.
이에 본 연구자들은 1992년 7월부터 2009년 12월까지 국내단일기관에서 시행한 췌장이식의 임상 결과를 분석하여 보고하고자 한다.
119예에 대해, 수혜자에 대한 자료로 나이, 성별, 신체 검진 소견, 수술적응증, 수술방법, 수술 후 경과, 합병증 등에 대해 수술 기록, 입원 및 외래경과기록 등의 의무기록과 검사소견 등을 수집하였으며, 기증자의 자료로는 뇌사 판정진행 시의 의무 기록 또는 생체 기증자의 의무기록 등을 수집하였으며 후향적으로 분석하였다.
췌장 이식편 부전(graft failure)은 췌장이식 후 혈당조절을 위한 인슐린의 재투여로 정의되었으며, 췌장 이식편의 거부반응의 진단은 신ㆍ췌장 동시 이식 또는 신장 이식 후 췌장이식을 받은 환자에서는 신장 조직검사를 통해 진단되었으며, 췌장 단독이식으로 췌장액이 방광으로 배액되는 경우 요 아밀라아제가 50% 이하로 감소한 경우 거부반응으로 진단하였다. 일부 췌장 단독이식 후에 방광배액법에서 소장배액법으로 전환수술을 받은 환자에서는 제한적으로 췌장이식편 초음파유도 세침조직검사를 시행하여 거부반응을 진단하였다.
통계분석 방법으로는 기술적인 분석을 바탕으로 수혜자 및 기증자의 기초 자료를 분석하여, 연속형 변수에 대해서는 분포에 따라 각각 평균과 표준편차 또는 중앙값과 범위를 기술하고 t-test 또는 Mann-Whitney test를 사용하여 비교하였으며, 범주형 변수에 대해서는 Chi-square test 또는 Fisher’s exact test를 사용하여 비교 분석하였다. 췌장 이식편 생존율, rejection-free 이식편 생존율 및 환자 생존율은 Kaplan-Meier method에 의해 산출하였으며 생존율의 비교는 Log Rank test 또는 Breslow test를 이용하였다. 통계적인 유의성은 p value <0.05로 판단하였다.
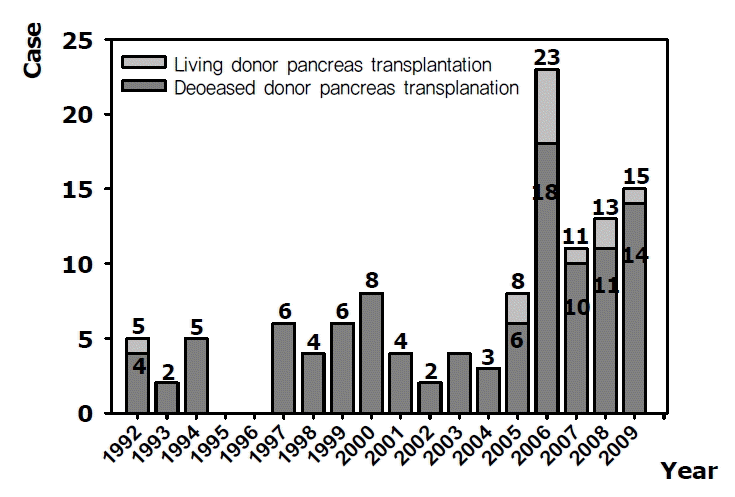
1992년 7월에 신부전증, 망막 병변에 의한 시각장애를 수반한 31세의 제 1형 당뇨병 환자에서 20세 뇌사자로부터 신ㆍ췌장 동시 이식(simultaneous pancreas kidney transplantation, SPK)을 시작으로 2009년 12월까지 119예의 췌장이식을 시행하였다(그림 1).
시행 첫 해인 1992년에 5예의 췌장이식을 시행하였으며, 2006년에는 23예로 가장 많은 췌장이식을 시행하였다. 2003년에 17세 당뇨병 환자에서 어머니로부터 췌장의 체부와 미부를 기증 받아 국내 최초로 생체 췌장 단독이식(pancreas transplantation alone, PTA)을 성공적으로 시행하였고, 2005년 합병증을 수반한 22세 제 1형 당뇨병 환자에서 어머니로부터 신ㆍ췌장을 동시에 기증 받아 생체 신ㆍ췌장 동시이식수술을 성공하였다.
2009년 9월에는 합병증을 수반한 32세 제1형 당뇨병 환자에게 남편으로부터 생체 신이식과 뇌사자로부터 췌장이식을 동시에 시행하는 생체 신장, 뇌사자 췌장 동시 이식수술(simultaneous deceased donor-pancreas living-donor kidney transplantation, SPLK)을 시행하였다.
기증자는 119예 중 뇌사자 107예, 생체기증자 12예였다. 뇌사자 107례에서 뇌사자의 성별은 남녀비는 82 vs. 25였으며 연령은 29.4±10.7세였으며, 신체질량지수(body mass index, BMI)는 21.5±2.8 kg/m2이었다. 뇌사의 원인은 외상성 46명(43.0%), 뇌혈관 질환 38명(35.5%), 저산소증 6명(5.6%), 뇌종양 4명(3.7%), 기타 14명(13.1%)이었다.
생체 기증자의 성별은 남녀비는 5 vs. 7이었으며 연령은 42.0±8.1세였으며, 신체질량지수는 21.9±2.7 kg/m2였다. 수혜자와의 관계는 부 1예, 모 4예, 여자형제 3예, 남자형제 1예, 남편 1예였다.
수혜자 119예의 특징으로 성별은 남녀비 62 vs. 57이었으며, 연령은 33.5±9.9세였으며, 당뇨병 진단 시 연령은 18.9±8.5세였다. 당뇨 합병증으로는 신경병증 15예, 망막병증 52예, 신장병증 68예에서 있었으며, 인슐린 사용량은 29.8±18.4 U였으며 신체질량지수는 20.7±2.1 kg/m2, 수술 시 C-peptide는 1.0±2.3이었다(표 1).
췌장이식의 수술 유형은 신ㆍ췌장 동시이식(simultaneous pancreas kidney transplantation, SPK) 췌장 단독이식(pancreas transplantation alone, PTA), 신장이식 후 췌장이식(pancreas transplantation after kidney transplantation, PAK)으로 나누어 볼 때 뇌사자 췌장이식에서 SPK 61예, PTA 36예, PAK 10예이었으며, SPK 1예는 뇌사자 췌장이식과 생체 신장이식을 동시에 시행한 경우였다. 생체 췌장이식에서는 SPK 6예와 PTA 6예였다. 췌장액 배액술의 방법으로는 방광을 통한 배액술(bladder drainage)이 69예였으며, 장을 통한 배액술(enteric drainage)이 50예였다. 방광을 통한 배액술을 시행 받은 50명의 환자 중에 20명에서는 반복되는 하부요로감염(6예), 대사성 산증(4예), 역류성 췌장염(4예), 누공 또는 누출(3예), 육안적 혈뇨(2예), 배뇨시 통증(2예) 기타(2예) 등의 방광을 통한 배액술과 관련된 합병증으로 장을 통한 배액술로의 전환 수술(enteric conversion)을 시행받았다(이식 수술 후 전환수술까지의 기간; 중앙값 27개월, 범위 0~124개월).
본원에서의 췌장 이식 후 사용 면역억제제는 시기에 따라 변화하였다. 먼저 1992년 7월부터 1996년 12월까지는 췌장이식을 받은 환자들(Era I, n=12)은 OKT3 (Orthoclone OKT3®, Janssen) induction을 하였고, cyclosporine (Sandimmun®, Novartis; Sandimmune Neoral®, Novartis), azathioprine (Azathioprin®, Korea United Pharm)과 스테로이드를 투여 받았으며, 1997년 1월부터 1998년 12월까지 췌장이식 수술을 받은 환자(Era II, n=11)들은 OKT3 induction을 하고 tacrolimus (Prograf®, Astellas), azathioprine과 스테로이드를 투여받았으며, 1999년 1월부터 2004년 7월에 췌장이식수술을 받은 환자들(Era III, n=24)은 IL-2 receptor antibody induction (Simulect®, Novartis)과 tacrolimus, mycophenolate mofetil (MMF, Cellcept®, Roche)과 스테로이드로 면역억제를 시행하였다. 2004년 8월부터 2009년 12월까지는(Era IV, n=61) anti-thymocyte globulin (Thymoglobulin®, Genzyme) induction과 tacrolimus, MMF/mycophenolaic acid(Myfortic®, Novartis)와 1주일 이내의 단기간 스테로이드로 면역억제를 시행하였다. 최근 2009년에는 Thymoglobulin® 국내 수급의 문제가 있었던 수 개월 사이에는 Thymoglobulin® induction 대신에 Simulect® induction을 시행하였다(n=11).
췌장이식 수술 후 외과적인 합병증으로는 이식 1개월 이내의 재원 중 사망 예는 1예(0.8%)로 idiopathic hyperammonemia로 인한 사망 예였다(표 2). 수술 후 재수술을 요하는 출혈은 17예(14.3%)에서 있었다. 췌장이식 수술 후 초기 이식편의 생존율에 직접적으로 영향을 미칠 수 있는 이식편 혈전증은 총 21예(17.6%)로 부분적 혈전증 18예, 완전 폐색 3예에서 나타났는데, 완전폐색이 있었던 3예는 모두 이식 초기에 이식편소실을 겪었다. 누공 및 누출은 9예(7.6%)에서 있었는데 이 중 2예는 이식편 제거술을 받았으며, 2예에서는 장으로의 배액술로 전환 수술을 받았으며 나머지는 비수술적 보존적인 치료를 받았다. 이식편의 역류성 췌장염은 14예(11.7%)에서 나타났으며 특히 괴사성 췌장염을 보였던 2예를 포함하여 3예는 이식편 제거술을 시행받았다.
기타 합병증으로는 25예(21.0%)에서 하부요로감염이 있었으며, 육안적 혈뇨 25예(21.0%), 대사성 산증 10예(8.4%)등이 있었으며 감염으로는 폐렴, 거대세포바이러스감염 등이 있었다.
췌장이식 후 1년 rejection-free survival rate는 77.2%였으며, 3년, 5년 10년 rejection-free survival rate는 각각 69.6%, 61.6%, 55.5%였다(표 3). 1-year rejection rate를 사용 면역억제제에 따른 군으로 나누어 보았을 때, 42.3% (Era I), 22.1% (Era II), 30.8% (Era III), 17.4% (Era IV)였다(그림 2C). Era I, II와 Era III, IV로 나누어 시기별 차이를 비교하였을 때 두 시기별 rejection-free graft survival rate는 통계적으로 유의하지 않았다(p=0.312, 그림 2B). 각 수술 유형에 따른 rejection-free graft survival은 표 3과 그림 2에서 보는 바와 같다.
1992년 이후 119명의 환자를 대상으로 한 이식 췌장의 생존율은 1년, 5년, 10년이 81.6%, 63.4% 그리고 57.1%였다. Era I, II (1998년 까지, n=23)과 Era III, IV (1999년 이후, n=96)로 나누어 보았을 때 1년, 5년, 10년 췌장 이식편 생존율은 각각 55.2%, 26.1%, 21.7%와 89.1%, 74.6%, 67.9%였다(p<0.001, 그림 3A, B). Era III, IV의 환자를 이식수술형태별로는 나누어 보았을 때, 뇌사자 SPK에서 1년, 5년, 10년 췌장 이식편 생존율은 92.4%, 86.3% 그리고 76.7%였고, PAK 및 PTA에서 1년, 5년 췌장 이식편 생존율이 83.3%, 41.7% 및 86.7%, 71.4%였다(표 4). 생체 기증자이식 12예의 1년, 5년 췌장 이식편 생존율은 80.0% 및 54.9%였다.
췌장이식 후 혈당조절을 위해 다시 인슐린 투약이 필요한 췌장 이식편 부전의 원인을 살펴보았을 때 만성 거부반응 7예, 급성 거부반응 10예, 혈전증 3예, 췌장염 3예, 누출 4예, 환자순응도 불량 5예였다(표 5).
환자 생존율은 전체 이식 환자에서 1년 5년, 10년이 93.0%, 86.0% 및 86.0%였다. Era I, II (1998년 까지, n=23)와 Era III, IV (1999년 이후, n=96)로 환자를 두 군으로 나누어 보았을 때 환자 1년 5년, 10년 생존율은 각각 82.6%, 69.6%, 69.6%와 95.5%, 91.1%, 91.1%였다(p=0.007, 그림 4A). Era III, IV (1999년 이후, n=96) 환자들을 대상으로 수술형태별로는 나누어보았을 때, 환자 생존율은 SPK에서 94.6%, 87.3%, 87.3%였고 PAK에서 100%, 100% 그리고 PTA에서 96.3%, 96.3%, 96.3%였다(p=0.384, 그림 4B). 생체기증 췌장이식 환자에서 사망례는 없었다.
당뇨병에서의 췌장이식이 1966년 Kelly 등에 의해 시행된 이후[6] 많은 기술적 향상과 면역억제제의 개발 및 수술 후 관리의 개선으로 췌장이식 후 이식 장기 생존율의 향상 및 수술합병증의 감소로 췌장이식의 적응증이 넓어지고 있다.
1992년 7월 당뇨합병증으로 투석을 시행하고 있던 31세 여자 환자에서 첫 뇌사자 기증 신ㆍ췌장 동시이식을 시작한 이래로 본원에서 시행한 췌장이식 119예 중 67예(56.3%)로 신ㆍ췌장 동시 이식이 가장 많으나, 42예(35.3%)는 췌장 단독이식으로 저혈당 및 당뇨병성 혼수의 경험이 있으나 당뇨병성 신병증으로 인한 말기 신부전이 없으며 당뇨병성 망막병증 또는 신경병증의 합병증이 없거나 합병증이 있어도 초기 단계로 경과 관찰 중인 시기에 췌장 단독이식이 시행되었다.
이는 서구에서의 결과에서 전체 췌장이식 중에 췌장 단독이식이 차지하는 비율과 비슷하다[11].
당뇨병에서 당뇨병성 말기 신부전으로 투석을 시행하는 경우 신장이식을 필요로 하고 이런 상황에서 동시 췌장이식은 수술 후 면역억제제 사용에 따른 추가적인 부담이 없으나, 당뇨병 합병증(당뇨병성 신병증, 망막병증, 신경 병증)이 없거나 합병증 초기로 아직 투석을 시행치 않는 경우 췌장 단독이식 시행에 관해서는 논란이 있을 수 있다. 그러나 수술 후 사용하는 면역억제제의 비용, 면역억제제로 인한 부작용과 췌장이식수술에 따른 합병증 등을 감안하더라도, 적극적인 인슐린 치료에도 불구하고 빈번한 심각한 급성의 대사성 합병증(저혈당, 고혈당, 케톤산증)이 더 심각하다고 판단되는 경우 췌장 단독이식의 적응증이 될 수 있겠다[12-14].
제1형의 인슐린 의존형 당뇨병에서뿐 아니라 제2형으로 C-peptide 양성인, 인슐린이 필요한 환자 16명(13.4%)에서도 성공적으로 췌장이식이 시행되어 인슐린 비의존성을 유지할 수 있었다. Gruessner와 Sutherland에 의하면 제1형뿐 아니라, 제2형 당뇨병에서의 췌장이식도 10% 미만이기는 하나 시행되고 있고 점차 증가하는 추세에 있다[15]. 당뇨병의 90%를 차지하는 모든 2형 당뇨병이 췌장이식의 대상은 아니나, 비만형이 아닌 제2형 당뇨병 환자에서 혈당 유지를 위해 인슐린을 필요로 하는 경우, 이식 후 이식 췌장에서의 인슐린 생성으로 저자의 경우나 서구에서의 결과에서도 보듯이 수술 후에 인슐린을 끊을 수 있기에 인슐린의 투여 없이 euglycemia를 유지할 수 있는 좋은 치료가 될 수 있을 것으로 생각된다. 실제 2형 당뇨병 환자에서 시간이 지남에 따라 췌장에서의 인슐린분비 장애를 야기함이 보고되고 있다[16]. 따라서 2형 당뇨병환자가 비만이 수반된 경우 체중 감소의 1차 치료를 시행하고 체중감소에도 불구하고 인슐린을 계속 사용하게 되는 경우 췌장이식의 대상이 될 수 있겠다.
췌장이식의 기증자는 대부분 뇌사자이나 일부에서 심박동 정지 상태에서 기증(donation after cardiac death)이 이뤄지기도 하고[17] 일부에서 생체기증이 이뤄진다[18,19]. 생체기증자에서는 췌장의 체부와 미부를 부분절제하여 이식한다.
뇌사 공여자인 경우 병력상 당뇨병이 있거나 췌장에 직접 외상을 받은 경우 이외에는 모두 적용이 될 수 있다. 생체공여자인 경우 당뇨병의 요인이 없어야 함으로 수술 전 정밀검사로서 공복 혈당치(공복 10~16시간), hemoglobin A1c, 경구 당부하 검사(oral glucose tolerance test, OGTT), 정맥 당부하 검사 intravenous glucose tolerance test (IVGTT), 아르기닌 자극 검사(arginine stimulation test, AST), glucose potentiation of arginineinduced insulin secretion (GPAIS), insulin auto-antibody (IAA), GAD 65 auto-antibody (GAA), islet cell antigen 512 auto-antibody(ICA512) 등이 있으며, 췌장 및 혈관 구조를 파악하기 위한 자기공명 혈관조영술/컴퓨터 단층 촬영 혈관 조영술 등의 검사가 필요하다[20].
췌장이식 수술은 기술적으로 부분 혹은 전 췌장이식 모두가 가능하다. 부분 췌장이식은 문맥상부의 췌장 경부에서 절단한 후 좌측의 체부, 미부를 적출하여 이식하는 것으로 비장동맥과 비장 정맥이 문합술에 이용된다. 부분 췌장이식은 생체나 뇌사자 모두에서 이용될 수 있으나 주로 생체이식에서 사용된다. 생체 기증자 이식은 1979년 Minnesota대학에서 처음 시행되었고, 1990년대에 와서는 생체기증자에서 췌장과 함께 신장을 적출하여 동시이식을 시행함으로서 한 번의 이식을 통해 신부전증을 수반한 당뇨병의 치유를 도모하고 최근에는 생체 기증자에서 복강경 수술 및 robot을 이용한 췌장적출술이 시도되고 있다[21,22].
전 췌장이식은 뇌사 공여자로부터의 췌장 이식에 해당되는 수술로서 전췌장과 십이지장 일부를 적출하여 이식하는 방법이다.
이식췌장을 복강 내에 위치하게 하고 신장이식과 췌장이식을 동시에 시행하는 경우 대부분 신장을 좌측, 췌장을 우측에 이식한다. 췌장관의 재건술로서는 현재 세 가지의 방법으로 시행할 수 있다.
첫 번째로 췌관-소장문합술은 췌액을 소장으로 배출시키는 방법으로 생리학적으로 가장 이상적인 방법이다. 1967년 Kelly 등[6]에 의해 시행된 이후 가장 오래된 수술방법이나, 소장절개에 따른 감염의 위험이 있다는 것이 문제점이다.
두 번째로 췌관에 polymer를 주입하여 췌관을 메우는 방법은 용액상태의 polymer가 췌장 내에 주입된 후 고체화됨으로써 췌관을 폐색시키는 방법으로 Dubernard [23]가 처음으로 시도한 후 유럽을 중심으로 시행되었던 방법이나 췌장염과 췌장의 위축이 생길 수 있어 최근에 거의 사용되지 않고 있다.
마지막으로 췌관-방광 문합술은 신장이식에서와 같은 방법에 해당된다. 1973년 Gliedman이 수혜자의 요관을 췌관에 문합술한 후 1982년 Sollinger 등이 처음으로 췌관-방광문합술을 시행하였다[24]. 이 방법은 소장절개에 따른 감염이 없고 요배설에 함유되는 췌장효소인 아밀라아제의 측정으로 거부반응 및 췌장기능의 변화를 예측할 수 있다[24,25]. 이 방법은 1990년대 초반까지 주를 이루었던 방법으로 췌장액을 소변으로 내보내는 방법이므로 방광염, 요도염 및 점막출혈 그리고 대사성 산증 등의 많은 합병증으로 생리학적으로 이상적인 방법은 아니나[26,27], 췌장이식 후에 거부반응을 진단할 수 있는 췌장 조직검사는 이식 췌장 주변이 장으로 둘러싸여 초음파 유도하에서도 접근이 용이하지 않을뿐 아니라 출혈, 췌장 누공 등의 합병증의 위험이 높다는 점을 고려할 때, 요 아밀라아제 측정을 통한 췌장 기능 및 거부반응의 모니터링이 직접적으로 가능하다는 점에서 장점이 있다.
그러나 최근에 와서 면역억제제의 개선으로 술 후 거부반응이 줄고 췌관 방광문합술은 수술 후 야기되는 여러 가지 합병증으로 인해 소장문합술을 다시 선호하는 경향이 있다[28]. 또한 신ㆍ췌장 동시이식에서 이식신장에서의 혈청 creatinine 수치 변화가 거부반응의 초기 지표로 사용됨으로써 요 아밀라아제 측정의 중요성이 감소하게 되었다.
저자들의 119예 중 방광문합술이 69예, 소장문합술이 50예로 방광문합술이 더 많았으나 최근에 와서 신ㆍ췌장 동시이식인 경우 거의 모두 소장문합술을 시행하였고 췌장 단독이식인 경우 방광문합술을 시행하고 있다. 방광문합술을 시행한 후 이에 따른 여러 가지 합병증으로 소장으로의 전환문합술이 시행된 경우가 20예(29.0%)로 저자들은 췌장 단독이식 6개월 이후 안정적인 췌장기능을 보이는 환자에서 방광문합술에 따른 합병증을 보이는 경우 적극적으로 소장문합술을 권유하여 방광 배액으로 인한 반복 입원을 줄이려 하고 있다.
기존의 일반적인 혈관 문합 수술방법으로, 췌장에서 생성되는 인슐린을 장골정맥을 통해 전신적으로 순환(systemic drainage)하게 됨으로써 말초 혈액내 고인슐린 농도(syndrome X)를 야기시켜 지방대사의 장애를 야기할 것으로 보고되기도 하였다[29]. 이에 대해 췌장의 정맥혈 배액을 상장간막 정맥을 통해 할 수 있도록 혈관 문합을 하여, 간 내로 일차로 인슐린을 순환이 되도록(portal drainage) 함으로써 정상적인 생리적인 구조에 가깝게 하려는 수술법이 개발되었다[30,31]. 이 방법으로 혈액 내 인슐린을 정상으로 유지시키고 전신적 흡수법에 비해 수술 후 거부반응도 적음이 보고되나 수술기법이 까다롭고 아직 이점이 분명치 않아 향후 연구결과를 주시하여야 할 것으로 생각된다.
췌장이식 후 관리는 타 장기이식에 비해 이식 수술 후 합병증이 많아서 이에 대한 적극적인 예방과 적절한 치료가 필요하다. 예방적 항생제를 투여하고 이식췌장 내의 동맥 혹은 정맥의 혈전에 대비한 항응고제를 사용하여야 하며 이에 따른 출혈의 부작용을 염두에 두어야 한다. 이식췌장 내의 동맥 혹은 정맥의 혈전은 초기 췌장 이식편 부전의 중요한 위험요소로 췌장단독이식이나 특히 생체 기증자 부분췌장이식에서는 항응고제의 필요성이 더욱 요구된다[10,32]. 저자들은 췌장 이식 수술 후 heparin을 사용하고 수술 후 1~2일에 조영제를 사용한 3D CT를 이용하여 췌장 문합술 부위의 혈류소통과 혈전 유무를 확인하여 항응고제 사용 기간을 결정한다[33].
췌장이식 후 거부반응의 빈도는 신장이식보다 많다고 알려져 있으며 실제로 거부반응은 췌장이식편의 장기 생존율에 가장 큰 영향을 미치는 요인 중의 하나이다. 수술 후 면역억제제 요법은 최근에 와서 tacrolimus와 mycophenolate mofetil 및 prednisone을 기본으로 하고 IL-2 수용체에 대한 항체로서 basiliximab (Simulect®, Novartis), daclizumab (Zenapax®, Roche)를 사용하고 있으며, 기타 m-TOR inhibitor (Sirolimus, Rapamune®, Pfizer), anti-thymocyte globulin (Thymoglobulin®), OKT3 및 campath-1H (Alemtuzumab, anti-CD52 antibody)를 사용하기도 한다[34,35]. 최근 steroid의 많은 부작용으로 인해 수술 후 1주 이내에 steroid를 끊거나 처음부터 steroid를 사용치 않은 시도가 보고되고 있고[36], cyclosporin이나 tacrolimus같은 calcineurin inhibitor 사용하지 않고, 유도 면역억제제로서 anti-thymocyte globulin, campath-1H 등의 항체와 함께 MMF나 sirolimus을 사용함으로써 calcineurin inhibitor의 신독성을 줄여보려는 시도가 보고되고 있다[37].
수술 후 거부반응은 조기 진단되고 조기 치료될수록 가역적인 과정을 밟아 치료 성공율을 높일 수 있다. 이식 수술 후 거부반응의 지표로서 혈당치의 상승이나 C-펩티드의 감소, 혈중 아밀라아제의 상승 이외에 췌관 방광문합술이 시행된 환자에서 요 아밀라아제 및 요산도 측정, 그리고 신장이식이 같이 시행된 환자에서 혈중 크레아티닌치의 측정 등이 이용될 수 있다. 그러나 실제 혈당치 상승이나 C-펩티드 감소는 거부반응이 이미 진행된 다음에 나타나고, 요 아밀라아제가 먼저 감소되고, 신장이식이 같이 시행된 경우 혈중 크레아티닌 증가가 혈당 증가나 C-펩티드 감소보다 먼저 나타나므로 요아밀라아제 또는 혈중 크레아티닌이 췌장 이식편 거부반응의 조기지표로 주로 사용된다. 최근에 와서 췌장의 조직검사에 의한 거부반응 진단 비율이 증가되고 있으나 그 시술이 타 장기에서보다 제한적이고 합병증이 많은 단점이 있어 거부반응의 진단에 어려움이 있다[15,24].
IPTR (International Pancreas Transplant Registry)의 보고에 의하면 1999년부터 2004년 중반까지 시행된 뇌사자 췌장이식 후 1년 환자 생존율이 췌장 단독이식(PTA)에서 97.7%, 신ㆍ췌장 동시이식(SPK)에서 95.2%, 신이식 후 췌장이식(PAK)에서 95.5%이었으며, 췌장 이식편의 1년 생존율은 신ㆍ췌장 동시이식에서 85.5%, 신이식 후 췌장이식에서 79.6%, 췌장단독이식에서 78%로 신장이식에는 못 미치나 향상된 성적을 보여주고 있다[28].
Registry에 의하면 췌장 이식편 생존율에 영향을 주는 여러 요인 중 신ㆍ췌장 동시이식이 췌장단독 이식보다 생존율이 높으며 사용하는 면역억제제의 종류, 수혜자의 연령, 재이식술 등이 예후에 영향을 미치는 요인이었다[28].
우리나라에서는 아직 췌장이식의 예가 많지 않아서 그 결과를 논하기는 이르나 저자들의 결과에 의하면 환자 생존율은 93% (1년), 86% (5년), 86% (10년)이고, 수술 후 거부반응을 면역억제제 투여에 따른 시대별로 나누어 보았을 때 초기 cyclosporin을 주로 한 면역억제제 사용시기(Era I)에서 1년 거부반응 발생률은 44.2%였으며 1999년 tacrolimus를 사용한 이후, Thymoglobulin® induction을 시행한 Era IV에서는 1년 거부반응 발생률이 17.4%이었다. 또한 췌장 이식편 생존율은 1992년 이후 81.6% (1년), 63.4% (5년), 57.1% (10년)나 1999년 이후 tacrolimus와 MMF를 사용한 이후 췌장 이식편 생존율은 89.1% (1년), 72.9% (5년) 그리고 66.2% (10년)를 나타내었다. 1999년 이후 graft survival의 향상은 개선된 면역억제제의 사용과 초기 경험을 바탕으로 한 수술 술기의 안정성 및 수술 후 환자관리의 개선 등으로 췌장이식 후 환자 및 장기 생존율의 향상과 수술 후 합병증의 감소에 기인한 것으로 여겨진다.
당뇨병은 인슐린 치료에도 불구하고 합병증이 발생하여 시력을 잃거나 신장기능의 상실과 신경기능의 장애를 야기한다. 따라서 췌장이식 후 이러한 합병증의 결과를 관찰함은 췌장이식의 필요성을 밝힘에 있어서 중요하다.
췌장 단독이식 후 반복적으로 신장조직 검사를 시행한 바, 당뇨병에 의한 사구체 병변의 진행이 더 이상 관찰되지 않았고 이러한 소견은 대조군으로 신이식만 시행 받은 당뇨병 환자와 비교가 되었다[38]. 당뇨병성 신경병증으로 인한 운동신경 및 감각신경 장애는 성공적인 췌장이식으로 정상 혈당이 유지되면 신경전도율이 빨라져 회복됨이 관찰되나 개개인에 따라 회복기간이 다양하다. 그러나 당뇨병성 망막병증은 성공적인 췌장이식 후라도 진행됨이 관찰되었으나 정상혈당이 유지되면 수술 후 3년 이후에는 망막병변이 안 정화됨이 보고되었다[39]. 보고자에 따라서 결막미세혈관병변이 췌장이식 후 호전되고, 망막의 신경전도율이 호전되나 대부분 진행성 망막병변에서 췌장이식 후 성과는 기대 이하인 것 같다. 이러한 결과는 특히 당뇨병성 망막병증의 진행을 고려할 때 합병증의 초기단계에 췌장이식이 필요함을 뒷받침하는 근거가 되기도 한다.
저자들의 경험에서 당뇨병성 신경병증, 특히 감각신경장애가 수술 후 수 개월 사이에 호전되는 경우들을 경험하였으나 망막 병변에서의 호전은 관찰할 수 없었고 오히려 수술 직후 망막변변의 일부 악화는 수술전 적극적인 안과적 치료의 필요성과 함께 수술 후 사용하는 steroid의 부작용을 최소화 할 수 있도록 단기간 steroid 요법이 고려될 수 있겠다.
췌장이식 이외에도 향후 췌장도세포 이식이 시술의 용이성을 고려할 때 현재의 수준에서 더 향상된 성공률을 보일 때 아마 췌장이식을 대체할 수 있는 방법이 되지 않을까 기대해 본다.
췌장이식은 최근에 와서 환자관리와 면역억제제의 개선으로 이식 성적이 향상되어 신부전증을 수반한 당뇨병에서의 신ㆍ췌장 동시이식인 경우 저자들의 결과에 의하면 1년 이식편 생존율이 90%에 이르러 타 장기이식과 유사한 성적을 보여주고 있고 따라서 인슐린 의존형 당뇨병의 근본적인 치료로 제시될 수 있다고 여겨진다.
또한 초기 당뇨병성 합병증 상태로 혈당조절이 용이치 않거나 인슐린 사용에 장애가 있는 경우 췌장 단독이식이 고려될 수 있을 것으로 생각된다. 물론 수술 후 사용하는 면역억제의 비용과 약의 부작용에 따른 부담을 고려하여 환자및 가족의 판단에 따라 수술이 고려될 수 있겠다.
REFERENCES
1. World Health Organization. Diabetes 2010 [Internet]. [cited 2010 Mar 24]. Available from: http://www.who.int/mediacentre/factsheets/fs312/en/print.html
2. Sutherland DE, Gruessner RW, Dunn DL, et al. Lessons learned from more than 1,000 pancreas transplants at a single institution. Ann Surg 2001;233:463–501.



3. Korean Diabetes Association, Health Insurance Review & Assessment Service. Report of Task Force Team for Basic Statistical Study of Korean Diabetes Mellitus: Diabetes in Korea 2007. Seoul: Godlfishery; 2008.
4. Krolewski AS, Warram JH, Freire MB. Epidemiology of late diabetic complications. A basis for the development and evaluation of preventive programs. Endocrinol Metab Clin North Am 1996;25:217–242.


5. The Diabetes Control and Complications Trial Research Group. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. N Engl J Med 1993;329:977–986.
6. Kelly WD, Lillehei RC, Merkel FK, Idezuki Y, Goetz FC. Allotransplantation of the pancreas and duodenum along with the kidney in diabetic nephropathy. Surgery 1967;61:827–837.


7. Gruessner AC, Sutherland DE. Pancreas transplant outcomes for United States (US) cases as reported to the united network for organ sharing (UNOS) and the international pancreas transplant registry (IPTR). Clin Transpl 2008;45–56.


8. 한덕종, 장혁재, 김인구, 박건춘, 민병철. 제1형 당뇨병에서의 췌장-신장 동시이식-2예보고. 대한외과학회지 1994;46:273–282.
10. 국립장기이식관리센터. 2008년도 연보. 2010. [Internet]. [cited 2010 Mar 24]. Available from: http://www.konos.go.kr/jsp/front/m05/sub_01.jsp
11. Gruessner RW, Sutherland DE, Najarian JS, Dunn DL, Gruessner AC. Solitary pancreas transplantation for nonuremic patients with labile insulin-dependent diabetes mellitus. Transplantation 1997;64:1572–1577.


12. Sutherland DE. Is immunosuppression justified for nonuremic diabetic patients to keep them insulin independent? (The argument for). Transplant Proc 2002;34:1927–1928.


13. Cryer PE. Hypoglycemia-associated autonomic failure in diabetes. Am J Physiol Endocrinol Metab 2001;281:E1115–E1121.


14. Robertson P, Davis C, Larsen J, Stratta R, Sutherland DE. Pancreas transplantation in type 1 diabetes. Diabetes Care 2004;27(Suppl 1):S105.

15. Gruessner AC, Sutherland DER. Pancreas transplant outcomes from United States (US) cases reported to the united network for organ sharing (UNOS) and non-UScases reported to the international pancreas transplant registry (IPTR) as of October, 2000. In: Cecka JM, Terasaki PI, eds. Clinical Transplants 2000. Los Angeles: UCLA Immunogenetics Center; 2001. 45–72.
16. Sasaki TM, Gray RS, Ratner RE, et al. Successful long-term kidney-pancreas transplants in diabetic patients with high C-peptide levels. Transplantation 1998;65:1510–1512.


17. Tojimbara T, Teraoka S, Babazono T, et al. Long-term outcome after combined pancreas and kidney transplantation from non-heart-beating cadaver donors. Transplant Proc 1998;30:3793–3794.


18. Kendall DM, Sutherland DE, Najarian JS, Goetz FC, Robertson RP. Effects of hemipancreatectomy on insulin secretion and glucose tolerance in healthy humans. N Engl J Med 1990;322:898–903.


19. Gruessner RW, Kendall DM, Drangstveit MB, Gruessner AC, Sutherland DE. Simultaneous pancreas-kidney transplantation from live donors. Ann Surg 1997;226:471–480; discussion 480-472.



20. Barr ML, Belghiti J, Villamil FG, et al. A report of the Vancouver Forum on the care of the live organ donor: lung, liver, pancreas, and intestine data and medical guidelines. Transplantation 2006;81:1373–1385.


21. Horgan S, Galvani C, Gorodner V, et al. Robotic distal pancreatectomy and nephrectomy for living donor pancreas-kidney transplantation. Transplantation 2007;84:934–936.


22. Gruessner RW, Kandaswamy R, Denny R. Laparoscopic simultaneous nephrectomy and distal pancreatectomy from a live donor. J Am Coll Surg 2001;193:333–337.


23. Dubernard JM, Traeger J, Neyra P, Touraine JL, Tranchant D, Blanc-Brunat N. A new method of preparation of segmental pancreatic grafts for transplantation: trials in dogs and in man. Surgery 1978;84:633–639.

24. Sollinger HW, Pirsch JD, D'Alessandro AM, Kalayoglu M, Belzer FO. Advantages of bladder drainage in pancreas transplantation: A personal view. Clin Transplant 1990;4:32–36.
25. Prieto M, Sutherland DE, Fernandez-Cruz L, Heil J, Najarian JS. Experimental and clinical experience with urine amylase monitoring for early diagnosis of rejection in pancreas transplantation. Transplantation 1987;43:73–79.


26. See WA, Smith JL. Activated proteolytic enzymes in the urine of whole organ pancreas transplant patients with duodenocystostomy. Transplant Proc 1991;23:1615–1616.

27. Han DJ, Kim IK, Park KC. Refractory graft duodenitis and bleeding following enteric diversion of transplanted pancreas with bladder drainage. Transplant Proc 1994;26:2292–2293.

28. Gruessner AC, Sutherland DE. Pancreas transplant outcomes for United States (US) and non-US cases as reportedto the united network for organ sharing (UNOS) and the international pancreas transplant registry (IPTR) as of June 2004. Clin Transplant 2005;19:433–455.

29. Carpentier A, Patterson BW, Uffelman KD, et al. The effect of systemic versus portal insulin delivery in pancreas transplantation on insulin action and VLDL metabolism. Diabetes 2001;50:1402–1413.


30. Bagdade JD, Ritter MC, Kitabchi AE, et al. Differing effects of pancreas-kidney transplantation with systemic versus portal venous drainage on cholesteryl ester transfer in IDDM subjects. Diabetes Care 1996;19:1108–1112.


31. Stratta RJ, Gaber AO, Shokouh-Amiri MH, et al. Experience with portal-enteric pancreas transplant at the University of Tennessee-Memphis. Clin Transpl 1998;239–253.


32. Sutherland DE, Goetz FC, Najarian JS. Living-related donor segmental pancreatectomy for transplantation. Transplant Proc 1980;12(4 Suppl 2):19–25.

33. Kim YH PJ, Kim SC, Han DJ. Efficacy of immediate post-transplant CT angiography in pancreas transplantation [Abstract]. Xenotransplantation 2009;16:393–394.
34. Gruessner RW, Burke GW, Stratta R, et al. A multicenter analysis of the first experience with FK506 for induction and rescue therapy after pancreas transplantation. Transplantation 1996;61:261–273.


35. Stratta RJ. Simultaneous use of tacrolimus and mycophenolate mofetil in combined pancreas-kidney transplant recipients: a multi-center report. The FK/MMF Multi-Center Study Group. Transplant Proc 1997;29:654–655.


36. Gruessner RW, Sutherland DE, Parr E, Humar A, Gruessner AC. A prospective, randomized, open-label study of steroid withdrawal in pancreas transplantation-a preliminary report with 6-month follow-up. Transplant Proc 2001;33:1663–1664.


37. Kaufman DB, Leventhal JR, Koffron AJ, et al. A prospective study of rapid corticosteroid elimination in simultaneous pancreas-kidney transplantation: comparison of two maintenance immunosuppression protocols: tacrolimus/mycophenolate mofetil versus tacrolimus/sirolimus. Transplantation 2002;73:169–177.


Rejection in pancreas transplantation (n=119). (A) Rejection-free graft survival according to era. Rejection-free graft survival rates were calculated with the Kaplan-Meier method. We used cyclosporine, azathioprine, and steroid with OKT3 induction in Era I, tacrolimus, azathioprine, and steroid with OKT3 induction in Era II, tacrolimus, mycophenolate mofetil, and steroid with IL-2 receptor antibody in Era III, and tacrolimus, mycophenolate mofetil/mycophenolic acid, and steroid with anti-thymocyte globulin induction in Era IV. (B) Rejection-free graft survival (Era I, II vs. III, IV). (C) Rejection rate at 1 year post-transplantation. (D) Reversibility of rejection with therapy.
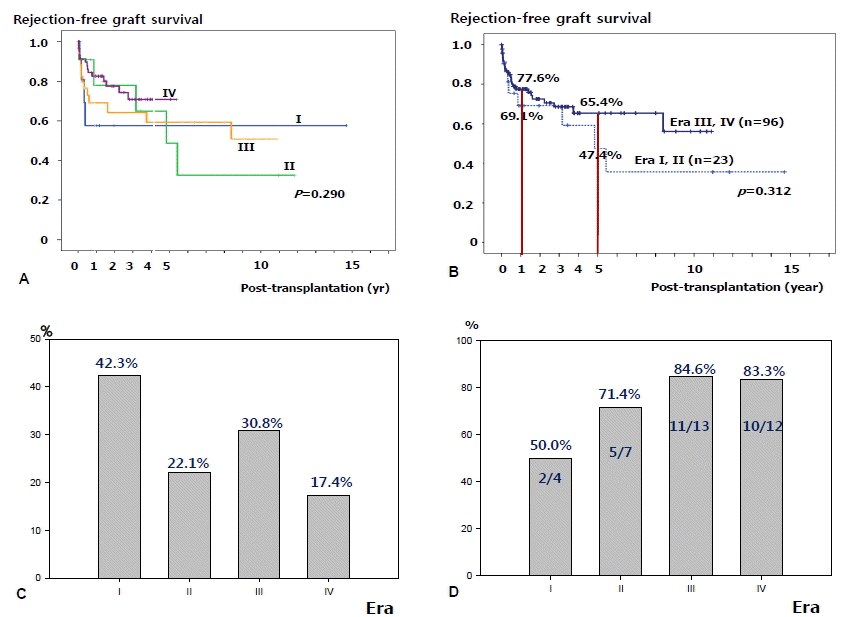
Figure 2.
Graft survival rate. (A) Graft Survival according to era (n=119). (B) Graft Survival according to transplantation type (Jan. 1999 to Dec. 2009; n=96).

Figure 3.
Patient survival rate. (A) Patient Survival according to era (n=119). (B) Patient Survival according to transplantation type (Jan. 1999 to Dec. 2009; n=96).
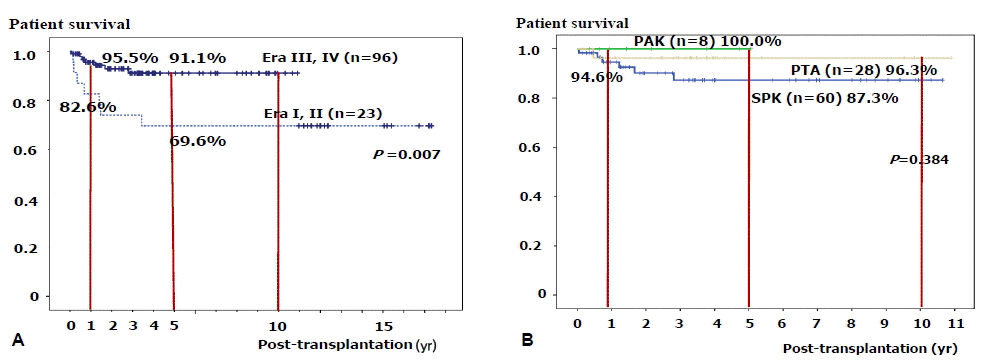
Figure 4.
Table 1.
Characteristics of pancreas transplant recipients
Table 2.
Postoperative complications after pancreas transplantation
Table 3.
Rejection-free graft survival rate according to type of pancreas transplantation
Table 4.
Graft survival rate after introduction of tacrolimus (n=96)
Table 5.
Causes of pancreas graft failure
- TOOLS
-
 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link XML Download
XML Download Full text via DOI
Full text via DOI-
 Download Citation
Download Citation
 Print
Print-
Share :