자연 판막에서 발생한 Staphylococcus lugdunensis에 의한 감염성 심내막염 1예
A Case of Native Valve Infective Endocarditis Caused by Staphylococcus lugdunensis
Article information
Abstract
S. lugdunensis 감염성 심내막염은 국내에서 거의 보고가 없었고, 매우 드물지만 심한 합병증 및 높은 사망률을 보이는 질환이다. 저자들은 항생제 및 수술적 치료로 완치된 자연 판막에서 발생한 S. lugdunensis 감염성 심내막염 1예를 경험하였기에 이를 문헌고찰과 함께 보고하는 바이다.
Trans Abstract
A 37-year-old woman presented to our hospital with a 1-month history of fever. She also complained of lower leg pain. Transthoracic echocardiography showed large vegetations on the mitral valve leaflets. Staphylococcus lugdunensis was isolated from blood cultures. She was diagnosed with infectious endocarditis due to S. lugdunensis and was treated with antibiotics and surgery. Infective endocarditis caused by S. lugdunensis can be invasive and often resembles endocarditis due to Staphylococcus aureus. Thus, whenever this organism is found in patients with endocarditis, early surgical treatment of the infected valve should be considered. (Korean J Med 2011;80:212-215)
서 론
Staphylococcus lugdunensis는 응고효소 음성 포도알균(coagulasenegative staphylococcus, CNS)의 일종으로 1988년 Freney 등에 의해 처음 보고되었다[1]. S. lugdunensis는 주로 피부에서 발견되며 혈액배양 검사에서 발견시 오염균인 경우가 드물다. S. lugdunensis는 Vandenesch 등에 의하여 급성 감염성 심내막염을 일으킬 수 있는 원인균으로 사망률이 70%에 이를 정도로 높은 것으로 나타났다[2]. 그러나 현재까지 국내에서 S. lugdunensis에 의한 감염성 심내막염은 최 등에 의한 1예 외에는 보고된 바가 없었다[3]. 이에 저자들은 혈액배양에서 S. lugdunensis가 동정되었고, 수술로 치료한 자연 판막에서 발생한 감염성 심내막염 1예를 문헌고찰과 함께 보고하는 바이다.
증 례
환 자: 정○○, 여자 37세
주 소: 발열
현병력: 환자는 평소 건강하였고, 내원 1개월 전부터 기침 및 객담을 동반한 발열이 지속되었고, 1주 전부터 심한 좌측 고관절 및 하지 통증으로 입원하였다.
과거력: 1년 전 자궁근종으로 자궁 적출술을 시행 받았고, 철분결핍성 빈혈로 경구용 철분 제제를 복용하고 있었다.
가족력 및 사회력: 특이한 가족력 및 사회력은 없었다.
이학적 소견: 내원 당시 혈압 130/80 mmHg, 맥박 96회/분, 호흡수 20회/분, 체온 37.6℃로 급성 병색을 보였고, 의식은 명료하였다. 두경부 검진에서 결막 창백이 관찰되었고, 심박은 규칙적이며 심첨부에서 수축기 심잡음이 들렸다. 좌측 오금 동맥(popliteal artery)의 맥박이 감소되어 있었다.
흉부사진과 심전도 소견: 정상이었다.
검사실 소견: 입원 당시 일반혈액 검사 소견은 혈색소 9.8 g/dL, 백혈구 21,430/mm3 (중성구 85.3%), 혈소판 146,000/mm3였다. ESR 57 mm/hour, CRP 24.8 mg/dL로 증가되어 있었다. 류마티스 인자가 53.4 u/mL로 증가되어 있었으며 이외의 혈청 전해질 농도 및 간 기능 검사, 소변 검사는 정상이었다. 발목-상완 지수(ankle-brachial index)가 좌측이 0.68로 감소되어 있었다.
방사선 소견: 하지 전산화 단층촬영 혈관 조영술(computed tomography angiogram)상 좌측 온 엉덩동맥(common iliac artery)에서 바깥 엉덩동맥(external iliac artery)까지 폐쇄가 관찰되었다(그림 1A). 복부 전산화 단층촬영상 비장(spleen) 내에서 다발성 조영감소가 관찰되었다(그림 1B).

(A) Computed tomography (CT) angiography of the pelvis and lower extremities shows multisegmental arterial occlusion from the left common iliac artery to the left external iliac artery (black arrow). (B) Abdomino-pelvic CT shows multifocal irregular decreased enhancement in the spleen (white arrow).
심초음파 소견: 경흉부 심초음파(transthoracic echocardiogram)에서 승모판에 직경 약 1 cm 정도의 우종(vegetation)이 2개 관찰되었고, 심한 승모판 역류증이 동반되어 있었다(그림 2).
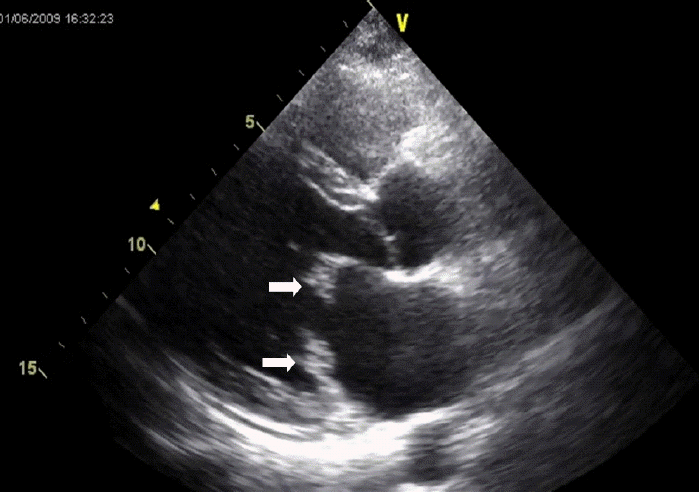
Transthoracic echocardiography shows two echogenic masses on the mitral valve leaflets (white arrow).
치료 및 임상경과: 상기 소견으로 감염성 심내막염으로 추정 진단하고 경험적 항생제 치료로 ceftriaxone과 gentamicin을 정주하였다. 입원해서 시행한 혈액 배양 검사에서 S. lugdunensis가 분리, 동정되었고, 항생제 감수성 검사를 참조하여 항생제를 ampicillin-sulbactam, nafcillin 및 gentamicin으로 변경하였다. 이후 2주간 사용하였으나 발열이 지속되었고, 심초음파상 소견도 변화가 없어 수술적 치료를 시행하기로 결정하였다. 환자는 흉부외과로 전과되어 승모판막 치환술 및 좌측 엉덩동맥의 색전제거술을 시행 받았다. 절제한 승모판의 병리조직 소견상 급성 염증 세포의 침윤이 보였다(그림 3). 환자는 이후 특별한 수술 후 합병증 없이 회복되어 퇴원 후 외래 추적관찰 중이다.
고 찰
감염성 심내막염의 원인균으로 그람 양성세균인 S. aureus와 Streptococcus viridans가 가장 흔한 것으로 알려져 있다[4-6]. 그 중에서 S. lugdunensis는 CNS의 일종으로 심내막염의 원인으로 비교적 드물고, 최근의 후향적인 연구에 의하면 감염성 심내막염을 일으키는 CNS 중 18%를 차지한다[7]. S. lugdunensis는 경한 피부감염에서 심내막염, 복막염, 패혈성 쇼크, 골수염, 뇌농양 등의 침습성 감염에 이르기까지 다양한 감염증의 원인으로 임상적 중요성이 커지고 있으며 특히 자연 판막 심내막염의 원인균으로 그 빈도가 증가하고 있다[8,9]. S. lugdunensis에 의한 감염성 심내막염은 적절한 항생제 치료에도 불구하고 급격히 진행하는 경우가 흔하여 심장 내 농양의 형성, 판막의 파열에 의한 심부전이 흔히 발생하고 이는 높은 사망률과 연관을 가지게 된다[10]. Seenivasan 등과 Yu는 전이성 감염으로서의 전신 색전증이 증례의 32%에서 발생하는 것으로 보고하였는데 본 증례에서도 이와 유사한 색전증이 발생하였다[11]. S. epidermidis 같은 대부분의 CNS에 의한 감염성 심내막염은 심한 합병증을 일으키거나 치명적인 경우가 드물지만 S. lugdunensis는 보다 더 침습적인 임상경과를 보여 S. aureus에 의한 감염성 심내막염과 비슷한 임상양상을 띈다[12].
S. lugdunensis 감염성 심내막염의 감염 경로는 본 증례에서 찾을 수 없었고, 지금까지의 문헌보고를 종합해보면 대부분 피부를 통해서 감염되며 많은 수에서 뚜렷한 감염 경로를 알 수 없었다[2]. S. lugdunensis는 베타락탐 계열의 항생제에 대부분 감수성을 가지는 것으로 보고되고 있다[13,14]. 사용기간은 잘 알려진 바가 없으나 항생제만으로 완치되었던 경우의 치료기간은 4~6주였다[11]. 그러나 항생제 사용에도 균혈증이 지속되거나 심장이나 전신적인 합병증이 나타나면 조기에 감염된 판막의 치환을 포함한 수술적 치료가 필요할 수 있다. 본 증례의 경우에서는 2주간의 항생제 감수성 검사에 기초한 항생제 치료에 잘 반응하지 않았고, 심한 승모판 역류가 있어 수술적 치료로 완치되었다.
1993년에 Vandenesch 등은 20증례의 분석에서 70%의 사망률을 보고하였으나[2], 1993년 이후의 28증례를 분석한 Seenivasan과 Yu의 보고에서는 사망률이 18%로 이전보다는 크게 감소된 양상을 보였는데[11], 이러한 사망률의 차이에 대해서 Seenivasan과 Yu는 조기에 시행된 수술적 치료를 사망률 감소의 요인으로 제시하였다. 그러므로, 이러한 문헌고찰들로 볼 때 조기에 시행된 수술적 치료가 전체적인 사망률을 줄이는데 가장 중요한 요소이며 시기 적절한 균의 동정과 수술이 환자의 치료에 가장 중요한 요인으로 보인다. 본 증례의 경우 균의 동정 및 적절한 항생제의 사용과 수술적 치료를 통해 감염성 심내막염을 완치할 수 있었다.
