서 론
췌장의 신경내분비 종양은 드문 종양 중의 하나로 남녀에서 동일하게 인구 10만 명당 1~2명 정도의 빈도로 발생한다. 임상적 증후군의 여부에 따라서 기능성과 비기능성으로 분류하는데, 약 70~80%가 기능성 종양에 해당하며, 분비하는 호르몬의 종류에 따라서 인슐린종(insulinoma), 가스트린종(gastrinoma), 글루카곤종(glucagonoma), VIPoma 등으로 구분하며 인슐린종이 60%로 가장 높은 빈도를 보인다[1,2]. 그 중 부신피질자극호르몬(ACTH, adrenocorticotropic hormone)을 분비하는 췌장 신경내분비 종양은 극히 드물고, ACTH의 이소성 과분비와 부신피질호르몬(cortisol)의 과분비로 인해 임상적으로 쿠싱 증후군(Cushing’s syndrome)을 나타내는 것이 특징이다. 이들은 95% 이상이 흔히 간 전이를 동반하고 예후가 매우 불량하다. 그러한 이유는 조기 전이에 의해 종양자체의 절제도 어렵고, 항암화학요법은 이 환자들의 면역 억제 상태와 전신쇠약으로 인해 시행되기 어려운 경우가 많기 때문이다. 치료의 목적은 주로 혈청 부신피질호르몬 농도를 줄이는 것이다.
저자들은 상복부 불편감을 주소로 내원한 환자에서 간 전이를 동반한 ACTH를 분비하는 악성 췌장 신경내분비 종양 1예를 경험하였기에 보고하는 바이다.
증 례
62세 남자가 상복부 통증으로 내원하였다. 이 증상은 3개월 전부터 시작되었는데, 간헐적으로 반복되는 조이는 듯하고 하복부의 팽만감을 동반하였다. 1년 전 고혈압을 진단받았고, 3개월 전 당뇨병을 진단받았다. 2년 전 중단한 5갑년의 흡연력이 있었고, 6년 전부터 거의 매일 소주 한 병씩 마셨다. 이외에 특이한 가족력은 없었다.
내원 시 활력징후는 혈압 140/80 mmHg, 맥박 70회/분, 호흡수 20회/분, 체온은 36.8℃였고, 의식은 명료하였다. 환자는 전신 쇠약을 동반한 만성 병색을 보였으며 월상안, 안면 홍조, 후경부 비후, 근무력 및 말초 부종이 있었다. 복부 검진상 장음은 정상이었고, 복부 팽만 및 상복부 압통이 있었으나 반발통은 없었고, 간, 비종대도 없었다. 몸무게 70 kg, 키 173 cm로 신체질량지수(Body Mass Index)는 23.4 kg/m2였다.
내원 시 말초혈액 검사에서 혈색소 14.2 g/dL, 적혈구 용적률 40.9%, 백혈구 8,700/mm3, 혈소판 195,000/mm3였고, 생화학 검사에서 혈청요소질소 23 mg/dL, 크레아티닌 0.9 mg/dL, glucose 221 mg/dL, 아스파테이트 트랜스페라제 42 IU/L, 알라닌 트랜스페라제 78 IU/L, 총 빌리루빈 0.7 mg/dL였다. 나트륨 139 mEq/L, 칼륨 2.3 mEq/L로 저칼륨혈증이 있었고, 동맥혈 검사상 pH 7.620, Base Excess 13.7 mmol/L, HCO3- 36.5 mmol/L으로 대사성 알칼리혈증이 있었다. 기저혈청 cortisol 농도는 오전 8시에 82.1 μg/dL (정상범위: 6.5~19.5 μg/dL), ACTH 농도는 오전 8시에 92.6 pg/mL (정상범위: 6.0~56.7 pg/mL)로 증가되어 있었다. 24시간 소변검사상 유리 cortisol 역시 11,844 μg/day (정상범위: 55.5~286.0 μg/day)로 증가되어 있었다.
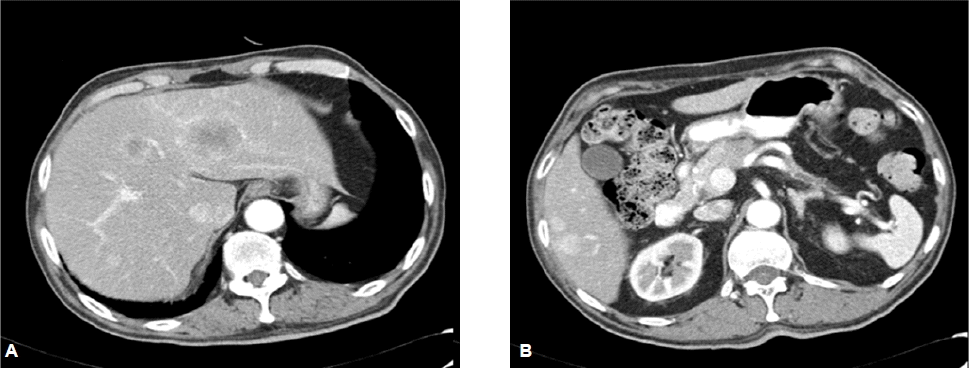
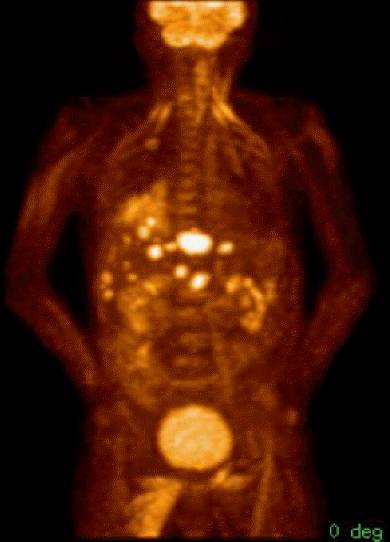
복부 전산화단층촬영에서 간에 다양한 크기의 다발성 종괴들이 관찰되었고, 이 종괴들은 동맥기에 조영제에 의해 조영 증강이 되다가 정맥기 및 지연 영상에서 조영 증강이 사라지는 영상을 보였다(그림 1A). 또한 췌장에서 뚜렷한 종괴는 관찰되지 않았지만, 말단 췌관이 확장되어 있었고, 이 확장된 췌관이 췌장 체부에서 갑자기 절단되는 소견을 보여 췌장 체부 종양의 가능성을 시사하였다(그림 1B). F18-Fluorodeoxy glucose (FDG) 양전자방출단층촬영에서 췌장 체부 종양과 다발성 간 전이가 관찰되었다(그림 2). 뇌 자기공명영상은 정상이었다.
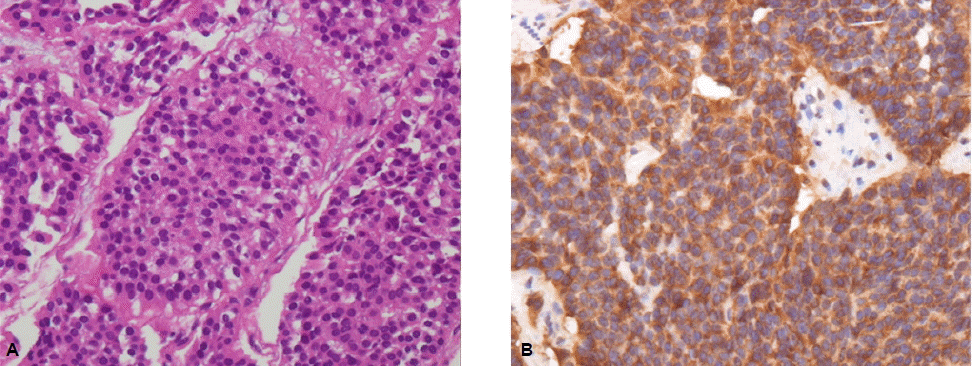
확진을 위하여 다발성 간 종괴에 대해 경피적 간 조직생검을 시행하였다. 병리조직검사상 분화도가 좋은 핵과 미세한 과립모양의 호산성 세포질을 가진 작고 둥근 모양의 단조로운(monotonous) 세포들이 둥지(nest)를 이루고 있었고(그림 3A), 면역조직화학 염색상 chromogranin, synaptophysin, neuron-specific enolase (NSE)에 양성이어서 전이성 신경내분비 종양에 합당하였다(그림 3B).
기능성의 부신피질자극호르몬을 분비하는 췌장에서 기원한 악성 신경내분비 종양의 다발성 간 전이로 진단하고, 입원 19일째부터 somatostatin analog로 치료하였는데, 이때의 환자의 Eastern Cooperative Oncology Group (ECOG) 전신수행상태는 3에 해당했다. 치료 시작 후 2주째에 시행한 혈액 검사에서 혈청 cortisol 55.9 μg/dL, 혈장 ACTH 75.2 pg/mL로 여전히 상승되어 있었으나, 24시간 소변검사에서 유리 cortisol은 3341.25 μg/day로 감소했다. 그러나 환자는 2~3일의 일시적인 전신쇠약의 호전 후 곧바로 폐렴이 진행되어 입원 40일에 사망하였다.
고 찰
췌장 신경내분비 종양은 드문 질환으로 전체 췌장 종양의 0.4~1.6%를 차지한다. 췌장 신경내분비 종양은 기능성 종양과 비기능성 종양으로 구분되는데, 기능성 종양은 특정 호르몬의 과다 분비로 인해 이와 연관된 특징적인 임상증상이 유발되는 경우로, 약 70~80%가 기능성 종양에 해당한다. ACTH를 분비하는 췌장의 ACTHoma는 발생빈도가 인구 100만 명당 0.1명이 되지 못하고, 전 세계적으로 약 110예 가량 보고되었다[1].
ACTHoma에서는 ACTH의 이소성 과분비에 의한 cortisol의 과다로 인해 거의 모든 환자에서 쿠싱 증후군(Cushing’s syndrome)이 특징적으로 나타난다. 전체 이소성 쿠싱 증후군의 약 4~16% 정도가 ACTHoma에 의해 발생하는데[2], 이소성 쿠싱 증후군의 경우 체중 증가나 중심 비만과 같은 전형적인 쿠싱 증후군의 증상은 많지 않지만, 체액 저류, 고혈압, 저칼륨혈증, 대사성 알칼리혈증, 내당능 장애와 같은 대사 이상들이 현저하고 우울증이나 성격 변화와 같은 스테로이드 정신병이 흔히 나타난다[3]. 특징적인 임상양상을 보이면서 혈장 ACTH 및 소변 유리 cortisol이 증가되어 있고, 고용량 덱사메타손 억제 검사에서 혈청 cortisol의 분비가 억제되지 않는 경우 이소성 쿠싱 증후군을 의심할 수 있으며, 이후 흉부 및 복부 전산화단층촬영 등을 통해 ACTH를 분비하는 신경내분비 종양의 원발 위치를 찾게 된다. 본 증례에서는 고용량 덱사메타손 억제 검사는 시행하지 않았지만 상복부 통증으로 인해 내원 시 시행했던 복부 전산화단층촬영에서 다발성 간 종괴들이 발견되었고, 이에 대한 조직 검사와 F18-FDG 양전자방출단층촬영으로 간 전이를 동반한 췌장 신경내분비 종양을 확인하였다. 뇌 자기공명영상에서 뇌하수체에 이상 소견이 없음을 확인함으로써 ACTHoma에 의한 이소성 쿠싱 증후군으로 진단할 수 있었다.
ACTHoma는 다른 기능성 췌장 신경내분비 종양에 비해 MEN-1 (multiple endocrine neoplasia-type 1)과 연관된 경우가 드물고, 악성도가 높아 95% 이상이 악성이다. 췌장 신경내분비 종양에서 악성 여부는 조직학적 소견보다는 주변 조직으로의 국소 침범이나 원격 전이 유무로 판단하는데, ACTHoma는 특히 진단 시 간 전이를 동반하는 경우가 많다. Doppman 등은 8년간 진단된 10명의 ACTHoma 환자들 중 9명이 진단 당시에 간 전이를 동반하였다고 보고한 바 있다[4]. 췌장 신경내분비 종양에서 간 전이의 유무는 가장 중요한 독립적 예후인자이며, 간 전이 외에 여성 환자인 경우, ha-ras 종양 유전자나 p53의 과발현이 있는 경우, MEN-1을 동반하지 않은 경우 등이 불량한 예후와 관련이 있다고 알려져 있다.
기능성 췌장 신경내분비 종양의 치료는 수술적 절제가 유일한 치료이나 ACTHoma는 진단 시 원격 전이를 동반하는 경우가 많아 대부분 근치적 절제가 불가능하다[5]. 다발성 전이를 동반한 신경내분비종양에서 현재 정립된 치료는 없다. 신경내분비 종양의 경우 대개 다혈관성 종양인데, 최근 연구에서 VEGF (vascular endothelial growth factor)와 VEGF의 수용체가 증가되어 있는 것이 증명되었다[6]. 따라서 VEGF 경로의 차단을 목표로 하는 bevacizumab, sunitinib, sorafenib 등[6]을 이용한 치료가 시도되고 있다. 또한 경구 mTOR(mammalian target of rapamycin) 억제제인 everolimus를 이용한 대규모 연구도 진행 중이다[7]. 신경내분비 종양에는 somatostatin 수용체가 많이 분포하고 있기 때문에 그동안에는 somatostatin analog인 octreotide, lanreotide 등을 이용한 치료가 주로 사용되었으며 특히 기능성 내분비 종양의 증상 억제에 효과를 나타냈다. 그 외 방사선 동위원소 표지 somatostatin analog를 이용한 치료도 연구되고 있으나 동위원소의 양과 치료 주기에 대하여 아직 연구가 부족한 상황이다. 한편 ACTHoma의 경우는 somatostatin analogue에 대한 반응이 미흡하다는 보고도 있다[1]. Streptozocin 기저의 항암 화학요법이 췌장의 신경내분비 종양에 시도되기도 하는데, ACTHoma 환자의 대부분에서 고용량의 부신피질호르몬에 의한 면역 억제가 존재하고, 전신 쇠약이 심한 경우가 많아서 전신적 항암항암화학요법을 시도하기에는 제한점이 있다. 그래서 ACTHoma의 경우는 부신피질호르몬 생성을 억제시키기 위한 약물요법으로 metyrapone이나 ketoconazole을 사용할 수 있는데, 본 환자의 경우는 ketoconazole 요법의 시도를 시작하는 중에 폐렴 진행을 통한 급격한 임상적 악화가 발생하여 사망하였다. 간 전이가 제한적으로 존재하는 경우는 간동맥 색전술 등의 국소 요법이 가능하기도 하다[8].



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






