ى„œ ë،
ê°„ى„¸يڈ¬ى•”ê³¼ ê°گ별ى„ ىڑ”ي•کëٹ” يکˆê´€ى„± ى¢…ى–‘ىœ¼ë،œ 드물ى§€ë§Œ يکˆê´€ ىœ،ى¢…(angiosarcoma)ى´ 대ي‘œى پى¸ ى•…ى„± ى¢…ى–‘ى´ë‹¤. يکˆê´€ ىœ،ى¢…ى€ 비ى†Œ(arsenic)ë‚ک vinyl chloride, thorotrastى™€ ê°™ى€ 물ى§ˆى—گ ë…¸ى¶œëگ ë•Œ 발병 ىœ„ي—کى´ ىˆê³ 무ى¦ىƒپ يک¹ى€ ë³µي†µى´ë‚ک ى´‰ى§€ëگکëٹ” ى¢…ê´´ë،œ ى§„단ëگœë‹¤. ىکپىƒپ ê²€ى‚¬ى—گى„œ 단ى¼ يک¹ى€ 다발ى„±ىک ê²°ى ˆë،œ ê´€ى°°ëگکى§€ë§Œ 대부분 ى§„단 ى‹œ 병기가 ى§„ي–‰ëگکى–´ ىˆê¸° 때문ى—گ ىˆکىˆ ى پ ى ˆى œê°€ ى–´ë ¤ىڑ´ ê²½ىڑ°ê°€ ë§ژê³ ىکˆي›„ê°€ 매ىڑ° 불ëں‰ي•ک다. ê°„ى—گ ë°œىƒي•کëٹ” يکˆê´€ى„± ى–‘ى„± ى¢…ى–‘ ëکگëٹ” ى¢…ى–‘ى„± 병변ىœ¼ë،œ 림ي”„ê´€ى¢…(lymphangioma), ىœ ى „ى„± يکˆê´€ ى§ˆي™کى¸ hereditary hemorrhagic telangiectasia, ى•…ى„± ê²½ي–¥ى„ ê°€ى§„ ىƒپي”¼ى„± يکˆê´€ë‚´ي”¼ى¢…(epithelioid hemangioendothelioma) 등ى´ ىˆىœ¼ë‚ک, ë°œىƒ ىکˆê°€ 매ىڑ° 드물기 때문ى—گ ى €ىگëٹ” ë³¸ê³ ى—گى„œ ê°„ى„¸يڈ¬ى•”ê³¼ ê°گ별ى„ ىڑ”ي•کëٹ” 대ي‘œى پى¸ يکˆê´€ى„± ى–‘ى„± ى¢…ى–‘ى¸ يکˆê´€ى¢…(hemangioma)ى—گ 대ي•´ ى„ىƒپى پ, ىکپىƒپي•™ى پ, 병리ى پ يٹ¹ى§•ê³¼ ê°„ى„¸يڈ¬ى•”ê³¼ىک 구별ى گ, 관리ى—گ 대ي•´ 기ىˆ ي•کê³ ىگ ي•œë‹¤.
ê°„ يکˆê´€ى¢…ى€ ê°€ى¥ ي”ي•ک게 ë³¼ ىˆک ىˆëٹ” 비ىƒپي”¼ى„±(nonepithelial) ى–‘ى„± ى¢…ى–‘ىœ¼ë،œ ىœ ë³‘ë¥ ى€ ى،°ى‚¬ë§ˆë‹¤ ى°¨ى´ê°€ ë§ژى•„ى„œ 1-20%ë،œ ë³´ê³ ëگœë‹¤[1]. ê°„ى—گى„œ ë°œىƒي•کëٹ” 다른 ى–‘ى„± ى¢…ى–‘ê³¼ 마ى°¬ê°€ى§€ë،œ يکˆê´€ى¢…ى€ 남ىگ보다ëٹ” ى—¬ىگى—گى„œ ë§ژى´ ىƒê²¨ى„œ ê·¸ 비ëٹ” 1:5 ى •ëڈ„ë،œ ى•Œë ¤ى ¸ ىˆê³ ى§„단 ى‹œ يڈ‰ê· ى—°ë ¹ى€ 50ى„¸ى´ë‹¤[2]. يٹ¹يˆ 다발ى„±ى´ê±°ë‚ک يپ° يکˆê´€ى¢…ى€ ëچ”ىڑ± ى—¬ى„±ى—گى„œ ë§ژى´ ىƒê¸´ë‹¤. يکˆê´€ى¢…ى´ estrogen ىˆکىڑ©ى²´ë¥¼ ê°€ى§€ê³ ىˆى–´ى„œ يک¸ë¥´ëھ¬ ىڑ”법ىœ¼ë،œ يپ¬ê¸°ë¥¼ ى¤„ى¼ ىˆک ىˆë‹¤ëٹ” ى¼ë¶€ ë³´ê³ ê°€ ىˆê³ , ى„ى‹ 기간ى—گ يکˆê´€ى¢…ى´ ى»¤ى§„다ëٹ” ê´€ى°° ê²°ê³¼ëڈ„ 병يƒœىƒë¦¬ى—گ يک¸ë¥´ëھ¬ى´ ê´€ى—¬ي•کê³ ىˆë‹¤ëٹ” ê°€ى„¤ىک ى‹ ë¹™ى„±ى„ 높ى¸ë‹¤[3-5]. Estrogen ى™¸ى—گ glucocorticoidë‚ک 다른 ى„±ى¥ ى¸ىگëڈ„ يکˆê´€ى¢…ىک ى„±ى¥ى—گ ê´€ى—¬ي• 것ىœ¼ë،œ ى—¬ê²¨ى§€ë©° êµى†Œ ê²°ى ˆى„± ê³¼ى¦ى‹(focal nodular hyperplasia) ي™کىگ 26ëھ…ى—گى„œ 23%ê°€ يکˆê´€ى¢…ى„ ê°™ى´ ê°€ى§€ê³ ىˆى—ˆëٹ”ëچ°, ى´ë“¤ ëھ¨ë‘گ يک¸ë¥´ëھ¬ 대ى²´ىڑ”법ى„ ë°›ê³ ىˆëٹ” ى—¬ى„±ى´ى—ˆë‹¤ëٹ” ë³´ê³ ëٹ” يکˆê´€ى¢…ê³¼ يک¸ë¥´ëھ¬ يٹ¹يˆ estrogenê³¼ىک ê´€ë ¨ى„±ى„ ىœ ى¶”ي•ک게 ي•œë‹¤[6-8]. 대부분ىک يکˆê´€ى¢…ى€ ى¦ىƒپ ى—†ى´ ىڑ°ى—°يˆ 발견ëگکê³ ى‹ ى²´ê²€ى‚¬ë‚ک 간기ëٹ¥ ê²€ى‚¬ 등ى—گى„œ ى´ىƒپ ى†Œê²¬ى´ ى—†ى§€ë§Œ, 10 cm ى´ىƒپىک 거대 يکˆê´€ى¢…(giant hemangioma)ى€ 복부 불يژ¸ê°گىک ى¦ىƒپى„ ىœ ë°œي• ىˆک ىˆê³ ى¢…ê´´ê°€ ى´‰ى§€ëگ ىˆکëڈ„ ىˆë‹¤. ى•½ 5-10%ىک ي™کىگى—گى„œëٹ” 다발ى„±ىœ¼ë،œ ë‚کيƒ€ë‚کê³ , ى¼ë¶€ ي™کىگى—گى„œëٹ” ê°„ ى™¸ى—گ ي”¼ë¶€, يڈگ, 뇌 등ى—گëڈ„ يکˆê´€ى¢…ى„ ê°€ى§€ê³ ىˆë‹¤. 드물게 يکˆê´€ى¢…ê³¼ ê´€ë ¨ي•´ى„œ ë‚کيƒ€ë‚کëٹ” ى¦ىƒپىœ¼ë،œ ىڑ°ىƒپ복부 ي†µى¦ى´ ىˆëٹ”ëچ°, 기ى „ى´ ëھ…ي™•ي•کى§€ ى•ٹى§€ë§Œ يکˆê´€ى¢…ى´ ى»¤ى§€ë©´ى„œ ى£¼ë³€ ى‹¤ى§ˆى´ë‚ک Glisson ى؛،ىٹگى„ ىگê·¹ي•کê±°ë‚ک 내부 ى¶œيکˆ, êµى†Œى پى¸ يکˆى „ يک•ى„± 등ىœ¼ë،œ ى¸ي•´ ىƒê¸°ëٹ” 것ىœ¼ë،œ ى„¤ëھ…ي•œë‹¤. ى¦ىƒپى„ ëڈ™ë°کي•œ يکˆê´€ى¢…ىک يپ¬ê¸°ëٹ” 대부분 5 cm ى´ىƒپى´ë‹¤. Kasabach-Merritt ى¦ي›„êµ°ى—گى„œëٹ” ëڈ™ë°کي•œ 거대 يکˆê´€ى¢…ىœ¼ë،œ ى¸ي•´ 복부 ي†µى¦ى´ ىˆê³ يکˆى•،ى‘ê³ ى¥ى• 를 يڈ¬ي•¨ي•کëٹ” ى—¼ى¦ ë°کى‘ى´ ى´ˆê¸°ى—گëٹ” ê°„ى—گ만 êµي•œي•´ى„œ ىƒê¸°ى§€ë§Œ ى „ى‹ ى پى¸ ى„¬ىœ ى†Œ 분ي•´(fibrinolysis)ى™€ يکˆى†ŒيŒگ ê°گى†Œى¦ى´ ë°œىƒي•´ ى‚¬ë§ë¥ ى´ 20-30%ى—گ ى´ë¥¸ë‹¤[9].
يکˆê´€ى¢…ىœ¼ë،œ ى¸ي•´ ë°œىƒي• ىˆک ىˆëٹ” ê°€ى¥ ى‹¬ê°پي•œ ي•©ë³‘ى¦ى€ ى™¸ىƒپى—گ ىکي•کê±°ë‚ک ىگë°œى پى¸ يŒŒى—´ى—گ ىکي•œ 복강내 ى¶œيکˆى´ë‹¤[10,11]. يپ¬ê¸°ê°€ 5 cm 미만ى¸ يکˆê´€ى¢…ىک يŒŒى—´ ىœ„ي—کى€ ى—†ىœ¼ë‚ک 거대 يکˆê´€ى¢…ى—گى„œëٹ” 드물ى§€ë§Œ يŒŒى—´ë،œ ى¸ي•´ ى‹¬ê°پي•œ ى¶œيکˆى´ ë‚کيƒ€ë‚ ىˆک ىˆë‹¤. يŒŒى—´ى´ ىˆëٹ” ê²½ىڑ° ى‹¬ي•œ ë³µي†µê³¼ 복부 يŒ½ë§Œ, ى €يکˆى••ê³¼ ى‡¼يپ¬ê¹Œى§€ ى§„ي–‰ëگ ىˆک ىˆê³ يکˆى•، ê²€ى‚¬ى—گى„œ ê°„ يڑ¨ى†Œ, 빌리부빈ىک ى¦ê°€ى™€ ي•¨ê»ک يکˆى•،ى‘ê³ ى‹œê°„ىک ى§€ى—°ى„ ë³¼ ىˆک ىˆë‹¤. ى¼ë¶€ ي™کىگى—گى„œëٹ” يکˆى•،ى‘ê³ ى´ىƒپê³¼ 범발ى„± يکˆê´€ë‚´ ى‘ê³ ى¦(disseminated intravascular coagulation)ىک ى†Œê²¬ëڈ„ ë³´ى¸ë‹¤. ë³µىˆک ى²œىگë،œ 복강 ë‚´ ى¶œيکˆى´ ي™•ى¸ëگکë©´ ê°„ CT (computed tomography) ê²€ى‚¬ë¥¼ ي†µي•´ يکˆê´€ى¢…ى—گى„œىک ى¶œيکˆ 부ىœ„를 ى°¾ê³ يکˆê´€ ى،°ىکپىˆ ê³¼ ى„ يƒى پ ê°„ëڈ™ë§¥ ىƒ‰ى „ىˆ ى„ ى‘급ىœ¼ë،œ ى‹œي–‰ي•´ى•¼ ي•œë‹¤. ىƒ‰ى „ىˆ ى´ي›„ ي™کىگ ىƒپيƒœê°€ ى•ˆى •ëگکë©´ ê°„ ى ˆى œىˆ ى„ ى‹œي–‰ي• ىˆکëڈ„ ىˆë‹¤.
ى´ى™¸ى—گ يکˆê´€ى¢…ê³¼ ê´€ë ¨ëگœ ë“œë¬¼ê³ ë¹„ى „يک•ى پى¸ ي•©ë³‘ى¦ىœ¼ë،œëٹ” يکˆى„± ë‹´ى¦™(hemobilia), ë°کë³µى پى¸ يکˆê´€ى¢… ë‚´ىک يکˆى „ى—گ ىکي•œ ى—¼ى¦ى„± ê°€ى„±ى¢…ى–‘(inflammatory pseudotumor), ي•ک대 ى •ë§¥ ى••ë°•ىœ¼ë،œ ى¸ي•œ يکˆى „ê³¼ يڈگىƒ‰ى „ى¦, 문맥 ى••ë°•ىœ¼ë،œ ى¸ي•œ 문맥ى•• ي•ى§„ى¦, يکˆê´€ى¢…ىک ë‚ى„± ë³€ي™”(cystic degeneration) 등ى´ ىˆë‹¤.
ê°„ يکˆê´€ى¢…ىک 병리
يکˆê´€ى¢…ى´ ىƒê¸°ëٹ” 기ى „ى€ ëھ…ي™•يˆ ê·œëھ…ëگکى§€ ى•ٹى•کىœ¼ë‚ک ى¼ى¢…ىک يکˆê´€ 기يک•(malformation) ëکگëٹ” ى„ ى²œى پى¸ ê³¼ىک¤ى¢…(hamartoma)ىک ي•کë‚کë،œ ى—¬ê²¨ى§€ê³ , ê³¼ى¦ى‹(hyperplasia)ى´ë‚ک 비대(hypertrophy)보다ëٹ” ي™•ى¥(ectasia)ى—گ ë”°ë¼ ë°œىƒي•کëٹ” 것ىœ¼ë،œ ى•Œë ¤ى ¸ ىˆë‹¤. ى¼ë°کى پىœ¼ë،œ يکˆê´€ى¢…ى€ 둥근 ëھ¨ى–‘ى„ ي•کê³ ىˆê³ ى–‡ى€ ي”¼ë§‰ىœ¼ë،œ ë‘کëں¬ى‹¸ى—¬ ىˆë‹¤[12]. ى ˆë‹¨ë©´ى€ ى پê°ˆىƒ‰ى„ ë ê³ ىٹ¤يڈ°ى§€ى™€ ê°™ى€ ى„±ىƒپى„ ê°€ى§€ë©° ى¶œيکˆى´ë‚ک ë°کي”, ى„يڑŒي™”를 ëڈ™ë°کي•کëٹ” ê²½ىڑ°ëڈ„ ىˆë‹¤. يک„미경ىœ¼ë،œ ë³¼ ë•Œ, ى¢…ى–‘ى€ 단ى¼ى¸µىک ë‚´ي”¼ى„¸يڈ¬ë،œ ëچ®ى¸ 다ى–‘ي•œ يپ¬ê¸°ىک ي™•ى¥ëگœ يکˆê´€ىœ¼ë،œ 구ى„±ëگکى–´ ىˆê³ يکˆê´€ى—گëٹ” يکˆى•،ى´ ى°¨ ىˆë‹¤. يکˆê´€ë“¤ى€ ى–‡ى€ ى„¬ىœ ى„± 격벽ىœ¼ë،œ 분리ëگکى–´ ىˆëٹ”ëچ°, 격벽 ë‚´ى—گ ê°„يک¹ يکˆى „ى´ ىˆë‹¤. يپ° يکˆê´€ى¢…ى—گى„œëٹ” يکˆى „ى´ ىƒê¹€ى—گ ë”°ë¼ ى½œë¼ى ىœ¼ë،œ ى´ë£¨ى–´ى§„ ë°کي”ى´ë‚ک ى„¬ىœ ى„± ê²°ى ˆى´ ىƒê¸°ê¸°ëڈ„ ي•œë‹¤[13].
ê°„ يکˆê´€ى¢…ىک ى§„단
ى¼ë°کى پى¸ يکˆى•،ê²€ى‚¬ëٹ” يکˆê´€ى¢…ىک ى§„단ى—گ ëڈ„ى›€ى´ ëگکى§€ ى•ٹëٹ”다. ى „ىˆ ي•œ ë°”ى™€ ê°™ى´, 거대 يکˆê´€ى¢…ىک ê²½ىڑ° ىگë°œى پى¸ يک¹ى€ ى™¸ىƒپى—گ ىکي•œ يŒŒى—´ê³¼ ى´ى—گ 따른 복강 ë‚´ ى¶œيکˆى´ ىˆëٹ” ê²½ىڑ° ê°„ يڑ¨ى†Œ ىˆکى¹کë‚ک 빌리루빈, يکˆى•،ى‘ê³ ê²€ى‚¬ىک ى´ىƒپ 등ى„ ë³¼ ىˆک ىˆىœ¼ë‚ک 무ى¦ىƒپىک ى‘ى€ يکˆê´€ى¢…ى—گى„œëٹ” ى¼ë°کيکˆى•،ê²€ى‚¬ ëکگëٹ” ي™”ي•™ê²€ى‚¬, يکˆى•،ى‘ê³ ê²€ى‚¬ى—گى„œ يٹ¹ى´ ى†Œê²¬ى„ ë³¼ ىˆک ى—†ë‹¤. ë”°ë¼ى„œ يکˆê´€ى¢…ىک ى§„단ى€ ى´ˆىŒيŒŒ, CT ëکگëٹ” MRI (magnetic resonance imaging) ê²€ى‚¬ى™€ ê°™ى€ ىکپىƒپ ê²€ى‚¬ë¥¼ ي†µي•´ ى´ë£¨ى–´ى§„다. 과거 99mTc-RBC scanى´ ê°„ى„¸يڈ¬ى•”ê³¼ يکˆê´€ى¢…ى„ 구분ي•کëٹ”ëچ° ى‚¬ىڑ©ëگکى—ˆىœ¼ë‚ک ى‘ى€ يکˆê´€ى¢… ى§„단ى—گ ى •ي™•ëڈ„ê°€ ë–¨ى–´ى§€ê³ CT, MRIىک ي•´ىƒپëٹ¥ى´ 발달ي•¨ى—گ ë”°ë¼ ي•µىکي•™ ê²€ى‚¬ëٹ” ىµœê·¼ ى‚¬ىڑ© 빈ëڈ„ê°€ 매ىڑ° ى¤„ى–´ë“¤ى—ˆë‹¤.
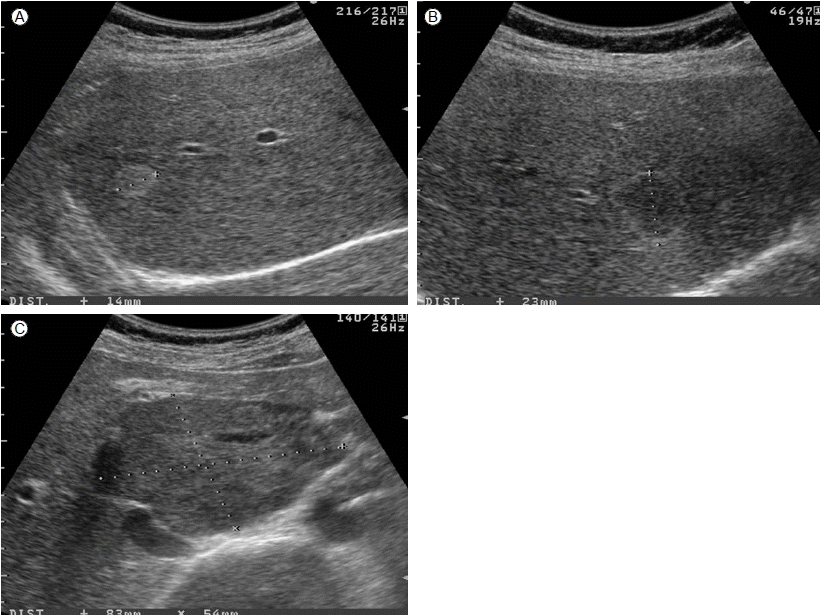
يکˆê´€ى¢…ىک ى´ˆىŒيŒŒ ى†Œê²¬
يکˆê´€ى¢…ىک ى „يک•ى پى¸ ى´ˆىŒيŒŒ ى†Œê²¬ىœ¼ë،œëٹ” 경계가 ëھ…ي™•ي•œ ê²°ى ˆيک•ىœ¼ë،œ ê³ ى—گى½”ى„±(hyperechoic)ى´ê³ , ى¤‘ى‹¬ى—گ ى‘ى€ ى €ى—گى½”ى„±(decreased echogenicity) 부ىœ„ê°€ ê´€ى°°ëگ ىˆکëڈ„ ىˆë‹¤[14,15]. ê°„ يکˆê´€ى¢…ى„ ê°•ي•ک게 ى‹œى‚¬ي•کëٹ” 다른 ى†Œê²¬ىœ¼ë،œëٹ” ى£¼ë³€ ى‹¤ى§ˆê³¼ ëڈ™ى¼ي•œ ى—گى½” ëکگëٹ” ى €ى—گى½”를 ê°–ëٹ” ê²°ى ˆى—گى„œ 경계부ى—گ ê³ ى—گى½”를 ê°–ëٹ” ê²½ىڑ°ى´ë‹¤[16]. ى§€ë°©ê°„ى§ˆي™کى´ ىˆëٹ” ي™کىگى—گى„œëٹ” ى£¼ë³€ ى‹¤ى§ˆë¶€ىک ى „ë°کى پى¸ ê³ ى—گى½” ê²½ي–¥ىœ¼ë،œ ى¸ي•´ يکˆê´€ى¢…ى€ ىک¤يˆë ¤ ى €ى—گى½” ê²°ى ˆë،œ ê´€ى°°ëگœë‹¤. ê°„ى„¸يڈ¬ى•”ى—گى„œëٹ” ىƒ‰ى،° ëڈ„ي”Œëں¬(color Doppler)를 ى´ىڑ©ي•´ى„œ ى¢…ى–‘ 내부ىک ëڈ™ë§¥ى„± يکˆë¥ک를 ي™•ى¸ي• ىˆک ىˆëٹ” ê²½ىڑ°ê°€ ë§ژى§€ë§Œ يکˆê´€ى¢…ى—گى„œëٹ” 10-50%ى—گى„œë§Œ يکˆë¥ک를 ي™•ى¸ي• ىˆک ىˆë‹¤[17]. ê°„ يکˆê´€ى¢…ىک ى§„단ى—گى„œ ى´ˆىŒيŒŒىک 민ê°گëڈ„ëٹ” 60-75%, يٹ¹ى´ëڈ„ëٹ” 60-80%ى´ë‹¤. ى¼ë¶€ ى•…ى„± ê°„ ى¢…ى–‘ىک ى´ˆىŒيŒŒ ى†Œê²¬ى´ يکˆê´€ى¢…ê³¼ ëڈ™ى¼ي•ک기 때문ى—گ 간경변ى¦ى´ ىˆëٹ” ي™کىگ ëکگëٹ” ى•”ىک ê³¼ê±°ë ¥ى´ ىˆëٹ” ي™کىگى—گى„œ ى´ˆىŒيŒŒ ê²€ى‚¬ë،œ يکˆê´€ى¢…ê³¼ ىœ ى‚¬ي•œ 병변ى´ ê´€ى°°ëگکëٹ” ê²½ىڑ° ى—ëڈ™ى پ CT ëکگëٹ” MRIë،œ ê¼ ê°گ별ى„ ي•´ى•¼ ي•œë‹¤. 그림 1ى€ يپ¬ê¸°ê°€ ى‘ى€ يکˆê´€ى¢…ىک ى „يک•ى پى¸ ى´ˆىŒيŒŒ ى†Œê²¬ى„ ë³´ى—¬ى¤€ë‹¤.
يکˆê´€ى¢…ىک CT ى†Œê²¬
يکˆê´€ى¢…ى€ ى„¬ىœ ى„± ê°„ى§ˆë،œ ë‘کëں¬ى‹¸ى¸ 다ى–‘ي•œ يپ¬ê¸°ىک ى„œë،œ ى—°ê²°ëگœ êµ´ ëھ¨ى–‘(sinusoidal) 공간ىœ¼ë،œ ى´ë£¨ى–´ى ¸ ىˆê¸° 때문ى—گ ى،°ىکپى œë¥¼ ى´ىڑ©ي•œ ى—ëڈ™ى پ ى،°ىکپ ى¦ê°• CT scanى—گى„œ يٹ¹ى§•ى پى¸ ى،°ىکپ ى¦ê°• ى–‘ىƒپى„ ë³¼ ىˆک ىˆê³ ى´ê²ƒى„ ë°”يƒ•ىœ¼ë،œ 대부분ىک ê°„ يکˆê´€ى¢…ى„ ى§„단ي• ىˆک ىˆë‹¤[18-20]. 다ى¤‘ى‹œê¸°(multiphase) CTى—گى„œ ë‘گ ê°€ى§€ ى†Œê²¬ى´ ى§„단ىک ى¶•ى´ ëگکëٹ”ëچ°, ى²«ى§¸ê°€ ى،°ىکپ ى¦ê°• ى–‘ىƒپىœ¼ë،œ 병변ىک ى£¼ë³€ë¶€ي„° 구يک•(globular)ىœ¼ë،œ ى،°ىکپى¦ê°•ى´ ëگکى–´ى„œ ى¤‘ى‹¬ë¶€ë،œ ى گى°¨ ى،°ىکپ ى¦ê°•ëگکê±°ë‚ک ëڈ™ë§¥ê¸°(arterial phase)부ي„° 병변 내부ë،œ ê· ى¼ي•ک게 ى،°ىکپى¦ê°•ى´ ëگکى–´ى„œ 계ى†چ ىœ ى§€ê°€ ëگکëٹ” ى†Œê²¬ى´ë‹¤. ë‘گ 번ى§¸ëٹ” ى،°ىکپى¦ê°•ىک ى •ëڈ„ê°€ 대ëڈ™ë§¥ىک ى،°ىکپ ى¦ê°•ê³¼ ëڈ™ى¼ي•ک다. ى´ëں¬ي•œ يٹ¹ى§•ى€ ê°„ى„¸يڈ¬ى•”ى—گى„œىک CT ى†Œê²¬ê³¼ ي™•ى—°يˆ 구분ëگکëٹ” 것ىœ¼ë،œ ê°„ى„¸يڈ¬ى•”ى—گى„œëٹ” ëڈ™ë§¥ê¸°ى—گ ى „ë°کى پى´ê³ ëھ…ي™•ي•œ ى،°ىکپ ى¦ê°•ى´ ىˆë‹¤ê°€ 문맥기(portal phase)ى™€ ى§€ى—°ê¸°(delayed phase)ى—گ 병변ىک ى،°ىکپ ى¦ê°•ى´ ى£¼ë³€ ى‹¤ى§ˆë³´ë‹¤ ى•½ي™”ëگکëٹ” ى†Œىœ„ washout ى†Œê²¬ى„ ë³´ى´ëٹ” 것ى´ يٹ¹ى§•ى پى´ë‹¤. ê°„ يکˆê´€ى¢…ى—گى„œ ى،°ىکپ ى¦ê°•ىک ى†چëڈ„ëٹ” 내부 구ى،°ى—گ يپ¬ê²Œ ى¢Œىڑ°ëگکëٹ”ëچ°, ى،°ىکپى œê°€ 비êµگى پ ëٹ¦ê²Œ يکˆê´€ى¢…ىœ¼ë،œ ى°¨ 들ى–´ê°€ëٹ” ê²½ىڑ°ëٹ” ي™•ى¥ëگکى–´ ىˆëٹ” يکˆê´€ىک 공간ى´ يپ° ê²½ىڑ°ى´ê³ 빨리 ى°¨ 들ى–´ê°€ëٹ” ê²½ىڑ°ëٹ” ى£¼ë³€ىک ê°„ى§ˆ(interstitium)ى€ ë„“ى€ ë°کë©´ يکˆê´€ 공간ى€ ى‘ى€ ê²½ىڑ°ى´ë‹¤[21]. ى،°ىکپى œê°€ ى گى§„ى پىœ¼ë،œ يکˆê´€ى¢… 내부ë،œ ى°¨ 들ى–´ê°€ê³ ى،°ىکپ ى¦ê°•ى´ ى§€ى†چëگکëٹ” ى´ىœ ëٹ” يکˆê´€ 내부ى—گى„œ يکˆë¥ک ى†چëڈ„ê°€ ëٹگ리기 때문ى´ë‹¤. ê·¸ë ‡ê¸° 때문ى—گ ى¼ë‹¨ ي™•ى¥ëگœ يکˆê´€ىœ¼ë،œ 들ى–´ىک¨ ى،°ىکپى œëٹ” يکˆê´€ى¢… ë°–ىœ¼ë،œ ë¹ ى ¸ ë‚کê°€ى§€ ëھ»ي•کê³ ى‹œê°„ى´ يگ름ى—گ ë”°ë¼ ى گى°¨ ى،°ىکپى œê°€ ى¶•ى پëگœë‹¤. ى—ëڈ™ى پ ى،°ىکپ ى¦ê°• CTىک ê°„ يکˆê´€ى¢… ى§„단ىک ى •ي™•ëڈ„ëٹ” 민ê°گëڈ„ 75-85%, يٹ¹ى´ëڈ„ 75-90%ى´ë‹¤. 그림 2ëٹ” ى—ëڈ™ى پ ى،°ىکپ ى¦ê°• CTى—گى„œ ê°پ ى‹œê¸°ë³„ يکˆê´€ى¢…ىک ى „يک•ى پى¸ ى†Œê²¬ى„ ë³´ى—¬ى¤€ë‹¤.
يکˆê´€ى¢…ىک MRI ى†Œê²¬
ى—ëڈ™ى پ ى،°ىکپ ى¦ê°• CTى—گى„œ 비ى „يک•ى پى¸ ى†Œê²¬ى„ ë³´ى—¬ يکˆê´€ى¢…ى„ ى•…ى„± ى¢…ى–‘ê³¼ ê°گ별ي•ک기 ى–´ë ¤ىڑ¸ ë•Œ MRI를 ى´ىڑ©ي• ىˆک ىˆë‹¤. MRIëٹ” ê°„ يکˆê´€ى¢…ىک ى§„단ى—گى„œ ê°€ى¥ ى •ي™•ëڈ„ê°€ 높ى€ ê²€ى‚¬ë،œ ê°„ ى „ى´ëگœ ى•…ى„± ى¢…ى–‘ê³¼ىک ê°گ별ى—گى„œ يٹ¹ى´ëڈ„ê°€ 100%ë،œ ë³´ê³ ëگœë‹¤[22]. T1 ê°•ى،° ىکپىƒپى—گى„œ يکˆê´€ى¢…ى€ ى£¼ë³€ ى‹¤ى§ˆê³¼ 비êµگي•´ى„œ ى €ى‹ يک¸ ê°•ëڈ„(hypointense)ë،œ ê´€ى°°ëگکê³ T2 ê°•ى،° ىکپىƒپى—گى„œëٹ” ë‚ى¢…ى²کëں¼ 매ىڑ° ê³ ى‹ يک¸ ê°•ëڈ„(hyperintense)ë،œ ë³´ى¸ë‹¤. ى،°ىکپى œ ى£¼ى‚¬ ي›„ ى„¸ ê°€ى§€ىک ى،°ىکپ ى¦ê°• ى–‘ىƒپى„ ë³¼ ىˆک ىˆëٹ”ëچ°, ى²« 번ى§¸ ى–‘ىƒپى€ يپ¬ê¸°ê°€ ى‘ى€ ê²½ىڑ° ى،°ىکپى œê°€ ى‹ ى†چي•کê³ ê· ى¼ي•ک게 يکˆê´€ى¢…ىœ¼ë،œ 들ى–´ê°€ ى،°ىکپ ى¦ê°•ى´ ëگکëٹ” 것ى´ê³ ë‘گ 번ى§¸ ى–‘ىƒپى€ ê°€ى¥ ي”ي•œ 것ىœ¼ë،œ(ى „ى²´ىک 77% ى •ëڈ„), CTى—گى„œىک ى–‘ىƒپê³¼ ê°™ى´ ى£¼ë³€ë¶€ë¶€ي„° 구يک•ىœ¼ë،œ ى،°ىکپى œê°€ 들ى–´ê°€ى„œ ى گى°¨ ى¤‘ى‹¬ë¶€ë،œ ى،°ىکپ ى¦ê°•ëگœë‹¤. ى„¸ 번ى§¸ ى–‘ىƒپى€ يپ° يکˆê´€ى¢…ى—گى„œ ê´€ى°°ëگکëٹ” 것ىœ¼ë،œ ë‘گ 번ى§¸ ى–‘ىƒپê³¼ 비ىٹ·ي•کى§€ë§Œ يکˆê´€ى¢… ë‚´ë،œ 들ى–´ê°„ ى،°ىکپى œê°€ ىک¤ë«ëڈ™ى•ˆ 남ى•„ ىˆى–´ ى،°ىکپ ى¦ê°•ى´ ى§€ى†چëگکëٹ” ى°¨ى´ê°€ ىˆë‹¤[23]. 그림 3ى€ T2 ê°•ى،° ىکپىƒپى—گى„œ ê³ ى‹ يک¸ ê°•ëڈ„ ى†Œê²¬ى„ ë³´ى´ëٹ” يکˆê´€ى¢…ىک ى „يک•ى پى¸ MRI ى†Œê²¬ى„ ë³´ى—¬ ى£¼ë©° ê°„ى„¸يڈ¬ى•”ê³¼ ê°„ يکˆê´€ى¢…ىک ى´ˆىŒيŒŒ, CT, MRIى—گى„œىک ê°گ별ى گى„ ي‘œ 1ى—گ ىڑ”ى•½ي•کىک€ë‹¤. ىکپىƒپ ê²€ى‚¬ë،œ ى§„단ى´ ي™•ى‹¤ي•کى§€ ى•ٹى€ ê²½ىڑ° 20-22 gauge를 ى´ىڑ©ي•œ ى،°ى§پ ىƒê²€ى„ ي†µي•´ ê°گ별ى§„단ي• ىˆک ىˆë‹¤. ى§€ê¸ˆê¹Œى§€ىک ë³´ê³ ى—گى„œëٹ” يکˆê´€ى¢…ىک ى،°ى§پ ىƒê²€ ي›„ ى¶œيکˆى´ë‚ک يŒŒى—´ ىکˆëٹ” ى—†ى—ˆë‹¤[24-26].
يکˆê´€ى¢…ىک ى¶”ى پ ê²€ى‚¬ى™€ 관리
무ى¦ىƒپىک ى‘ى€(< 5 cm) يکˆê´€ى¢…ى—گ 대ي•´ ى¼ë°کى پىœ¼ë،œ 1ë…„ 간격ىک ى¶”ى پ ى´ˆىŒيŒŒ ê²€ى‚¬ê°€ ê¶Œê³ ëگکى§€ë§Œ[27], ى¼ë¶€ ى—°êµ¬ى—گى„œëٹ” ى „يک•ى پى¸ ى†Œê²¬ى„ ë³´ى´ëٹ” يکˆê´€ى¢…ى—گ 대ي•´ى„œëٹ” ى¶”ى پê²€ى‚¬ê°€ ي•„ىڑ” ى—†ىŒى„ ë³´ê³ ي•œë‹¤[28]. 10 cmê°€ ë„کëٹ” 거대 يکˆê´€ى¢…ى€ ë©´ë°€ي•œ ى¶”ى پى´ ي•„ىڑ”ي•کê³ ى ٹى€ ي™کىگى—گى„œëٹ” يŒŒى—´, يکˆى „, ى¶œيکˆىک ىœ„ي—کى„ ى—†ى• 기 ىœ„ي•´ ىˆکىˆ ى پ ى ˆى œë¥¼ ê³ ë ¤ي• ىˆک ىˆë‹¤. ى گى°¨ ىگë¼ë©´ى„œ ى¦ىƒپى„ ىœ ë°œي•کëٹ” يکˆê´€ى¢…ى´ë‚ک ى²« 발견 ى‹œ 15 cmê°€ ë„کëٹ” 것ى€ ى ˆى œي•کëٹ” 것ى´ ى¢‹ë‹¤. يکˆê´€ى¢…ى´ 다발ى„±ى´ê±°ë‚ک ê´‘ë²”ىœ„ي•ک게 ê°„ ى…구(hilum)ى—گ까ى§€ 걸ى³گ ىˆëٹ” ê²½ىڑ° ىˆکىˆ ى پ ى ˆى œê°€ ى–´ë µê²Œ ëگکëٹ”ëچ° ى´ëں° ê²½ىڑ°, ê°„ëڈ™ë§¥ ىƒ‰ى „ىˆ ى„ ê³ ë ¤ي•´ ë³¼ ىˆک ىˆë‹¤. ê°„ى´ى‹ى€ ى ˆى œë‚ک ىƒ‰ى „ىˆ ى„ ى‹œي–‰ي•ک기 ى–´ë ¤ىڑ¸ ë•Œ ى„ يƒي•ک게 ëگœë‹¤. ê°„ëڈ™ë§¥ ê²°ى°°ىˆ ى´ë‚ک ى™¸ë¶€ ë°©ى‚¬ى„ ى،°ى‚¬ëڈ„ 드물ى§€ë§Œ 다른 ى¹ک료가 ى–´ë ¤ىڑ¸ ë•Œ ى‹œëڈ„ëگœ ى پى´ ىˆë‹¤[29,30].
ê²° ë،
ê±´ê°•ê²€ى§„ىک ê´‘ë²”ىœ„ي•œ 보급ى—گ ë”°ë¼ ى´ˆىŒيŒŒ ê²€ى‚¬ى—گى„œ ê°„ يکˆê´€ى¢…ى„ ىکى‹¬ ëکگëٹ” ى§„단받ëٹ” ىکˆê°€ ëٹکى–´ë‚کê³ ىˆë‹¤. 만ى„± ê°„ى§ˆي™کىک ë³‘ë ¥ى´ ى—†ëٹ” ê²½ىڑ° ى „يک•ى پى¸ ى†Œê²¬ى„ ë³´ى´ëٹ” ى‘ى€ يکˆê´€ى¢…ى€ ى´ˆىŒيŒŒ ê²€ى‚¬ë§Œىœ¼ë،œ ى§„단ى´ ê°€ëٹ¥ي•کى§€ë§Œ 비ى „يک•ى پى¸ ى†Œê²¬ى„ ë³´ى´ê±°ë‚ک 만ى„± ê°„ى—¼, 간경변 등 기ى،´ ê°„ى§ˆي™کى´ ىˆëٹ” ê²½ىڑ°ى—گëٹ” ê¼ ى—ëڈ™ى پ ى،°ىکپ ى¦ê°• CTë‚ک MRIë،œ ê°„ى„¸يڈ¬ى•” 등 ى•…ى„± ê°„ ى¢…ى–‘ê³¼ ê°گ별ي•کëٹ” 것ى´ ى¤‘ىڑ”ي•ک다.





 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






