골다공증 치료의 최신 지견: 누구를, 무엇으로, 얼마 동안 치료할 것인가?
Management of Osteoporosis: Who to Treat, What to Use, and for How Long?
Article information
Trans Abstract
Osteoporosis is a huge global problem both socially and economically- in the South Korea alone, in 2011 66 million dollar was spent on treatment and social care of the 773,000 osteoporotic patients- and therefore variable preventative and therapeutic approaches are keys to managing this problem within the aging population of today. This review discusses the main issues- who should be treated, what pharmacological agents should be used, and how long they should be administered- surrounding current osteoporosis management. Identifying patients at risk is challenging before they develop a fracture. Probability of fracture based on the Korea-adapted WHO algorithm should be used in making decision of treatment. Though bisphosphonates are the most commonly used drugs for the treatment of osteoporosis, the majority of data on fracture effect is from studies of 3 or 4 years. The long-term treatment should balance fracture efficacy against the risk of adverse events. Although evidence is limited regarding the risk of fracture with the continuation of bisphosphonate therapy, it might be useful to continue treat osteoporosis up to 10 years, to prevent vertebral fractures in the high risk elderly. There are currently no data to guide clinicians in determining who should continue treatment after 5 years. The duration of treatment and the agent selected should be based on individual assessment of risks and benefits and on patient preference. (Korean J Med 2013;85:364-373)
서 론
우리나라 골다공증의 현황
2008-2009년 국민건강영양조사에 따르면 50세 이상 성인의 골다공증 유병률은 여성에서 35.5%, 남성에서 7.5%로 여성이 남성에 비해 4배 이상 높았으며 추정되는 진단율과 치료율은 각각 26.2%와 12.8%이었다[1]. 2010년 발표된 국내 안성 지역 코호트 연구 결과 50세 이상 성인의 요추 골다공증 유병률은 여성 24.0%, 남성 12.9%였으며 척추 골절의 50세 이상 성인의 유병률은 여성 16.5%, 남성 12.1%로 나타났다[2]. 그뿐만 아니라 건강보험심사 청구 자료를 분석한 결과 50세 여성이 일생 동안 골다공증 골절을 최소 한 번 이상 경험할 확률인 전생애 위험도는 59.5%로 남성의 23.8%에 비해 2.5배 가량 높게 나타났다. 특히 사망률이 높은 대퇴골 골절의 전생애 위험도는 50세 여성 12.3%, 남성 5.2%였으며 대퇴골 골절 발생 후 1년내 사망률은 여성 17.3%, 남성 22.6%로 나타났다[3]. 따라서 골다공증은 중년의 건강을 위협하는 흔한 질환일 뿐만 아니라 노년의 삶의 질과 수명까지 결정할 수 있는 심각한 질환으로 인식되어야 한다. 건강보험심사평가원이 2007년부터 2011년까지 5년간의 자료를 이용하여 ‘골다공증(M80-M82)’에 대해 분석한 결과를 보면 진료인원은 2007년 53만5천명에서 2011년 77만3천명으로 5년간 약 44.3%가 증가하였고, 연평균 증가율은 9.7%로 나타났으며 총 진료비는 2007년 535억원에서 2011년 722억원으로 5년간 약 187억원(35.0%)이 증가하였고, 연평균 증가율은 7.9%로 나타났다[4]. 따라서 우리 사회가 급격한 고령 사회로 진입하면서 골다공증은 막대한 사회 경제적 비용을 요구하는 질환이 될 것이다.
본 론
누구를 치료할 것인가?
골다공증 치료에 대한 지침은 다양하지만 미국골다공증재단의 지침이 가장 일반적이고 널리 사용되고 있다[5]. 골다공증 치료는 당연히 골절의 위험이 높은 대상에 대해 시행되어야 한다. 폐경 후 여성이나 50세 이후 남성에서 대퇴골 골절이나 요추 골절이 있는 경우 또는 골밀도가 T 점수가 -2.5 이하인 경우에는 치료가 시작되어야 한다. 골다공증의 진단은 골밀도에 기반을 두고 있으나 골밀도만으로는 골절 위험을 평가하는 데 제한점이 있으므로 진단과는 별개의 개념으로 골다공증의 치료 대상을 선정해야 한다[6]. 미국골다공증재단에서는 위의 두 가지 경우 외에 골절위험도평가(Fracture risk assessment tool, FRAX)를 통해 척추 등 주요 부위 또는 대퇴골의 10년 골절 위험도가 각각 20% 또는 3% 이상인 경우 치료가 시행될 것을 권고하고 있다. 하지만 우리나라의 기준은 아직까지 마련되어 있지 않으므로 이 기준을 우리 진료 현장에 그대로 적용하기는 어렵다. 골다공증 치료를 고려하는 모든 환자는 위험인자를 줄이기 위한 상담이 필요하며 치료 프로그램의 일부로서 칼슘과 비타민 D 그리고 운동의 중요성에 대해 전문적인 상담을 받아야 한다. 치료를 시작하기에 앞서 2차성 골다공증의 가능성에 대한 평가가 이루어져야 하며 중심 골밀도 검사를 시행해야 한다. 골다공증 위험이 높아 골밀도 검사가 고려될 수 있는 경우를 표 1에 기술하였다.
무엇으로 치료할 것인가?
현재 사용 중인 골다공증 치료제
비스포스포네이트
비스포스포네이트는 가장 널리 사용되는 골다공증의 치료제로서 경구나 주사제로 투여될 수 있으며 질소 포함 여부에 따라 작용 기전이 다르다. 비스포스포네이트는 pyrophosphate의 P-O-P 구조에서 산소를 탄소로 치환한 P-C-P 구조를 가진 매우 안정된 유도체이다. 임상에서 주로 사용되는 질소 포함 비스포스포네이트의 치환된 탄소 원소에 결합하는 두 개의 측부 사슬(R1, R2) 중 한 사슬(R1)은 수산화(-OH)기에 의해 뼈의 칼슘에 대한 친화력을 더욱 강화시키고 나머지 질소가 포함된 R2는 비스포스포네이트의 골흡수 억제 효과를 결정한다[7,8]. 이러한 비스포스포네이트는 farnesyl pyrophosphate synthase를 억제시켜 파골세포의 기능에 필수적인 단백질을 억제한다[9,10]. 현재까지 alendronate, risedronate, ibandronate, zoledronate가 골다공증의 예방과 치료 목적으로 미국 식약청으로부터 승인되었다.
비스포스포네이트는 경구 투여 시 대부분 소장에서 흡수되나 흡수율은 1-5% 정도로 매우 낮다. 혈중 비스포스포네이트의 30-70%가 뼈에 흡수되고 나머지는 신장을 통해 빠르게 배설된다. 비스포스포네이트는 인체에 존재하지 않는 합성 물질이므로 P-C-P 결합을 절단할 수 있는 효소도 당연히 존재하지 않는다. 따라서 비스포스포네이트는 체내 흡수 후 골재형성이 활발히 진행되는 뼈의 수산화인회석 내에 결합해 수년간 뼈 안에 그대로 존재하다가 골흡수 과정 동안 유리된다. 이때 파골세포는 국소적으로 고농도의 비스포스포네이트에 노출된다.
경구 비스포스포네이트의 가장 흔한 부작용은 위장 장애이며 주사제 비스포스포네이트의 가장 흔한 부작용은 독감 유사 증상으로 3일 정도 지속될 수 있다. 이것은 T 세포 계열의 세포와 단핵구에 의해 매개된다[11]. 비스포스포네이트의 장기간 사용에 따른 부작용으로, 드물지만 하악골 괴사가 있다. 경구 비스포스포네이트의 경우 하악골 괴사가 발생할 확률은 1/10,000-100,000명/년으로 극히 드문 것으로 알려지고 있다[12,13]. 하악골 괴사의 발생은 비스포스포네이트의 투여 경로와 기간에 따라 결정되므로 골다공증 환자에서보다 고용량 주사제 비스포스포네이트를 투여받는 암 환자에서 훨씬 흔하다[14,15]. 그 외에도 비스포스포네이트의 장기간의 사용은 대퇴골의 비정형골절과 관련되어 있다[16,17]. 2010년 미국 식약청에서는 비스포스포네이트 약품 설명서에 장기간 사용에 따른 비정형 대퇴 골절에 대한 위험을 알리도록 권고하였다. 이러한 골절의 병태생리적 기전은 아직 확실하지 않지만 골재형성이 일어나는 부위의 골기질에 대한 비스포스포네이트의 친화도 및 축적된 양과 관련이 있을 것으로 생각되고 있다. 파골세포에 대한 지속적인 억제 효과는 파골세포와 밀접하게 결합된 조골세포까지 영향을 미쳐 결국 조골세포가 미세 손상을 복구하지 못하는 결과를 초래할 수 있다[18].
칼시토닌
칼시토닌은 갑상선의 C 세포에서 합성되고 분비되는 호르몬으로서 사람에서 칼시토닌의 생리적인 역할은 분명하지 않다. 칼시토닌은 혈중 칼슘이 감소하면 증가되며 임신과 수유 같은 생리적인 스트레스 환경에서 칼슘 조절에 중요한 것으로 알려지고 있다. 성숙 조골세포는 칼시토닌 수용체를 발현하고 있으며 세포 연구에서 칼시토닌은 파골세포에 직접 작용하여 골흡수를 억제한다[19,20]. 1991년 비강 내 연어 칼시토닌(200 IU/day)은 폐경 후 골다공증 환자의 치료에 승인을 받았다. 그러나 2012년 7월 유럽 약품청에서는 칼시토닌의 장기간 사용 시 암의 발생 위험이 증가되므로 골다공증의 치료로 칼시토닌을 더 이상 사용하지 않도록 권고하였으며 파제트병 등에 대해서도 2차 약제로 3개월 이하로만 사용하도록 제한하였다[21]. 2013년 3월 미국 식약청 자문위원회도 골다공증 치료로서의 칼시토닌의 판매를 금지하도록 권고하였다. 이에 따라 우리 식약처에서도 합성연어칼시토닌 제제의 적응증에서 ‘폐경 후 골다공증’을 삭제하였고, 파제트병 치료에도 기본적으로 3개월 이내로 사용을 제한하였다. 칼시토닌은 그동안 골다공증의 치료에서 임상적 증거가 비교적 빈약한 약제였으나 장기간 사용 시 암의 발생 위험이 증가되므로 더 이상 골다공증의 영역에서 사용될 수 없다.
Raloxifen
장기간의 여성호르몬 치료가 심혈관 질환이나 유방암, 자궁암의 위험을 경미하게 증가시킨다는 사실이 알려지면서 호르몬 치료는 더 이상 골다공증의 예방과 치료에 추천되지 않고 있다[22,23]. 에스트로젠의 원치 않는 조직 특이적인 작용을 극복하기 위하여 선택적 에스트로젠 수용체 조절제(selective estrogen receptor modulators, SERMs)의 역할에 관심이 높아지고 있다. 유방암 치료에 사용되었던 tamoxifen 역시 골밀도를 증가시킬 수 있다. Raloxifen은 폐경 후 여성 골다공증의 예방에 승인을 받았으며 골밀도에 대한 효과를 경구 alendronate와 직접 비교한 EVA 연구에서 raloxifen은 alendronate와 비슷한 골절 감소 효과를 보였다[24,25]. RUTH 연구에서 raloxifen은 치명적인 뇌졸중과 정맥색전증의 위험이 보고되었으나[26] 유방암 발생의 위험을 효과적으로 감소시키는 것으로 알려져 2007년 유방암 발생 위험이 높은 폐경 후 여성의 치료에 승인을 받았다[27]. 합성 SERMs 외에도 자연에서 발견되는 식물성 에스트로젠에 대한 관심이 높아지고 있다. 그 중에서 콩에서 발견되는 isoflavone의 일종인 genistein은 다른 조직의 부작용 없이 폐경 후 골량 감소를 효과적으로 예방할 수 있지만 식물성 에스트로젠의 골절 감소 효과는 아직 입증되지 않은 실정이다[28].
Denosumab (RANKL 단일클론항체)
파골세포의 형성과 기능에서 RANKL (receptor activated nuclear-kappaB ligand)와 RANK의 상호 작용은 핵심적인 역할을 담당한다. Denosumab은 RANKL에 대한 인간 단일클론항체로서 파골세포 전구세포에 발현되어 있는 RANK과 조골세포 RANKL의 상호 작용을 방해하는 골흡수 억제제이다. Denosumab은 2010년 미국 식약청으로부터 골절 위험이 높은 폐경 후 골다공증 여성의 치료에 허가를 받았으며 2년 후에는 역시 골절 위험이 높은 남성의 치료에도 승인을 얻었다[29,30]. 폐경 후 골다공증 여성에서 denosumab과 alendronate를 비교한 연구에서 denosumab이 요추와 대퇴골의 골밀도를 보다 효과적으로 증가시켰다[30]. Denosumab의 1회 주사 후 임상적인 효과는 6개월까지 유지되었으나 치료 중단 후에는 비스포스포네이트에 비해 골밀도가 빠르게 감소하였다. 그 이유는 denosumab이 비스포스포네이트와 달리 골의 구조에 함입되지 않기 때문인 것으로 보인다. Denosumab과 관련된 하악골 괴사가 치료를 중단하였을 때 비스포스포네이트에 유발된 것보다 훨씬 회복이 빠르다는 보고가 있다[31].
부갑상선호르몬
부갑상선호르몬은 혈중 칼슘을 유지함으로써 칼슘 항상성에서 중심적인 역할을 담당한다[32]. 일차성 부갑상선기능 항진증에서 부갑상선호르몬은 파골세포를 자극하여 골흡수를 증가시키므로 골감소를 유발하지만 간헐적으로 주사할 경우 골재형성에 대한 골동화 효과를 나타낸다[33]. Teriparatide는 인간 재조합 부갑상선호르몬 유사체로서 1-34 아미노산펩타이드이며 저용량으로 간헐적으로 투여될 때 골형성 작용을 나타낸다. Teriparatide는 폐경 후 골다공증과 당류코르티코이드 유발성 골다공증에서 효과적으로 골밀도를 증가시키며 척추 및 대퇴골 골절의 감소 측면에서 alendronate보다 효과적이다[34-36]. Teriparatide의 골동화 작용의 기전은 완전히 밝혀지지 않았으나 조골세포의 자멸사를 억제하고 전구세포의 조골세포로의 분화 촉진 및 비활성화 조골세포의 재활성화를 통해 조골세포의 수를 증가시키는 것으로 생각되고 있다[37]. Teriparatide의 작용 기전을 감안하여 골흡수억제제와의 병합요법이 기대를 모았으나 alendronate와 같이 투여할 때 alendronate가 teriparatide의 골동화 작용을 둔화시켰다[38]. 하지만 1년간 부갑상선호르몬(1-84)을 투여한 다음 alendronate를 연속적으로 투여하였을 때 부갑상선호르몬에 의해 얻어진 골밀도의 개선 효과가 잘 유지되었다[39]. 올해 초에 발표된 DATA 연구에서 teriparatide를 denosumab과 병합 치료하였을 때 1년이라는 짧은 기간에도 불구하고 각각의 단독 치료군에 비해 병합 치료군에서 요추와 대퇴경부 골밀도가 유의하게 증가하였다[40]. Teriparatide의 우수한 골형성 효과에도 불구하고 동물 실험에서의 골육종의 발생이 증가되었으나 장기간의 임상 연구에서 사람에서 teriparatide와 골육종과의 관련성은 발견되지 않았다[41,42]. Teriparatide는 미국 식약청에서 골다공증의 골형성 치료제로 유일하게 승인을 받았으며 특히 골절 위험이 높은 환자들에게 도움이 될 수 있다. Teriparatide의 투여 횟수를 감소시키려는 시도가 있었는데 20 μg 주 1회까지는 효과적이라고 보고되었다[43]. 현재 비강 또는 경피적 방법 등의 약물 전달 시스템이 개발 되고 있으며 폐경 후 골다공증 환자를 대상으로 체내에 삽입되어 무선으로 조정되는 약물 전달 기기가 임상시험 중에 있다[44,45].
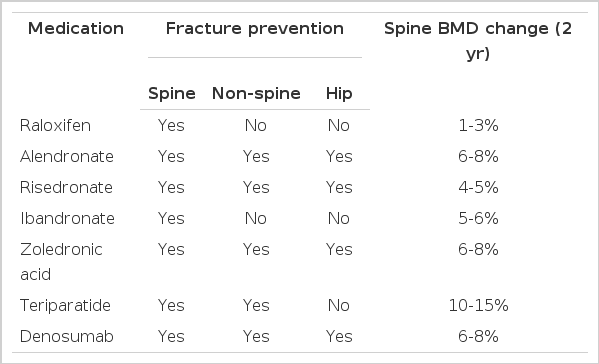
표 2에서 현재 사용 중인 골다공증 치료제의 골절 감소 효과에 대하여 요약하였다.
현재 개발 중인 골다공증 치료제
Cathepsin K 억제제
Cathepsin K는 1995년 인간 cDNA 라이브러리으로부터 클로닝되었으며 파골세포종 조직에 주로 국한하여 발현되었다[46,47]. Cathepsin K는 파골세포에 의해 유리되는 시스테인 단백분해제로서 골흡수 시 파골세포의 주름진 가장자리(ruffled border)를 통해 분비되어 제1형 콜라겐의 분해를 촉매한다. 파골세포가 기능하지 못하는 특징을 가진 pycnodysostosis라는 질환을 가진 환자에서 cathepsin K의 무의미 돌연변이가 확인되었으며 Ctsk 유전자 결손 마우스에서 골 경화증의 표현형이 관찰되었으므로 cathepsin K는 일찍부터 골다공증 치료의 표적으로서의 가능성이 제시되었다[48,49]. 그동안 여러 개의 cathepsin K 억제제가 개발되었으나 대부분이 다른 약물과의 상호 작용이 발생하거나 파골세포에 대한 선택적 작용이 부족하여 사용이 중단되었다. Odanacatib는 매우 선택적이고 가역적인 cathepsin K 억제제로서 90시간 이상의 비교적 긴 반감기를 가지고 있으며 50 mg 주 1회 투여시 골밀도를 효과적으로 증가시켰다[50,51]. Odanacatib는 다른 골흡수 억제제와 달리 골형성을 유지하면서 골흡수를 감소시키는데 이것은 파골세포의 수를 감소시키지 않으므로 ephrin과 같은 파골세포-조골세포 결합 인자가 조골세포의 동원과 기능을 계속 유지시킬 수 있기 때문인 것으로 생각된다[52]. Odanacatib는 폐경 후 여성 골다공증 환자에서 3상 연구가 진행되고 있으며 2012년에는 다른 cathepsin K 억제제인 MIV 711의 1상이 시작되었다.
Sclerostin 항체
Sclerostin은 골세포에서 분비되는 단백질로서 골과다증(hyperostosis)을 특징으로 하는 Van Buchem 병과 같은 골경화증에서 유전자의 변이가 처음 확인되었다[53]. Sclerostin은 조골세포의 Wnt 리간드와 LRP5/6 수용체의 상호작용을 길항하여 Wnt 신호전달을 억제하는 골형성의 음성 조절 인자이다. 역학적 부하의 감소에 의해 sclerostin의 발현이 증가되는데 역학적 부하가 감소된 마우스에서 sclerostin 항체를 투여할 때 골량이 증가되었다[54,55]. 인간 sclerostin 단일클론항체인 AMG 785는 1상 연구에서 건강한 남성과 폐경 후 여성에서 골형성을 증가시키고 골흡수 표지자를 감소시켰으며 현재 2상 연구가 진행 중이다[56,57].
줄기세포 치료
최근 근골격 연구에서 줄기세포 치료가 시도되고 있으며 치료의 초점은 주로 골절이나 연골 손상, 인대나 건 부상과 같은 손상 후의 조직 재생에 맞추어지고 있다[58]. 자가 간엽 줄기세포를 이용한 치료를 개발하는 데 있어서의 장애물은 간엽줄기세포가 골 표면에 도달하는 능력이 부족하다는 것이다. 최근 ‘업어주기’ 기술(piggyback technology)이 시도되었는데 간엽줄기세포에 발현되는 integrin α4β1의 리간드인 LLPA2를 alendronate에 ‘업혀서’ 생체 내에서 주입하게 되면 LLPA2가 결합된 간엽줄기세포는 alendronate에 의해 골표면으로 이동되어 그 곳에서 조골세포로의 분화와 골의 재생이 일어나게 된다[59].
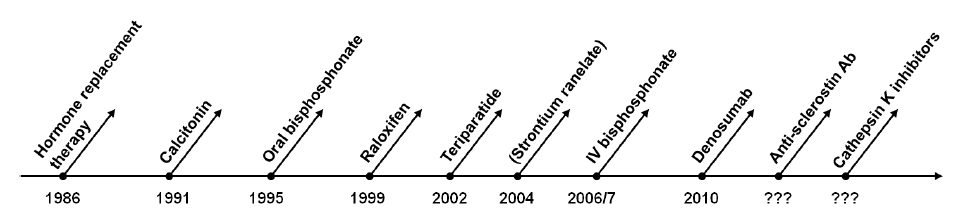
그림 1에서 골다공증 치료의 이정표가 되는 약제들을 승인된 순서대로 제시하였다.
얼마나 오랫동안 치료할 것인가?
SERM 제제
Raloxifene은 8,000여명의 폐경 후 골다공증 여성을 대상으로 한 3년간의 MORE (Multiple Outcomes of Raloxifene Evaluation) 연구를 통해 척추 골절에서의 골절 예방 효과가 입증되었다[60]. MORE 연구가 4년까지 연장되었을 때도 비슷한 결과가 관찰되었다[61]. Lasofoxifene [62]과 bazedoxifene [63,64] 역시 폐경 후 골다공증 여성을 대상으로 5년간의 대규모 임상연구를 통해 척추 골절 감소 효과가 확인되었다. SERM 제제의 골절 예방 효과를 일차적인 종점으로 시행된 5년 이상의 장기간 연구 결과는 부족하며 MORE 연구 대상자들을 대상으로 8년 동안 관찰한 CORE 연구나 관상동맥 질환 위험군을 대상으로 5.6년간 시행된 RUTH 연구에서 raloxifene군에서 치명적 뇌졸중의 위험은 증가되었으나 전체 사망률이나 뇌졸중 사망률은 차이가 없었다[26,65]. 더구나 침윤성 유방암의 발생은 raloxifene군에서 유의하게 감소하였다[66,67]. 따라서 SERM 제제는 4-5년간 치료를 통한 척추 골절 예방 효과는 입증되었으나 그 이상 치료하였을 때의 골절에 대한 효과는 결론내리기 어려우며 raloxifene은 장기간 사용하였을 때 비교적 좋은 안전성을 보이고 있다[60-64].
비스포스포네이트 제제
인간의 수명이 증가하면서 점점 더 많은 환자들이 골다공증으로 치료받을 수 있는 기간이 늘어나고 있다. 얼마나 오랫동안 치료해야 할 것인가 하는 문제는 1차 약으로 가장 널리 사용되는 비스포스포네이트 약제에 특히 중요하다. 비스포스포네이트는 골에 선택적으로 흡수되어 10년 이상의 반감기를 갖게 된다. 장기간 치료를 하게 되면 골 내에 축적될 뿐만 아니라 정상적으로 골의 구조를 유지하는 데 필수적인 골재형성을 방해하여 오히려 골에 좋지 않은 영향을 줄 수 있다.
Alendronate, risedronate, ibandronate, zoledronate 등 모든 비스포스포네이트가 3년간 사용 시 척추, 비척추(ibandronate 제외) 골절 위험을 감소시킬 수 있음이 입증되었다. 작년에 발표된 미국 식약청의 보고에 의하면 세 가지의 대규모 임상연구에서 얻어진 증거들을 바탕으로 비스포스포네이트의 골절 예방 효과는 3-5년까지 유지되며 약제 중단 후에 이러한 효과가 얼마나 지속될 수 있는지에 대해서는 예측하기 어렵다[68]. 이 중 risedronate를 사용한 VERT-MN (Vertebral Efficacy with Risedronate Therapy-Multinational) 연구는 2년 연장되어 5년까지 위약-대조군 연구로 진행되었는데 4, 5년째에도 척추 골절 감소효과가 입증되었다[69]. 놀랍게도 비스포스포네이트를 5년 이상 투여하였을 때 골절 감소 효과를 확인한 무작위 대조군 연구는 아직까지 없다. FLEX (Fracture Intervention Trial Long-term Extension) 연구는 alendronate를 4년 투여한 FIT (Fracture Intervention Trial) 연구를 연장한 연구로서 모든 환자에게 1년간 alendronate를 투여한 후 다시 643명의 alendronate군과 437명의 위약군으로 나누어 총 10년간 치료하였다[70,71]. 치료를 10년간 계속한 군은 중단한 군에 비해 임상적 척추 골절의 발생이 유의하게 감소되었으나 형태학적 척추 골절과 비척추 골절의 발생은 차이가 없었다. 하지만 일부에서는 대퇴골밀도 T-score -2.5 이하이거나 대퇴골밀도가 T-score -2.0 이하이면서 척추 골절이 있는 경우 alendronate를 지속하였을 때 임상적 효과를 얻을 수 있다는 의견이 제시되고 있다[72]. 하지만 이러한 효과가 다른 비스포스포네이트에도 적용 가능한지 불확실하다. Alendronate를 10년간 투여하였을 때 5년간 투여로 증가된 골량은 지속적으로 유지됨을 관찰할 수 있었다[70,73]. VERT-MN 연구를 2년 더 연장하여 7년간 68명 환자에서 골절에 대한 효과를 관찰하였을 때 골절 감소 효과는 6-7년에 3.8%으로 4-5년의 4.5%와 차이 없이 유지되었지만 위약군이 설정되지 않았으므로 역시 risedronate의 장기간 골절 예방 효과에 대해서는 결론을 내리기 어렵다[74]. Zoledronate에 대한 2상 연구를 5년 동안 연장하였을 때에도 골밀도는 증가하였지만 위약대조군이 설정되지 않았고 대상 환자의 수가 너무 적어 골절 위험감소에 대한 결론을 내릴 수 없었다[75].
10년 동안의 alendronate와 7년 동안의 risedronate 연구는 많은 약점을 가지고 있다. 두 연구 모두 골절 발생을 일차적인 종점으로 정하지 않았으며 처음 연구에서의 치료군과 대조군이 연장 연구에서는 뒤바뀌는 경우가 있었기 때문에 적절한 대조군과의 비교가 사실상 불가능했다. 그리고 연장 연구에 포함된 대상의 수가 처음 연구에 비해 매우 적었다는 것을 지적할 수 있다. 따라서 현재까지의 연구 결과를 바탕으로 5년 이상의 치료를 통해 효과를 예측할 수 있는 위험군을 정의하기는 어려우며 5년 이상의 치료 지속 여부는 환자의 위험도와 선호도를 근거로 결정해야 한다. 치료가 중단된 환자를 어떻게 감시할 것인지 어떤 경우에 다시 치료를 시작해야 할 것인지에 대해서도 더 많은 연구가 필요하다.
Denosumab
Denosumab의 폐경 후 골다공증 여성에 대한 골절 예방 효과는 3년간의 FREEDOM (Fracture Reduction Evaluation of Denosumab in Osteoporosis every 6 Months) 연구를 통해 척추, 비척추, 대퇴골 모든 부위에서 입증되었다[29]. 치료를 2년을 연장하였을 때에도 요추와 대퇴골밀도는 계속 증가하였다[76]. 2상 연구에서 6년간 denosumab을 투여하였을 때도 요추 골밀도는 계속 증가하였으며 골흡수 표지자 역시 지속적으로 억제되었다[77,78]. 아직까지 5년 이상의 denosumab 치료를 통해 골절 예방 효과를 확인한 연구는 없다. Denosumab 치료군에서도 하악골 괴사 발생이 보고되었으나 5년 이상의 치료 기간 동안 대퇴 전자하부 골절은 아직 보고되지 않았다[76].
그림 2에서는 골다공증 치료제의 장기간 투여 후 골절과 관련된 결과들을 분석한 주요 임상연구들을 제시하였다.
결 론
과거에 비해 우리는 골다공증의 치료의 영역에서 효능이 입증된 다양한 무기를 확보할 수 있게 되었다. 따라서 골절 위험이 높은 대상을 찾아내어 골절의 위험으로부터 보호하고자 하는 노력이 절실히 요구되고 있다. 골다공증의 치료의 중심이 되고 있는 비스포스포네이트는 골에 특이적이며 매우 짧은 반감기를 갖고 있어 타장기에 영향을 주지 않는 장점이 있으나 장기간 사용으로 인한 부작용들이 보고되고 있다.
지금 사용 중인 다양한 골다공증 치료제를 얼마 동안 사용할 것인가 하는 문제는 아직까지 결론이 없으나 현재까지의 임상 연구들의 증거를 바탕으로 칼시토닌을 제외한 골흡수 억제제의 경우 3-5년간 사용하는 것은 근거가 있으며 안전성에도 큰 무리가 없어 보인다. 5년 이상 alendronate를 투여한 연구에서 임상적 척추 골절 예방 등의 효과를 얻을 수 있는 고위험군을 찾아내려는 노력이 일부에서 있었으나 아직까지 비스포스포네이트 전체로 일반화하기는 어렵다. Denosumab은 현재까지 골량 증가 효과와 안전성이 우수하여 촉망받고 있다. 현재 개발 중인 cathepsin K 억제제, sclerostin 항체 등이 지금 사용 중인 약제보다 훨씬 우수한 효과와 안전성을 가진 약물로서 임상에 빨리 사용될 수 있기를 기대한다.