 |
 |
| Korean J Med > Volume 85(5); 2013 > Article |
|
ņÜöņĢĮ
ļ¬®ņĀü:
ļ│Ė ņŚ░ĻĄ¼ņØś ļ¬®ņĀüņØĆ Ļ░Ģņ¦üņä▒ ņ▓ÖņČöņŚ╝ ĒÖśņ×ÉņŚÉņä£ anti-tumor necrosis factor-╬▒ (anti-TNF-╬▒) ņ╣śļŻī ĒøäņØś ņ▓┤ņżæĻ│╝ Ļ│©ļ░ĆļÅäņØś ļ│ĆĒÖöļź╝ ņĢīņĢäļ│┤Ļ│Āņ×É ņŚ░ĻĄ¼ļź╝ ĒĢśņśĆļŗż.
ļ░®ļ▓Ģ:
Modified New York CriteriaņŚÉ ņØśĒĢ┤ ņ¦äļŗ©ļÉ£ ņ┤Ø 31ļ¬ģņØś (ļé©ņä▒ 25ļ¬ģ, ņŚ¼ņä▒ 6ļ¬ģ) Ļ░Ģņ¦üņä▒ ņ▓ÖņČöņŚ╝ ĒÖśņ×ÉļōżņØä ļīĆņāüņ£╝ļĪ£ ĒĢśņśĆļŗż. ļ¬©ļōĀ ĒÖśņ×ÉļōżņØĆ ļ╣äņŖżĒģīļĪ£ņØ┤ļō£ņä▒ ņåīņŚ╝ņ¦äĒåĄņĀ£(NSAIDs), sulfasalazine, methotrexateņŚÉļÅä ļ░śņØæĒĢśņ¦Ć ņĢŖĻ│Ā ņ¦łļ│æĒÖ£ņä▒ļÅäĻ░Ć ļåÆņĢä anti-TNF-╬▒ ņ╣śļŻīļź╝ 2ļģä ņØ┤ņāü ņŗ£Ē¢ēĒĢśņśĆļŗż. Anti-TNF-╬▒ņØś ņÜ®ļ¤ēņØĆ etanercept 25 mg ņŻ╝ 2ĒÜīņśĆĻ│Ā adalimumab 40 mg ņøö 2ĒÜīļĪ£ ĒĢśņśĆļŗż.
ņ▓┤ņżæĻ│╝ Ļ│©ļ░ĆļÅäļź╝(dual energy X-ray absorptiometry) ļ╣äļĪ»ĒĢśņŚ¼ ņ¦łļ│æĒÖ£ņä▒ļÅäņØś ņ¦ĆĒæ£ļĪ£ Bath ankylosing spondylitis (BASDAI), C-reactive protein (CRP), Erythrocyte sedimentation rate (ESR)ļō▒ņØä ņĖĪņĀĢĒĢśņśĆļŗż.
Ļ▓░Ļ│╝:
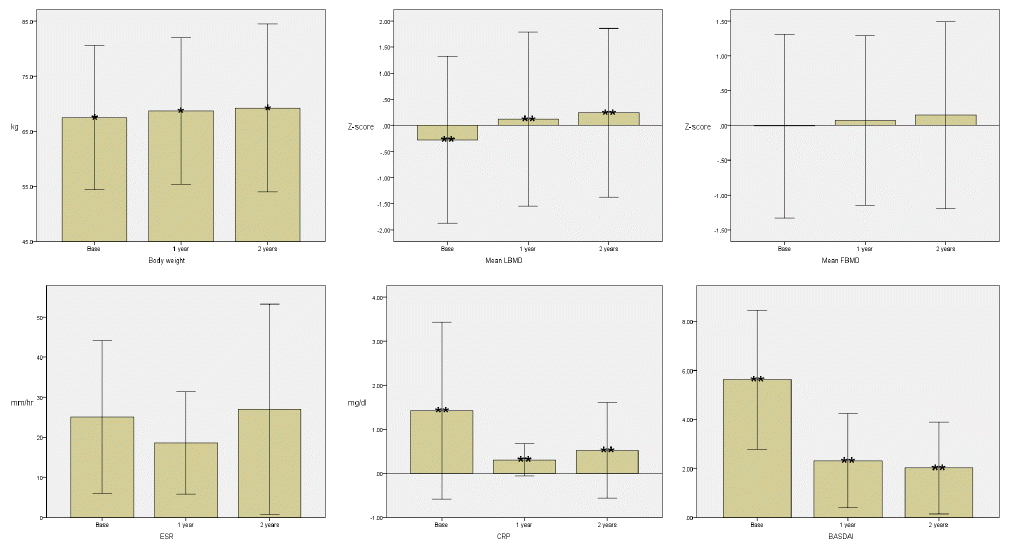
TNF-╬▒ ĻĖĖĒĢŁņĀ£ ņ╣śļŻī ņĀäĻ│╝ ļ╣äĻĄÉĒ¢łņØä ļĢī ņ╣śļŻī 1ļģä ĒøäņÖĆ 2ļģä ĒøäņØś ļ¬Ėļ¼┤Ļ▓īņØś ĒÅēĻĘĀņØĆ 68.6 ┬▒ 13.2 kg, 69.2 ┬▒ 15.2 kgļĪ£ p valueĻ░Ć 0.02ļĪ£ ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļź╝ ļ│┤ņśĆņ£╝ļ®░ ņŗ£Ļ░äņØ┤ Ļ░łņłśļĪØ Ļ░ÆņØ┤ ņ”ØĻ░ĆĒĢ©ņØä ņĢī ņłś ņ׳ļŗż(Fig. 1). TNF-╬▒ ĻĖĖĒĢŁņĀ£ ņ╣śļŻī ņĀä ņÜöņČöļČĆ(ņĀ£1-ņĀ£4ņÜöņČö) ĒÅēĻĘĀ Ļ│©ļ░ĆļÅäļŖö -0.2 ┬▒ 1.6ņØ┤ņŚłĻ│Ā ņ╣śļŻī 1ļģä ĒøäņÖĆ 2ļģä ĒøäņØś ņÜöņČöļČĆ ĒÅēĻĘĀ Ļ│©ļ░ĆļÅäļŖö(Z-scoreļĪ£ ļ│ĆĒÖś ņŗ£) Ļ░üĻ░ü 0.1 ┬▒ 1.6, 0.2 ┬▒ 1.6ņ£╝ļĪ£ p valueĻ░Ć 0.001ņØ┤ĒĢśļĪ£ ĒåĄĻ│äņĀüņ£╝ļĪ£ ļ¦żņÜ░ ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļź╝ ļ│┤ņśĆņ£╝ļ®░ ņŗ£Ļ░äņØ┤ Ļ░łņłśļĪØ Ļ░ÆņØ┤ ņ”ØĻ░ĆĒĢ©ņØä ņĢī ņłś ņ׳ļŗż(Fig. 1).
TNF-╬▒ ĻĖĖĒĢŁņĀ£ ņ╣śļŻī ņĀä BASDAIļŖö 5.6 ┬▒ 2.8ņĀÉņØ┤ņŚłĻ│Ā ņ╣śļŻī 1ļģä ĒøäņÖĆ 2ļģä ĒøäļŖö Ļ░üĻ░ü 2.3 ┬▒ 1.9ņĀÉ, 2.0 ┬▒ 1.8ņĀÉņ£╝ļĪ£ p valueĻ░Ć 0.01 ļ»Ėļ¦īņ£╝ļĪ£ ĒåĄĻ│äņĀüņ£╝ļĪ£ ļ¦żņÜ░ ņ£ĀņØśĒĢ£ Ļ░Éņåī ņ¢æņāüņØä ļ│┤ņśĆļŗż.
CRPļŖö TNF-╬▒ ĻĖĖĒĢŁņĀ£ ņ╣śļŻī ņĀä 1.4 ┬▒ 2.0 mg/dLņśĆĻ│Ā ņ╣śļŻī 1ļģä ĒøäņÖĆ 2ļģä ĒøäļŖö Ļ░üĻ░ü 0.3 ┬▒ 0.3 mg/dL, 0.5 ┬▒ 1.0 mg/dLļĪ£ p valueĻ░Ć 0.01 ļ»Ėļ¦īņ£╝ļĪ£ ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļź╝ ļ│┤ņśĆļŗż.
Ļ▓░ļĪĀ:
Ļ░Ģņ¦üņä▒ ņ▓ÖņČöņŚ╝ ĒÖśņ×ÉļōżņØä ļīĆņāüņ£╝ļĪ£ ĒĢ£ Ļ│©ļ░ĆļÅäņÖĆ ņ▓┤ņżæņØś ļ│ĆĒÖöņŚÉ ļīĆĒĢ£ ĻĄŁļé┤ ņ×ÉļŻīļŖö ņÖĖĻĄŁņŚÉ ļ╣äĒĢ┤ ļ»Ėļ»ĖĒĢ£ ņŗżņĀĢņØ┤ļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö 31ļ¬ģņØś Ļ░Ģņ¦üņä▒ ņ▓ÖņČöņŚ╝ ĒÖśņ×ÉļōżņØä ļīĆņāüņ£╝ļĪ£ TNF-╬▒ ĻĖĖĒĢŁņĀ£ ņ╣śļŻī Ēøä ņ▓┤ņżæĻ│╝ ņÜöņČöļČĆ Ļ│©ļ░ĆļÅäĻ░Ć ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢśĻ▓ī ņ”ØĻ░ĆĒĢ©Ļ│╝ ļÅÖņŗ£ņŚÉ ņ¦łļ│æĒÖ£ņä▒ļÅäņØś ņ¦ĆĒæ£ņØś BASDAIĻ░Ć ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢśĻ▓ī Ļ░ÉņåīĒĢśļŖö Ļ▓āņØä ĒÖĢņØĖĒĢśņśĆĻĖ░ņŚÉ ļ│┤Ļ│ĀĒĢśļŖö ļ░öņØ┤ļŗż.
Abstract
Background/Aims:
To determine the changes in body weight and bone mineral density in patients with ankylosing spondylitis(AS) receiving anti-tumor necrosis factor-╬▒ (TNF-╬▒) treatment.
Methods:
Thirty-one patients with AS (25 males and 6 females) who fulfilled the Modified New York Criteria for AS wereincluded in this retrospective study. All patients had active disease that eventually required anti-TNF-╬▒ treatment. Each patientreceived anti-TNF-╬▒ treatment (etanercept 25 mg twice weekly or adalimumab 40 mg twice monthly) for more than 2 years. Bodyweight, disease activity as Bath ankylosing spondylitis disease activity index (BASDAI), C-reactive protein, erythrocytesedimentation rate (ESR), lumbar bone mineral density (LBMD), and femoral bone mineral density (FBMD) were measured atbaseline and at 1 and 2 years after initiating anti-TNF-╬▒ treatment.
Results:
There was a significant increase in mean body weight at 1 year (1.1 ┬▒ 3.8 kg) and at 2 years (1.7 ┬▒ 4.8 kg) compared withbaseline. The gains in mean BMD of the lumbar spine were significant at 1 year (0.4 ┬▒ 0.4) and 2 years (0.5 ┬▒ 0.7) compared withbaseline. Mean BMD of the femur was also increased at 1 year (0.08 ┬▒ 0.7) and 2 years (0.1 ┬▒ 0.8) compared with baseline, but thesedifferences were not statistically significant. There were significant decreases in BASDAI at 1 year (-3.3 ┬▒ 2.8) and at 2 years(-3.6 ┬▒ 2.8) compared with baseline.
Ļ░Ģņ¦üņä▒ ņ▓ÖņČöņŚ╝ņØĆ ņ▓£ņן Ļ┤ĆņĀł ļ░Å ņ▓ÖņČöļź╝ ņ╣©ļ▓öĒĢśļŖö ļ¦īņä▒ ņŚ╝ņ”Øņä▒ ņ¦łĒÖśņ£╝ļĪ£ Ļ│©ļČĆņ░® ļČĆņ£äņŚ╝Ļ│╝ ļ¦Éņ┤ł Ļ┤ĆņĀłņŚ╝ņØ┤ ļÅÖļ░śļÉśļ®░ Ēśłņ▓Ł ņØīņä▒ ņ▓ÖņČö Ļ┤ĆņĀłņŚ╝ņØś Ļ░Ćņן ĒØöĒĢ£ ĒśĢĒā£ņØ┤ļŗż. HLA-B27Ļ│╝ Ļ░ĢĒĢ£ ņŚ░Ļ┤Ćņä▒ņØä ļ│┤ņØ┤ļ®░ ņØ╝ļ░śņĀüņ£╝ļĪ£ 0.1-0.8%ņØś ņ£Āļ│æļźĀņØä ļ│┤ņØĖļŗż[1,2].
Tumor necrosis factor (TNF)-╬▒, interleukin (IL)-1, IL-6 ļō▒ņØś ņĀäņŚ╝ņ”Øņä▒(proinflammatory) ņé¼ņØ┤ĒåĀņ╣┤ņØĖņØ┤ Ļ░Ģņ¦üņä▒ ņ▓ÖņČöņŚ╝Ļ│╝ ņŚ░Ļ┤ĆņØ┤ ņ׳ņ£╝ļ®░ ĒŖ╣Ē׳ TNFĻ░Ć Ļ░Ģņ¦üņä▒ ņ▓ÖņČöņŚ╝ņØś ļ│æņØĖņŚÉ ņ׳ņ¢┤ņä£ ņżæņÜöĒĢ£ ņØĖņ×ÉļØ╝ļŖö ņŚ¼ļ¤¼ ļ│┤Ļ│ĀĻ░Ć ņ׳ņŚłļŗż[3]. ĻĘĖ ņśłļĪ£ Ļ░Ģņ¦üņä▒ ņ▓ÖņČöņŚ╝ ĒÖśņ×ÉņØś Ēśłņ▓ŁņŚÉ TNF-╬▒Ļ░Ć ļŗżļźĖ ļ╣äņŚ╝ņ”Øņä▒ ņÜöĒåĄ ĒÖśņ×ÉņŚÉ ļ╣äĒĢ┤ ņ”ØĻ░ĆļÉśņ¢┤ ņ׳ņŚłĻ│Ā Ļ░Ģņ¦üņä▒ ņ▓ÖņČöņŚ╝ ĒÖśņ×ÉņØś ņ▓£ņן Ļ┤ĆņĀł ņĪ░ņ¦ü Ļ▓Ćņé¼ņŚÉņä£ TNF-╬▒ mRNAņÖĆ TNF-╬▒ ļŗ©ļ░▒ņØś ļ░£ĒśäņØ┤ ņ”ØĻ░ĆļÉśņ¢┤ ņ׳ņŚłļŗż[4].
TNF-╬▒ļŖö ņŗØņÜĢļČĆņ¦ä, ņŚÉļäłņ¦Ć ņåīļ╣ä ņ”ØĻ░Ć, ĻĘ╝ņ£Ī ļŗ©ļ░▒ ĒīīĻ┤┤, Ļ│©Ļ▓®ĻĘ╝ ņØ┤ĒÖö ņ×æņÜ® ļ░Å ņ¦Ćļ░® ļČäĒĢ┤ļź╝ ĒåĄĒĢ┤ ņĢģņĢĪņ¦ł(cachexia)ņØä ņ┤łļלĒĢśļ®░[5] ĒīīĻ│© ņäĖĒżļź╝ ņ┤ēņ¦äĒĢśĻ│Ā ļ¬©Ļ│© ņäĖĒżļź╝ ņ¢ĄņĀ£ĒĢśņŚ¼ Ļ│©Ļ▓░ĒĢŹņØä ņ┤łļלĒĢ£ļŗż[6]. TNF-╬▒ ĻĖĖĒĢŁņĀ£ ņ╣śļŻīļŖö ļÅÖļ¼╝ ņŗżĒŚśņŚÉņä£ ņĢģņĢĪņ¦łņØä Ļ░£ņäĀĒĢśļŖö ĒÜ©Ļ│╝ļź╝ ļ│┤ņŚ¼ņŻ╝ņŚłņ£╝ļ®░ Ļ░Ģņ¦üņä▒ ņ▓ÖņČöņŚ╝ņØś ņ╣śļŻī ļ░®ļ▓ĢņŚÉ TNF-╬▒ ĻĖĖĒĢŁņĀ£Ļ░Ć ļÅäņ×ģļÉśļ®┤ņä£ ņ╣śļŻī ņä▒ņĀüņØĆ ĒÜŹĻĖ░ņĀüņØĖ ļ░£ņĀäņØä ņØ┤ļŻ©ņŚłļŗż[7,8]. Briot ļō▒[9]ņØĆ Ļ░Ģņ¦üņä▒ ņ▓ÖņČöņŚ╝ ĒÖśņ×ÉļōżņØä ļīĆņāüņ£╝ļĪ£ ĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ TNF-╬▒ ĻĖĖĒĢŁņĀ£ ņ╣śļŻī Ēøä ņ£ĀņØśĒĢ£ņ▓┤ņżæ ņ”ØĻ░ĆņÖĆ Ļ│©ļ░ĆļÅä ņ”ØĻ░Ćļź╝ ļ│┤Ļ│ĀĒĢ£ ļ░ö ņ׳ļŗż. ĒĢśņ¦Ćļ¦ī ĻĄŁļé┤ ĒÖśņ×ÉļōżņØä ļīĆņāüņ£╝ļĪ£ ĒĢ£ ņŚ░ĻĄ¼ļŖö ļ»Ėļ»ĖĒĢ£ ņŗżņĀĢņØ┤ļŗż. ļö░ļØ╝ņä£ ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ ņĀĆņ×ÉļōżņØĆ ĻĄŁļé┤ Ļ░Ģņ¦üņä▒ ņ▓ÖņČöņŚ╝ ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ 2ļģäĻ░äņØś TNF-╬▒ ĻĖĖĒĢŁņĀ£ ņ╣śļŻī Ēøä ņ▓┤ņżæ, Ļ│©ļ░ĆļÅä ļ░Å ņ¦łļ│æĒÖ£ņä▒ļÅäņØś ļ│ĆĒÖöņÖĆ ĻĘĖ ņāüĻ┤ĆĻ┤ĆĻ│äļź╝ ĒÖĢņØĖĒĢśņśĆļŗż.
2008ļģä 4ņøöļČĆĒä░ 2010ļģä 10ņøöĻ╣īņ¦Ć ļ│ĖņøÉ ļźśļ¦łĒŗ░ņŖż ļé┤Ļ│╝ ņÖĖļלņŚÉ ņ¦ĆņåŹņĀüņ£╝ļĪ£ ļé┤ņøÉĒĢ£ Modified New York CriteriaņŚÉ ĒĢ®ļŗ╣ĒĢ£ Ļ░Ģņ¦üņä▒ ņ▓ÖņČöņŚ╝ ĒÖśņ×É ņżæ ņĄ£ņåī 3Ļ░£ņøö ņØ┤ņāü ļ╣äņŖżĒģīļĪ£ņØ┤ļō£ņä▒ ņåīņŚ╝ņ¦äĒåĄņĀ£(nonsteroidal anti-inflammatory drugs, NSAIDs), sulfasalazine, methotrexate (MTX)ņŚÉļÅä ļ░śņØæĒĢśņ¦Ć ņĢŖĻ│Ā ņ¦łļ│æĒÖ£ņä▒ļÅäĻ░Ć ļåÆņØĆ ĒÖśņ×É 31ļ¬ģ(ļé©ņ×É 25ļ¬ģ, ņŚ¼ņ×É 6ļ¬ģ, ņŚ░ļĀ╣ņØĆ 20-60ņäĖ)ņØä ļīĆņāüņ£╝ļĪ£ ĒĢśņśĆļŗż. Ļ░ä ņ¦łĒÖś, ņŗĀ ņ¦łĒÖś, Ļ│©ņĀł ļ│æļĀźņØ┤ ņ׳ļŖö ĒÖśņ×É, Ļ│©ļŗżĻ│Ąņ”Ø ņĢĮļ¼╝ņØä ļ│ĄņÜ®ĒĢśņŚ¼ Ļ│©ļ░ĆļÅäņŚÉ ņśüĒ¢źņØä ņżä ņłś ņ׳ļŖö ĒÖśņ×ÉļŖö ņĀ£ņÖĖĒĢśņśĆļŗż.
31ļ¬ģņØś ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ļéśņØ┤, ņä▒ļ│ä, ņ▓┤ņżæ, ņŗĀņן, Ļ│©ļ░ĆļÅä, ņ▓┤ņ¦łļ¤ē ņ¦Ćņłś, ņ¦łļ│æ ņØ┤ĒÖś ĻĖ░Ļ░ä, Ēśäņ×¼ ļ│ĄņÜ®ņżæņØĖ ņŖżĒģīļĪ£ņØ┤ļō£, MTX ļ│ĄņÜ®ļ¤ēņØä ņĀäņ×É ņ░©ĒŖĖļź╝ ĒåĄĒĢśņŚ¼ ĒøäĒ¢źņĀüņ£╝ļĪ£ ļČäņäØĒĢśņśĆļŗż. ņŖżĒģīļĪ£ņØ┤ļō£ļŖö prednisolone 5 mgņØä ĻĖ░ņżĆņ£╝ļĪ£ ņÜ®ļ¤ēņØä ļ│ĆĒÖśĒĢśņŚ¼ ĒĢ®ņé░ĒĢśņśĆļŗż(Table 1). ņ▓┤ņżæņØĆ ĒÖśņ×ÉĻ░Ć ņÖĖļלļź╝ ļ░®ļ¼Ė ņŗ£ ļÅÖņØ╝ĒĢ£ ņ▓┤ņżæĻ│äļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ 1ļģä ļŗ©ņ£äļĪ£ ņĖĪņĀĢĒĢśņśĆļŗż. Ļ│©ļ░ĆļÅäļŖö dual- energy X-ray absorptiometry (DPX-NT, GE. Lunar, USA)ņØä ņØ┤ņÜ®ĒĢśņŚ¼ ņÜöņČöļČĆ(ņĀ£1-ņĀ£4ņÜöņČö)ņÖĆ ņÖ╝ņ¬Į ļīĆĒć┤ Ļ│©ļČĆļź╝ 1ļģä ļŗ©ņ£äļĪ£ ņĖĪņĀĢĒĢśņśĆļŗż. Ļ│©ļ░ĆļÅäļŖö ĒÖśņ×ÉĻĄ░ņØś ĻĄ¼ņä▒ņØ┤ ļéśņØ┤Ļ░Ć ņĀŖņØĆ ļé©ņ×ÉņÖĆ ĒÅÉĻ▓Į ņĀä ņŚ¼ņä▒ņ×äņØä Ļ│ĀļĀżĒĢśņŚ¼ Z Ļ░Æņ£╝ļĪ£ Ēæ£ņŗ£ĒĢśņśĆļŗż[11]. ņ¦łļ│æĒÖ£ņä▒ļÅäļŖö 2ļģäĻ░ä 6Ļ░£ņøö ļŗ©ņ£äļĪ£ Bath ankylosing spondylitis disease activity index (BASDAI)ļź╝ ņ▓┤Ēü¼ĒĢśņŚ¼ ĒĢ£ĻĖĆļĪ£ ļ▓łņŚŁĒĢ£ ņŚ¼ņä» Ļ░Ćņ¦Ć ļ¼ĖĒĢŁņŚÉ ļīĆĒĢ£ ļŗĄņØä 0-10ņĀÉĻ╣īņ¦Ć ņĀÉņłśĒÖöĒĢśĻ│Ā ņØ┤ļź╝ Ļ│äņé░ĒĢ£ Ļ░ÆņØä ņØ┤ņÜ®ĒĢśņśĆļŗż[10]. ĒśłņĢĪĒĢÖņĀüņØĖ ņ¦łļ│æĒÖ£ņä▒ļÅä ņ¦ĆĒæ£ļĪ£ļŖö C-ļ░śņØæ ļŗ©ļ░▒(C-reactive protein)Ļ│╝ ņĀüĒśłĻĄ¼ ņ╣©Ļ░Ģ ņåŹļÅä(erythrocyte sedimentation rate)ļź╝ ņĖĪņĀĢĒĢśņśĆļŗż. ĒÖśņ×ÉļōżņØĆ etanercept, adalimumabņØä Ļ░üĻ░ü 25 mg ņŻ╝ 2ĒÜī Ēö╝ĒĢśņŻ╝ņé¼, 40 mg 2ņŻ╝ 1ĒÜī Ēö╝ĒĢśņŻ╝ņé¼ļĪ£ ņ¦ĆņåŹņĀüņ£╝ļĪ£ Ēł¼ņŚ¼ļ░øņĢśļŗż.
ņØ╝ļĀ©ņØś ņ▓┤ņżæ, Ļ│©ļ░ĆļÅä, ESR, CRP, BASDAIņØś ļ│ĆĒÖöņŚÉ ļīĆĒĢ£ ĒåĄĻ│äĻ▓ĆņĀĢņØĆ ļ╣äļ¬©ņłśņĀüņØĖ ļ░®ļ▓ĢņØĖ Frideman testļź╝ ņé¼ņÜ®ĒĢśņśĆĻ│Ā Ļ░ü ņłśņ╣śļōż ņé¼ņØ┤ņØś ņāüĻ┤ĆĻ┤ĆĻ│äļŖö Spearman correlation analysisļź╝ ņé¼ņÜ®ĒĢśņśĆļŗż. p valueļŖö 0.05 ņØ┤ĒĢśļź╝ ĒåĄĻ│äĒĢÖņĀüņ£╝ļĪ£ ņØśļ»ĖĻ░Ć ņ׳ļŖö Ļ▓āņ£╝ļĪ£ ļ│┤ņĢśņ£╝ļ®░ ņłśņ╣śļŖö ĒÅēĻĘĀ ┬▒ Ēæ£ņżĆ ĒÄĖņ░©ļĪ£ ļéśĒāĆļāłļŗż. ĒåĄĻ│äņĀü ļČäņäØņØĆ ņāüņÜ® ĒåĄĻ│ä ĒöäļĪ£ĻĘĖļשņØĖ ļ¦łņØ┤Ēü¼ļĪ£ ņåīĒöäĒŖĖ ņ£łļÅäņÜ░ņÜ® SPSS Version 18.0 (Chicago, USA)ļź╝ ņé¼ņÜ®ĒĢśņśĆļŗż.
Ļ░Ģņ¦üņä▒ ņ▓ÖņČöņŚ╝ ĒÖśņ×É 31ļ¬ģ(ļé©ņ×É 25ļ¬ģ, ņŚ¼ņ×É 6ļ¬ģ)ņØś ņ×äņāüņĀü, ņāØļ¼╝ĒĢÖņĀü, Ļ│©ļ░ĆļÅäņØś ĒŖ╣ņ¦ĢņØä Ēæ£ 1ņŚÉ ĻĖ░ņłĀĒĢśņśĆļŗż. ņŚ░ļĀ╣ņØĆ 36.2 ┬▒ 9.5ņäĖ, ņ▓┤ņżæņØĆ 67.4 ┬▒ 13.0 kg, ņ▓┤ņ¦łļ¤ē ņ¦ĆņłśļŖö 23.4 ┬▒ 4.0 kg/m2, ņ¦łļ│æ ņØ┤ĒÖś ĻĖ░Ļ░äņØĆ 6.8┬▒4.9ļģäņØ┤ņŚłļŗż. TNF-╬▒ ĻĖĖĒĢŁņĀ£ ņ╣śļŻī ņżæ ņŖżĒģīļĪ£ņØ┤ļō£ ļ│ĄņÜ®ņØä ņ¦ĆņåŹĒĢ£ ĒÖśņ×ÉļŖö 1ļ¬ģņ£╝ļĪ£ prednisoloneņØś 1ņØ╝ ĒÅēĻĘĀ ļ│ĄņÜ®ļ¤ēņØĆ 5.1 ┬▒ 7.1 mg/dayņśĆļŗż. HLA-B27 ņ¢æņä▒ņØĖ ĒÖśņ×ÉļŖö 30ļ¬ģ(96.7%), ESRņØĆ 25.1 ┬▒19.0 mm/hr, CRPļŖö 1.4 ┬▒ 2.0 mg/dL, BASDAIļŖö 5.6 ┬▒ 2.8ņØ┤ņŚłļŗż. Total lumbar spine Z scoreņØś ĒÅēĻĘĀņØĆ -0.2 ┬▒ 1.6, Total femur Z scoreņØś ĒÅēĻĘĀņØĆ -0.01 ┬▒ 1.3ņØ┤ņŚłļŗż.
TNF-╬▒ ĻĖĖĒĢŁņĀ£ ņ╣śļŻī ņĀäĻ│╝ ļ╣äĻĄÉĒ¢łņØä ļĢī ņ╣śļŻī 1ļģä ĒøäņÖĆ 2ļģä ĒøäņØś ļ¬Ėļ¼┤Ļ▓īņØś ĒÅēĻĘĀņØĆ 68.6 ┬▒ 13.2 kg, 69.2 ┬▒ 15.2 kgļĪ£ p valueĻ░Ć 0.02ļĪ£ ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļź╝ ļ│┤ņśĆņ£╝ļ®░ ņŗ£Ļ░äņØ┤ Ļ░łņłśļĪØ Ļ░ÆņØ┤ ņ”ØĻ░ĆĒĢ©ņØä ņĢī ņłś ņ׳ļŗż(Fig. 1). ņ╣śļŻī 2ļģä ĒøäņØś ņ▓┤ņżæĻ│╝ ņ¦łļ│æĒÖ£ņä▒ļÅäņØś ņ¦ĆĒæ£ņØĖ ESR (r = -0.3, p= 0.1), CRP (r = 0.02, p= 0.9), BASDAI (r = -0.02, p= 0.9)ļź╝ ļ╣äĻĄÉĒĢśņśĆņØä ļĢī ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ ņāüĻ┤ĆĻ┤ĆĻ│äļŖö ņ░ŠņĢäļ│╝ ņłś ņŚåņŚłļŗż(Table 2).
TNF-╬▒ ĻĖĖĒĢŁņĀ£ ņ╣śļŻī ņĀä ņÜöņČöļČĆ(ņĀ£1-ņĀ£4ņÜöņČö) ĒÅēĻĘĀ Ļ│©ļ░ĆļÅäļŖö -0.2 ┬▒ 1.6ņØ┤ņŚłĻ│Ā ņ╣śļŻī 1ļģä ĒøäņÖĆ 2ļģä ĒøäņØś ņÜöņČöļČĆ ĒÅēĻĘĀ Ļ│©ļ░ĆļÅäļŖö(Z-scoreļĪ£ ļ│ĆĒÖś ņŗ£) Ļ░üĻ░ü 0.1 ┬▒ 1.6, 0.2 ┬▒ 1.6ņ£╝ļĪ£ p valueĻ░Ć 0.001 ņØ┤ĒĢśļĪ£ ĒåĄĻ│äņĀüņ£╝ļĪ£ ļ¦żņÜ░ ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļź╝ ļ│┤ņśĆņ£╝ļ®░ ņŗ£Ļ░äņØ┤ Ļ░łņłśļĪØ Ļ░ÆņØ┤ ņ”ØĻ░ĆĒĢ©ņØä ņĢī ņłś ņ׳ļŗż(Fig. 1). ņ╣śļŻī 2ļģäņ¦ĖņØś ņÜöņČöļČĆ Ļ│©ļ░ĆļÅäņÖĆ ņ¦łļ│æĒÖ£ņä▒ļÅäņØś ņ¦ĆĒæ£ņØĖ ESR (r = 0.3, p= 0.1), CRP (r = 0.3, p= 0.05), BASDAI (r = -0.2, p= 0.1)ņÖĆņØś ņāüĻ┤Ć Ļ┤ĆĻ│äļź╝ ņĪ░ņé¼ĒĢśņśĆņ£╝ļéś ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ ņĀÉņØĆ ļ░£Ļ▓¼ĒĢśņ¦Ć ļ¬╗ĒĢśņśĆļŗż(Table 2).
ļīĆĒć┤ Ļ│©ļČĆņØś ĒÅēĻĘĀ Ļ│©ļ░ĆļÅäļŖö ņ╣śļŻī ņĀä -0.01 ┬▒ 1.3ņØ┤ņŚłĻ│Ā ņ╣śļŻī 1ļģä ĒøäņÖĆ 2ļģä ĒøäņØś ļīĆĒć┤ Ļ│©ļČĆņØś ĒÅēĻĘĀ Ļ│©ļ░ĆļÅäļŖö(Z-scoreļĪ£ ļ│ĆĒÖś ņŗ£) Ļ░üĻ░ü 0.07 ┬▒ 1.2, 0.1 ┬▒ 1.3ņ£╝ļĪ£ ņŗ£Ļ░äņØ┤ Ļ░łņłśļĪØ Ļ░ÆņØ┤ ņ”ØĻ░ĆĒĢśļŖö ņ¢æņāüņØä ļ│┤ņśĆņ£╝ļéś p valueĻ░Ć 0.3ņ£╝ļĪ£ ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ņ¦ĆļŖö ņĢŖņĢśļŗż(Fig. 1). ņ╣śļŻī 2ļģä ĒøäņØś ļīĆĒć┤ Ļ│©ļČĆ Ļ│©ļ░ĆļÅäņÖĆ ļŗżļźĖ ņ¦łļ│æĒÖ£ņä▒ļÅä ņ¦ĆĒæ£ņÖĆņØś ņāüĻ┤ĆĻ┤ĆĻ│äļź╝ ņĪ░ņé¼ĒĢśņśĆņØä ļĢī ESR (r = -0.1, p= 0.4), CRP (r = 0.1, p= 0.3), BASDAI (r = -0.1, p= 0.3)ļĪ£ ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ ņāüĻ┤ĆĻ┤ĆĻ│äļŖö ņ░ŠņĢäļ│╝ ņłś ņŚåņŚłļŗż(Table 2).
TNF-╬▒ ĻĖĖĒĢŁņĀ£ ņ╣śļŻī ņĀä BASDAIļŖö 5.6 ┬▒ 2.8ņĀÉņØ┤ņŚłĻ│Ā ņ╣śļŻī 1ļģä ĒøäņÖĆ 2ļģä ĒøäļŖö Ļ░üĻ░ü 2.3 ┬▒ 1.9ņĀÉ, 2.0 ┬▒ 1.8ņĀÉņ£╝ļĪ£ p valueĻ░Ć 0.01 ļ»Ėļ¦īņ£╝ļĪ£ ĒåĄĻ│äņĀüņ£╝ļĪ£ ļ¦żņÜ░ ņ£ĀņØśĒĢ£ Ļ░Éņåī ņ¢æņāüņØä ļ│┤ņśĆņ£╝ļ®░ ņ╣śļŻī ņĀäņØä ĻĖ░ņżĆņ£╝ļĪ£ ņ╣śļŻī 2ļģäņ¦Ėļ│┤ļŗż ņ╣śļŻī 1ļģäņ¦ĖņŚÉ ļŹö ļ¦ÄņØĆ Ļ░ÉņåīĒÅŁņØä ļ│┤ņØ┤ļŖö ĒŖ╣ņ¦ĢņØä ļ│┤ņśĆļŗż(Fig. 1).
CRPļŖö TNF-╬▒ ĻĖĖĒĢŁņĀ£ ņ╣śļŻī ņĀä 1.4 ┬▒ 2.0 mg/dLņśĆĻ│Ā ņ╣śļŻī 1ļģä ĒøäņÖĆ 2ļģä ĒøäļŖö Ļ░üĻ░ü 0.3 ┬▒ 0.3 mg/dL, 0.5 ┬▒ 1.0 mg/dLņ£╝ļĪ£ p valueĻ░Ć 0.01 ļ»Ėļ¦īņ£╝ļĪ£ ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļź╝ ļ│┤ņśĆņ£╝ļ®░ ņ╣śļŻī ņĀäĻ│╝ ļ╣äĻĄÉĒĢśņŚ¼ ņ╣śļŻī 1ļģä ĒøäņŚÉļŖö Ļ░ÆņØ┤ Ļ░ÉņåīĒĢśņśĆĻ│Ā ņ╣śļŻī 2ļģä ĒøäņŚÉļŖö Ļ░ÆņØ┤ ņĪ░ĻĖł ņ”ØĻ░ĆĒĢśņśĆņ¦Ćļ¦ī ņ╣śļŻī 1ļģä ĒøäņÖĆ ļ╣äĻĄÉĒĢśņŚ¼ Ēü░ ņ░©ņØ┤ļŖö ņŚåņŚłļŗż(Fig. 1).
ESRņØĆ ņ╣śļŻī ņĀä 25.1 ┬▒ 19.0 mm/hrņśĆņ£╝ļ®░ ņ╣śļŻī 1ļģä ĒøäņÖĆ 2ļģä ĒøäļŖö Ļ░üĻ░ü 18.5 ┬▒ 12.7 mm/hr, 27.0 ┬▒ 26.2 mm/hrļĪ£ CRPņÖĆ ļÅÖņØ╝ĒĢśĻ▓ī ņŗ£Ļ░äņŚÉ ļö░ļźĖ Ļ░ÉņåīņÖĆ ņ”ØĻ░Ć ņ¢æņāüņØä ļ│┤ņśĆņ£╝ļéś ĒåĄĻ│äņĀüņØĖ ņ£ĀņØśņä▒ņØĆ ņŚåņŚłļŗż(Fig. 1). 2ļģä ĒøäņØś ESRĻ│╝ CRP Ļ░äņŚÉļŖö ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ ņ¢æņØś ņāüĻ┤ĆĻ┤ĆĻ│ä(r = 0.7, p< 0.01)ļź╝ Ļ┤Ćņ░░ĒĢĀ ņłś ņ׳ņŚłļŗż(Table 2).
Ļ░Ģņ¦üņä▒ ņ▓ÖņČöņŚ╝ņØĆ ņŚēņ╣śņŚēļŹ® Ļ┤ĆņĀłņŚÉņä£ ņŗ£ņ×æĒĢśļŖö ņČĢņä▒ Ļ│©Ļ▓® Ļ┤ĆņĀłņØś ņŚ╝ņ”ØĻ│╝ ļČĆņ░® ļČĆņ£äņŚ╝ņØä ĒŖ╣ņ¦Ģņ£╝ļĪ£ ĒĢśļŖö ņ¦łĒÖśņ£╝ļĪ£, ļ¦īņä▒ ņŚ╝ņ”ØņØ┤ ņ׳ļŖö ļČĆņ£äņØś Ļ│© ņåīņŗżĻ│╝ ļŹöļČłņ¢┤ ņāłļĪ£ņÜ┤ ļ╝łņØś ņāØņä▒ņØä ļÅÖļ░śĒĢśļŖö ņŚŁņäżņĀü ĒŖ╣ņä▒ņØä Ļ░Ćņ¦ĆĻ│Ā ņ׳ļŖö ņ¦łĒÖśņØ┤ļŗż[1,2]. ņØ┤ļ¤¼ĒĢ£ Ļ│© ņåīņŗżņØĆ ņĀĢĒÖĢĒĢ£ ĻĖ░ņĀäņØĆ ņĢīļĀżņĀĖ ņ׳ņ¦Ć ņĢŖņ¦Ćļ¦ī ņĢäļ¦łļÅä ņŚ╝ņ”Øņä▒ cytokinesņØś ņĀäņŗĀ ņŚ╝ņ”Ø ļ░śņØæĻ│╝ ĒÖśņ×ÉņØś ļ¼╝ļ”¼ņĀü ĒÖ£ļÅÖņä▒ ņĀĆĒĢś ļ░Å ņןņÜ┤ļÅÖ ņĀĆĒĢśņŚÉ ļö░ļźĖ Ļ│© ļ»Ėļäżļ×äĒÖöņØś Ļ▓░ĒĢŹ, ņŖżĒģīļĪ£ņØ┤ļō£ņØś ņé¼ņÜ®, Ļ│© ĻĄÉņ▓┤ Ēæ£ņ¦Ćņ×ÉņØś ņ”ØĻ░Ć ļō▒ņ£╝ļĪ£ ņČöņĀĢļÉśĻ│Ā ņ׳ļŗż.
TNF-╬▒ļŖö Ļ░Ģņ¦üņä▒ ņ▓ÖņČöņŚ╝ņØś ļ│æņØĖņŚÉ Ļ╣ŖņØ┤ Ļ┤ĆņŚ¼ĒĢśņŚ¼ ņĄ£ĻĘ╝ ĻĘĖ ņ░©ļŗ©ņĀ£ļź╝ ņØ┤ņÜ®ĒĢ£ ņ╣śļŻīĻ░Ć ņóŗņØĆ ĒÜ©Ļ│╝ļź╝ ļ│┤ņØ┤Ļ│Ā ņ׳ņ¢┤ ņØ┤ ņ¦łĒÖśņŚÉņä£ ņżæņÜöĒĢ£ ņé¼ņØ┤ĒåĀņ╣┤ņØĖņ£╝ļĪ£ ņØĖņŗØļÉśĻ│Ā ņ׳ļŗż. Ļ░Ģņ¦üņä▒ ņ▓ÖņČöņŚ╝ ĒÖśņ×ÉļōżņŚÉĻ▓īņä£ Ļ│©ļ░ĆļÅäņØś Ļ░ÉņåīņÖĆ ļŹöļČłņ¢┤ ņ▓┤ņżæ Ļ░ÉņåīĻ░Ć ņØ╝ņ¢┤ļéśĻ▓ī ļÉśļŖöļŹ░ TNF-╬▒ļŖö ņØ┤ļ¤¼ĒĢ£ ļ│ĆĒÖöļōżņŚÉ ņżæņÜöĒĢ£ ņŚŁĒĢĀņØä ĒĢśĻ│Ā ņ׳ļŖö Ļ▓āņ£╝ļĪ£ ņé¼ļŻīļÉ£ļŗż[9]. TNF-╬▒ļŖö ļ¦īņä▒ ņ¦łĒÖśņŚÉņä£ ņĢģņĢĪņ¦łņØä ņ£Āļ░£ĒĢśļŖö Ļ▓āĻ│╝ļÅä Ļ┤ĆļĀ©ņØ┤ ņ׳ļŖöļŹ░ TNF-╬▒ļŖö ņ£ä ļ░░ņČ£ ņŗ£Ļ░äņØä ņ¦ĆņŚ░ņŗ£ĒéżĻ│Ā ņŚ░ļÅÖ ņÜ┤ļÅÖņØä ņżäņØ┤ļ®░ ņŗØņÜĢ ļČĆņ¦ä, ņŚÉļäłņ¦Ć ņåīļ╣ä ņ”ØĻ░Ć, Ļ│©Ļ▓®ĻĘ╝ ņØ┤ĒÖöņ×æņÜ®, ņ¦Ćļ░®ĒĢ®ņä▒ņØä ņ¢ĄņĀ£ĒĢśĻ│Ā ņ¦Ćņ¦łĻ│╝ ļŗ©ļ░▒ņ¦ł ļČäĒĢ┤ļź╝ ņ”ØĻ░Ćņŗ£Ēéżļ®░[5-8] ļśÉĒĢ£ ļ¦īņä▒ ņŚ╝ņ”Ø ņŗ£ņŚÉ ņŗØņÜĢĻ│╝ ņŚÉļäłņ¦Ć ņåīļ╣äļź╝ ņĪ░ņĀłĒĢśļŖö ĒśĖļź┤ļ¬¼ ļŗ©ļ░▒ņØĖ leptinņØś ņ£Āļ”¼Ļ░Ć ņ”ØĻ░ĆĒĢ£ļŗżļŖö ļ│┤Ļ│ĀļÅä ņ׳ļŗż[12].
Truyens ļō▒[7]ņØĆ ļÅÖļ¼╝ņŚ░ĻĄ¼ņŚÉņä£ TNF-╬▒ ĻĖĖĒĢŁņĀ£ļź╝ ņé¼ņÜ®ĒĢ£ ļÆż ņĢģņĢĪņ¦łņØ┤ Ļ░£ņäĀļÉśņŚłļŗżļŖö ņŚ░ĻĄ¼ļź╝ ļ░£Ēæ£ĒĢ£ ļ░ö ņ׳ņ£╝ļ®░ Maillefertļō▒[6]ņØĆ 45ļ¬ģņØś Ļ░Ģņ¦üņä▒ ņ▓ÖņČöņŚ╝ ĒÖśņ×ÉņŚÉĻ▓ī TNF-╬▒ ĻĖĖĒĢŁņĀ£ļź╝ ņé¼ņÜ®ĒĢ£ ļÆż Ēśłņ▓ŁņŚÉņä£ Ļ│©ņØś ņ×¼ĒØĪņłśĻ░Ć Ļ░ÉņåīĒĢ©ņØä ļ│┤ņŚ¼ņŻ╝ņŚłĻ│Ā 2ļģäĻ░äņØś Ļ│©ļ░ĆļÅäļź╝ ņČöņĀüĻ┤Ćņ░░ĒĢ£ Ļ▓░Ļ│╝ ņŚ╝ņ”Ø ļ░śņØæņØ┤ ņ¦ĆņåŹļÉ£ ĻĄ░ņŚÉņä£ Ēø©ņö¼ ļ¦ÄņØĆ Ļ│©ļ░ĆļÅä ņĀĆĒĢśļź╝ ļ│┤Ļ│ĀĒĢ£ ļ░ö ņ׳ļŗż. ņØ┤ļŖö ņŚ╝ņ”Ø ļ░śņØæĻ│╝ Ļ┤ĆļĀ©ļÉ£ Ļ│©ņØś ņ×¼ĒØĪņłśļź╝ ņĪ░ņĀłĒĢśļŖö TNF-╬▒ ĻĖĖĒĢŁņĀ£ņØś Ļ░äņĀæņĀüņØĖ ĒÜ©Ļ│╝ļź╝ ļéśĒāĆļéĖļŗż.
Allali ļō▒[13]ņØĆ 29ļ¬ģņØś Ļ░Ģņ¦üņä▒ ņ▓ÖņČöņŚ╝ ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ TNF-╬▒ ĻĖĖĒĢŁņĀ£ ņżæ ĒĢśļéśņØĖ infliximabņØś ņŻ╝ņé¼ ņ╣śļŻī Ēøä 6Ļ░£ņøö ļÆżņØś Ļ│©ļ░ĆļÅäļź╝ ņ▓┤Ēü¼ĒĢśņŚ¼ ņÜöņČöļČĆņÖĆ ļīĆĒć┤Ļ│© Ļ▓ĮļČĆņŚÉņä£ Ļ░üĻ░ü 3.6%, 1.1%ņØś Ļ│©ļ░ĆļÅäņØś ņ”ØĻ░Ćļź╝ ĒÖĢņØĖĒĢśņśĆļŗż. Dernis ļō▒[14]ļÅä 29ļ¬ģņØś Ļ░Ģņ¦üņä▒ ņ▓ÖņČöņŚ╝ ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ņ£Āņé¼ĒĢ£ Ļ▓░Ļ│╝ļź╝ ļ░£Ēæ£ĒĢ£ ļ░ö ņ׳ļŗż. Briot ļō▒[9]ņØĆ Ļ░Ģņ¦üņä▒ ņ▓ÖņČöņŚ╝ ĒÖśņ×ÉļōżņØä ļīĆņāüņ£╝ļĪ£ ĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ TNF-╬▒ ĻĖĖĒĢŁņĀ£ ņ╣śļŻī 2ļģä Ēøä ņ▓┤ņżæĻ│╝ Ļ│©ļ░ĆļÅäļź╝ Ļ▓Ćņé¼ĒĢ£ Ļ▓░Ļ│╝ Ļ░üĻ░ü ĒÅēĻĘĀ 2.2 kg, ĒÅēĻĘĀ 5.8%ļĪ£ ņ£ĀņØśĒĢśĻ▓ī ņ”ØĻ░ĆĒĢśļŖö Ļ▓āņØä ļ│┤ņŚ¼ņŻ╝ņŚłļŗż.
ĻĄŁļé┤ņŚÉņä£ļŖö ņĀäĒåĄņĀüņØĖ ņ╣śļŻīņŚÉ ļ░śņØæĒĢśņ¦Ć ņĢŖļŖö Ļ░Ģņ¦üņä▒ ņ▓ÖņČöņŚ╝ ĒÖśņ×ÉļōżņØä ļīĆņāüņ£╝ļĪ£ etanerceptņØś ņŻ╝ņé¼ ņ╣śļŻī Ēøä ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ BASDAIņØś Ļ░Éņåīļź╝ ļ░£Ēæ£ĒĢ£ ļ░ö ņ׳ļŗż[15].
ļ│Ė ņŚ░ĻĄ¼ļŖö Ļ░Ģņ¦üņä▒ ņ▓ÖņČöņŚ╝ņØä ņ¦äļŗ©ļ░øņØĆ ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ 2ļģäĻ░ä ĒøäĒ¢źņĀüņ£╝ļĪ£ ņŚ░ĻĄ¼Ē¢łņØä ļĢī TNF-╬▒ ĻĖĖĒĢŁņĀ£ ņ╣śļŻī Ēøä ĒÅēĻĘĀ ņ▓┤ņżæĻ│╝ ņÜöņČöļČĆņØś Ļ│©ļ░ĆļÅäĻ░Ć(Z-score) ņ”ØĻ░ĆĒĢśļŖö Ļ▓āņØä ļ│┤ņŚ¼ņŻ╝ņŚłļŗż. ņ▓┤ņżæņØĆ 2ļģäĻ░ä ĒÅēĻĘĀ 1.7 ┬▒ 4.8 kgņØś ņ”ØĻ░Ć ņ¢æņāüņØä ļ│┤ņśĆņ£╝ļ®░ ņÜöņČöļČĆ(ņĀ£1-ņĀ£4ņÜöņČö) Ļ│©ļ░ĆļÅäļŖö ņ╣śļŻī ņĀäĻ│╝ ļ╣äĻĄÉĒĢśņŚ¼ ņ╣śļŻī 2ļģä ņ¦Ė Ļ░üĻ░ü 0.5 ┬▒ 0.7ņØś ņ£ĀņØśĒĢ£ ņ”ØĻ░Ćļź╝ ļ│┤ņśĆņ£╝ļ®░ ņ¦łļ│æĒÖ£ņä▒ļÅäņØś ņ¦ĆĒæ£ņØĖ BASDAIļÅä -3.6 ┬▒ 2.8ņØś ņ£ĀņØśĒĢ£ Ļ░Éņåī ņ¢æņāüņØä ļéśĒāĆļé┤ņ¢┤ TNF-╬▒ ĻĖĖĒĢŁņĀ£ ņ╣śļŻī ĒøäņØś ņ▓┤ņżæĻ│╝ ņÜöņČöļČĆ Ļ│©ļ░ĆļÅäņØś Ļ░£ņäĀ ļ░Å ņŻ╝Ļ┤ĆņĀüņØĖ ņ”ØņāüņØś ĒśĖņĀäņØä ļ│┤ņØĖļŗżĻ│Ā Ļ▓░ļĪĀņØä ļé┤ļ”┤ ņłś ņ׳ļŗż.
ĻĘĖļ¤¼ļéś ņÜöņČöļČĆ Ļ│©ļ░ĆļÅäņØś ņ£ĀņØśĒĢ£ ņ”ØĻ░ĆņÖĆļŖö ļŗ¼ļ”¼ ļīĆĒć┤ Ļ│© Ļ│©ļ░ĆļÅäņØś ņé░ņłĀņĀüņØĖ ņ”ØĻ░ĆļŖö ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢśņ¦Ć ņĢŖņØĆ Ļ▓āņ£╝ļĪ£ ļéśņÖöļŗż. ņØ┤ņŚÉ ļīĆĒĢ┤ņä£ļŖö Ļ│©ļŗżĻ│Ąņ”ØņØś ņ╣śļŻī ļ░śņØæ ĒÅēĻ░Ć ņŗ£ņŚÉļÅä ļīĆĒć┤Ļ│©Ļ│╝ ņÜöņČöļČĆ Ļ│©ļ░ĆļÅä ņżæ ņ¢┤ļ¢ż Ļ▓āņØä ņäĀĒāØĒĢĀ Ļ▓āņØĖņ¦ĆņŚÉ ļīĆĒĢ£ ņĀĢĒÖĢĒĢ£ ņØśĻ▓¼ņØ╝ņ╣śĻ░Ć ņŚåļŖö ņāüĒā£ņØ┤Ļ│Ā ļźśļ¦łĒŗ░ņŖż Ļ┤ĆņĀłņŚ╝ ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ĒĢ£ TNF-╬▒ ĻĖĖĒĢŁņĀ£ ņ╣śļŻī ĒøäņØś Ļ│©ļ░ĆļÅä ļ│ĆĒÖöļź╝ ņĖĪņĀĢĒĢ£ ļŗżļźĖ ņŚ░ĻĄ¼ņŚÉņä£ļÅä ņÜöņČöļČĆļ¦ī ļŗ©ļÅģņ£╝ļĪ£ ņāüņŖ╣ĒĢ£ Ļ▓░Ļ│╝ļź╝ ļ│┤Ļ│ĀĒĢ£ ļ░ö ņ׳ņ¢┤ TNF-╬▒ ĻĖĖĒĢŁņĀ£ ņ╣śļŻī ĒøäņØś Ļ│©ļ░ĆļÅä ņāüņŖ╣ņŚÉ ļīĆĒĢ£ ņ╣śļŻīļ░śņØæņØä ĒÅēĻ░ĆĒĢĀ ļĢī ņ¢┤ļ¢ż ļČĆņ£äņŚÉ ļŹö ļ╣äņżæņØä ļæś Ļ▓āņØĖĻ░ĆņŚÉ ļīĆĒĢ┤ņä£ļÅä ņØśĻ▓¼ņØ╝ņ╣śĻ░Ć ņÜöĻĄ¼ļÉśļŖö ļ░öņØ┤ļŗż[16].
ĒśłņĢĪĒĢÖņĀüņØĖ ņŚ╝ņ”Øņ¦ĆĒæ£ņØĖ ESRĻ│╝ CRPļŖö ļæÉ ļ│Ćņłś Ļ░äņØś ņ£ĀņØśĒĢ£ ņ¢æņØś ņāüĻ┤ĆĻ┤ĆĻ│äļŖö ļ│┤ņśĆņ£╝ļ®░ ESRņØś ņé░ņłĀņĀüņØĖ Ļ░ÉņåīļŖö ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢśņ¦Ć ņĢŖņĢśņ¦Ćļ¦ī CRPņØś Ļ░ÉņåīļŖö ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ Ļ▓░Ļ│╝ļź╝ ļ│┤ņŚ¼ ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö TNF-╬▒ ĻĖĖĒĢŁņĀ£ ņ╣śļŻī Ēøä ĒśłņĢĪĒĢÖņĀüņØĖ ņŚ╝ņ”Ø ņ¦ĆĒæ£ņØś Ļ░Éņåīļź╝ ļéśĒāĆļé┤ļŖö ņ¦ĆĒæ£ļĪ£ņä£ CRPĻ░Ć ļŹö ņ£ĀņÜ®ĒĢ£ Ļ▓āņ£╝ļĪ£ ļéśĒāĆļé¼ļŗż.
ļśÉĒĢ£ Ļ│©ļ░ĆļÅäņÖĆ ņ▓┤ņżæņØś ņ”ØĻ░ĆļŖö TNF-╬▒ ĻĖĖĒĢŁņĀ£ļĪ£ ņØĖĒĢ┤ ņĀäņŗĀņØś ņŚ╝ņ”Ø ļ░śņØæņØś Ļ░ÉņåīņÖĆ ļÅÖļ░śļÉśļŖö Ļ▓āņ£╝ļĪ£ Ļ░ĆņĀĢĒĢśņśĆĻ│Ā 2ļģäĻ░äņØś Ļ│©ļ░ĆļÅäņÖĆ ņ▓┤ņżæņØä ņ¦łļ│æĒÖ£ņä▒ļÅäņØś ņ¦ĆĒæ£(BASDAI, ESR, CRP)ņÖĆ ļ╣äĻĄÉĒĢśņŚ¼ ĻĘĖ Ļ┤ĆļĀ©ņä▒ņØä ņ░ŠņĢäļ│┤Ļ│Āņ×É ĒĢśņśĆņ£╝ļéś Ļ░ĆņäżņŚÉ ņāüņØæĒĢśļŖö Ļ┤ĆļĀ©ņä▒ņØĆ ņ░ŠņĢäļ│╝ ņłś ņŚåņŚłļŗż(Table 2).
ļ│Ė ņŚ░ĻĄ¼ņØś Ļ░Ćņן Ēü░ ņĀ£ĒĢ£ņĀÉņ£╝ļĪ£ļŖö ļīĆņĪ░ĻĄ░Ļ│╝ņØś ļ╣äĻĄÉ ņŚåņØ┤ ņé¼ņĀä, ņé¼Ēøä ņŚ░ĻĄ¼ļź╝ ņ¦äĒ¢ēĒĢ£ Ļ▓āņØ┤ļ®░ TNF-╬▒ ĻĖĖĒĢŁņĀ£ņÖĖņØś ļŗżļźĖ ļ│ĆņłśļōżņØ┤ ĒÖśņ×ÉņØś Ļ│©ļ░ĆļÅäņÖĆ ņ▓┤ņżæņØś ļ│ĆĒÖöņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣Ā ņłśļÅä ņ׳ļŗżļŖö ņĀÉņØś Ļ░äĻ│╝ļź╝ ļōż ņłś ņ׳ņ¢┤ Ē¢źĒøä ņĀäĒåĄņĀüņØĖ NSAIDs ņ╣śļŻīļź╝ ņ¦ĆņåŹĒĢśļŖö ļīĆņĪ░ĻĄ░Ļ│╝ņØś ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢĀ Ļ▓āņ£╝ļĪ£ ņé¼ļŻīļÉ£ļŗż. ņ▓┤ņ¦łļ¤ē ņ¦Ćņłś(BMI)ņØś ņĖĪņĀĢņŚÉ ņ׳ņ¢┤ņä£ ņ”ØĻ░Ć ņ¢æņāüņØ┤ ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ Ļ▓āņ£╝ļĪ£ ļéśĒāĆļé¼ņ£╝ļéś ņØ┤ļŖö ņ▓┤ņżæņØś ņ”ØĻ░ĆņŚÉ ļö░ļźĖ ļ│ĆĒÖöļĪ£ ļ│┤ņØ┤ļ®░ ļ¬Ėņ▓┤ ĻĄ¼ņä▒ ņä▒ļČä(body composition)ņŚÉ ļīĆĒĢ£ Ļ░äĻ│╝Ļ░Ć ņ׳ņ¢┤ ĒĢ┤ņäØņŚÉ ņśżļźśļź╝ ņØ╝ņ£╝Ēé¼ ņłś ņ׳ņ¢┤ ĻĖ░ņ×¼ĒĢśņ¦Ć ņĢäļŗłĒĢśņśĆļŗż. ļśÉĒĢ£ Ļ│© ĻĄÉņ▓┤ Ēæ£ņ¦Ćņ×ÉņØś ļåŹļÅäĻ░Ć ļłäļØĮļÉ£ ņĀÉņØ┤ ļ│Ė ņŚ░ĻĄ¼ņØś ņĀ£ĒĢ£ņĀÉņ£╝ļĪ£ ņé¼ļŻīļÉ£ļŗż.
Ļ░Ģņ¦üņä▒ ņ▓ÖņČöņŚ╝ ĒÖśņ×ÉļōżņØä ļīĆņāüņ£╝ļĪ£ ĒĢ£ Ļ│©ļ░ĆļÅäņÖĆ ņ▓┤ņżæ, ņ¦łļ│æĒÖ£ņä▒ļÅäņØś ļ│ĆĒÖöņŚÉ ļīĆĒĢ£ ĻĄŁļé┤ ņ×ÉļŻīļŖö ņÖĖĻĄŁņŚÉ ļ╣äĒĢ┤ ļ»Ėļ»ĖĒĢ£ ņŗżņĀĢņØ┤ļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ĻĄŁļé┤ņØś 31ļ¬ģņØś Ļ░Ģņ¦üņä▒ ņ▓ÖņČöņŚ╝ ĒÖśņ×ÉļōżņØä ļīĆņāüņ£╝ļĪ£ TNF-╬▒ ĻĖĖĒĢŁņĀ£ ņ╣śļŻī Ēøä ņ▓┤ņżæĻ│╝ ņÜöņČöļČĆ Ļ│©ļ░ĆļÅä ļ░Å BASDAIĻ░Ć ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢśĻ▓ī ņ”ØĻ░ĆĒĢśļŖö Ļ▓āņØä ĒÖĢņØĖĒĢśņśĆĻĖ░ņŚÉ ļ│┤Ļ│ĀĒĢśļŖö ļ░öņØ┤ļŗż.
REFERENCES
1. Gran JT, Husby G. Epidemiology of ankylosing spondylitis. In: Hochberg MC, Silman AJ, Smolen JS, Weinblatt ME, Weisman MH, eds. Semin Arthritis Rheumatology. 1993:22:319ŌĆō334.
2. Braun J, Bollow M, Remlinger G, et al. Prevalence of spondylarthropathies in HLA-B27 positive and negative blood donors. Arthritis Rheum 1998;41:58ŌĆō67.


3. Gratac├│s J, Collado A, Filella X, et al. Serum cytokines (IL-6, TNF-alpha, IL-1 beta and IFN-gamma) in ankylosing spondylitis: a close correlation between serum IL-6 and disease activity and severity. Br J Rheumatol 1994;33:927ŌĆō931.


4. Braun J, Bollow M, Neure L, et al. Use of immunohistologic and in situ hybridization techniques in the examination of sacroiliac joint biopsy specimens from patients with ankylosing spondylitis. Arthritis Rheum 1995;38:499ŌĆō505.


5. Yumet G, Shumate ML, Bryant P, Lin CM, Lang CH, Cooney RN. Tumor necrosis factor mediates hepatic growth hormone resistance during sepsis. Am J Physiol Endocrinol Metab 2002;283:E472ŌĆō481.

6. Maillefert JF, Aho LS, El Maghraoui A, Dougados M, Roux C. Changes in bone density in patients with ankylosing spondylitis: a two-year follow-up study. Osteoporos Int 2001;12:605ŌĆō609.


7. Truyens C, Torrico F, Angelo-Barrios A, et al. The cachexia associated with Trypanosoma cruzi acute infection in mice is attenuated by anti-TNF-alpha, but not by anti-IL-6 or anti-IFN-gamma antibodies. Parasite Immunol 1995;17:561ŌĆō568.


8. Strassmann G, Kambayashi T. Inhibition of experimental cancer cachexia by anti-cytokine and anti-cytokine-receptor therapy. Cytokines Mol Ther 1995;1:107ŌĆō113.

9. Briot K, Gossec L, Kolta S, Dougados M, Roux C. Prospective assessment of body weight, body composition, and bone density changes in patients with spondyloarthropathy receiving anti-tumor necrosis factor-alpha treatment. J Rheumatol 2008;35:855ŌĆō861.

10. Park HJ, Kim SH, Lee JE, Jun JB, Bae SC. Korean translation and validation of Bath ankylosing spondylitis disease activity index (BASDAI): a pilot test. Value Health 2008;11:99ŌĆō104.


11. Writing Group for the ISCD Position Development Conference. Diagnosis of osteoporosis in men, premenopausal women, and children. J Clin Densitom 2004;7:17ŌĆō26.

12. Kirchgessner TG, Uysal KT, Wiesbrock SM, Marino MW, Hotamisligil GS. Tumor necrosis factor-alpha contributes to obesity-related hyperleptinemia by regulating leptin release from adipocytes. J Clin Invest 1997;100:2777ŌĆō2782.



13. Allali F, Breban M, Porcher R, Maillefert JF, Dougados M, Roux C. Increase in bone mineral density of patients with spondyloarthropathy treated with anti-tumour necrosis factor alpha. Ann Rheum Dis 2003;62:347ŌĆō349.



14. Demis E, Roux C, Breban M, Dougados M. Infliximab in spondylarthropathy: influence on bone density. Clin Exp Rheumatol 2002;20(6 Suppl 28):S185ŌĆō186.

Change in body weight, lumbar bone mineral density (LBMD), femoral bone mineral density (FBMD), erythrocyte sedimentation rate (ESR), C-reactive protein (CRP), Bath ankylosing spondylitis disease activity index (BASDAI) during anti-TNF-╬▒ therapy.LBMD, lumbar bone mineral density; FBMD, femoral bone mineral density; ESR, erythrocyte sedimentation rate; CRP, C-reactive protein; BASDAI, Bath ankylosing spondylitis disease activity index.
*p < 0.05, **p < 0.01.
Figure┬Ā1.
Table┬Ā1.
Characteristics of patients receiving anti TNF-╬▒ therapy
Table┬Ā2.
Spearman correlation analysis of 2-year changes
| 2-yr changes | Body weight | Mean LDMD | Mean FBMD | ESR | CRP | BASDAI |
|---|---|---|---|---|---|---|
| Body weight | - | - | - | - | - | - |
| Mean LDMD | -0.3 | - | - | - | - | - |
| Mean FBMD | 0.2 | 0.2 | - | - | - | - |
| ESR | -0.3 | 0.3 | -0.1 | - | - | - |
| CRP | 0.02 | 0.3 | 0.1 | 0.7a | - | - |
| BASDAI | -0.02 | -0.2 | -0.1 | -0.2 | 0.3 | - |
-
METRICS

-
- 1 Crossref
- 0 Scopus
- 7,731 View
- 79 Download



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



