ýä£ Ùíá
ÝØëÙÂÇ ÙîÇÙÅÖÙºÑÝÖòý×ÑýªØýùÉ ÙîÇÝò£ ýêÿýêáýØÇ ýÿñÙ×£ ýù¡ýé¼ÙÑ╝ Û░Çýºä Ýæ£ýñÇýáüýØ© ý╣ÿÙúî Ù░®Ù▓òýØ┤Ùéÿ ýêÿýêá Û┤ÇÙá¿ ýé¼ÙºØýØÇ 4-21%Ùí£ ýù¼ýáäÝ×ê ÙåÆÛ▓î Ù│┤Û│áÙÉÿÛ│á ý×êÙïñ[1]. ýªØýâüýØä ÙÅÖÙ░ÿÝòÿýºÇ ýòèÙèö ÝØëÙÂÇ ÙîÇÙÅÖÙºÑÝÖòý×ÑýªØýØÿ Ýè╣ýä▒ýâü ýºêÝÖÿýØÿ ýí░Û©░ Ù░£Û▓¼ýØ┤ ýû┤ÙáñýÜ┤Ùì░ Ýè╣Ý×ê Ýîîýù┤ÙÉ£ ÝØëÙÂÇ ÙîÇÙÅÖÙºÑÝÖòý×ÑýªØý£╝Ùí£ ýØæÛ©ëýêÿýêáýØä Ù░øÙèö Û▓¢ýÜ░ Ù│æýøÉ Ùé┤ ýé¼ÙºØÙÑáýØÇ 50% ýØ┤ýâüý£╝Ùí£ ÙºñýÜ░ ÙåÆÙïñ[2]. ÝØëÙÂÇ ÙîÇÙÅÖÙºÑÝÖòý×ÑýªØ ý╣ÿÙúî Ù░®Ù▓òý£╝Ùí£ ýèñÝàÉÝè© ÛÀ©ÙØ╝ÝöäÝè©ÙÑ╝ ýØ┤ýÜ®Ýò£ ýñæý×¼ýáü ý╣ÿÙúîÙèö ýêÿýêáýØ┤ ÝòäýÜöÝòÿÙéÿ ÙÅÖÙ░ÿÙÉ£ ýºêÝÖÿýØ┤Ùéÿ ÙéÿýØ┤ Ùô▒ý£╝Ùí£ ýêÿýêáýØ┤ ýû┤ÙáñýÜ┤ ÝÖÿý×ÉýùÉýä£ Ùì£ ý╣¿ýèÁýáüýØ© Ù░®Ù▓òý£╝Ùí£ ý╣ÿÙúîÝòÿÛ│áý×É ÙÅäý×àÙÉÿýùêÛ│á Û©░ÛÁ¼ýÖÇ ýï£ýêá Ù░®Ù▓òýØÿ Ù░£ýáäÝòÿÙ®┤ýä£ Ýÿäý×¼ ýú╝ýÜöÝò£ ý╣ÿÙúîÙ▓òý£╝Ùí£ ÙºÄýØ┤ ýï£ÝûëÙÉÿÛ│á ý×êÙïñ. ÝØëÙÂÇ ÙîÇÙÅÖÙºÑÝÖòý×ÑýªØýùÉ ÙîÇÝò£ ýñæý×¼ýáü ý╣ÿÙúî ý┤êÛ©░ýùÉÙèö ýï£ýêáÛ│╝ Û©░ÛÁ¼ýÖÇ Û┤ÇÙá¿ÙÉ£ Ýò®Ù│æýªØýØ┤ ÙºÄýòÿý£╝Ùéÿ ýï£ýêá Û▓¢ÝùÿýØ┤ ýîôýØ┤Û│á Ýò£ý©Á ÝûÑýâüÙÉ£ Û©░ÛÁ¼ÙôñýØ┤ ýäáÙ│┤ýØ┤Ù®┤ýä£ ýáÉý░¿ ýóïýØÇ Û▓░Û│╝ÙôñýØä Ù│┤ýù¼ýú╝Û│á ý×êÙïñ. Ýÿäý×¼Û╣îýºÇýØÿ ÙºÄýØÇ ýù░ÛÁ¼Û▓░Û│╝ÙôñýØÇ ýêÿýêáýùÉ Ù╣äÝò┤ ýñæý×¼ýáü ý╣ÿÙúîÛ░Ç ýï£ýêá ýï£Û░äÛ│╝ ýñæÝÖÿý×Éýïñ ý×àýøÉ Û©░Û░äýØ┤ ýººÛ│á ýáäý▓┤ ý×àýøÉÛ©░Û░äýØ┤ Ùï¿ýÂòÙÉÿÙ®░ ýï£ýêáÛ┤ÇÙá¿ Ýò®Ù│æýªØ Ù░Å ýé¼ÙºØÙÑáýØ┤ ýáüýØÇ Û▓âý£╝Ùí£ Ù│┤Û│áÝòÿÛ│á ý×êÙïñ[1,3].
Ù│© Ùíá
ýáüýØæýªØ
ÝØëÙÂÇÙîÇÙÅÖÙºÑÝÖòý×ÑýªØýØÇ Û░Çý×Ñ ÝØöÝò£ ÝØëÙÂÇÙîÇÙÅÖÙºÑ ýñæý×¼ýáü ý╣ÿÙúîýØÿ ýáüýØæýªØý£╝Ùí£, Ýîîýù┤ýØÿ ý£äÝùÿýä▒ýØ┤ ýêÿýêáÙí£ ýØ©Ýò£ ý£äÝùÿýä▒Ù│┤Ùïñ Ýü░ Û▓¢ýÜ░ ý╣ÿÙúîýØÿ ýáüýØæýªØýØ┤ ÙÉ£Ùïñ. ÙîÇÙÂÇÙÂäýØÿ ÝØëÙÂÇÙîÇÙÅÖÙºÑÝÖòý×ÑýªØýØÇ ýªØýâüýØ┤ ÙÅÖÙ░ÿÙÉÿýºÇ ýòèÛ©░ ÙòîÙ¼©ýùÉ ýï£ýêáýØä Û▓░ýáòÝòá ÙòîÙèö ÝÖÿý×ÉýØÿ ÙÅÖÙ░ÿÙÉ£ ýºêÝÖÿýØ┤Ùéÿ ýéÂýØÿ ýºêýØä Û│áÙáñÝòÿýù¼ Û▓░ýáòÝòÿýù¼ýò╝ Ýò£Ùïñ. ýªØýâüýØ┤ ýùåÙèö Û▓¢ýÜ░ ýØ╝Ù░ÿýáüýØ© ýñæý×¼ýáü ý╣ÿÙúîýØÿ ýáüýØæýªØýØÇ ýºüÛ▓¢ýØ┤ 6 cm ýØ┤ýâüýØ© Û▓¢ýÜ░ýØ┤Ùïñ. ÝåÁýªØýØ┤ ÙÅÖÙ░ÿÙÉ£ Û▓¢ýÜ░Ùèö Ýîîýù┤ýùÉ ý×äÙ░òÝòÿÛ▒░Ùéÿ Ýîîýù┤Ùí£ ýºäÝûëÙÉÿÙèö Û▓âýØä ýØÿÙ»©ÝòÿÛ©░ ÙòîÙ¼©ýùÉ Ýü¼Û©░ýùÉ Û┤ÇÛ│äýùåýØ┤ ýñæý×¼ýáü ý╣ÿÙúîýØÿ ýáüýØæýªØýØ┤ ÙÉ£Ùïñ. Ýü¼Û©░Û░Ç 6 cm ýØ┤ÝòÿýØ© Û▓¢ýÜ░ýùÉÙèö ýáòÛ©░ýáüý£╝Ùí£ ýÂöýáü Û┤Çý░░ÝòÿÙ®┤ýä£ Ýü¼Û©░Û░Ç 6 cm ýØ┤ýâüýØ┤ ÙÉÿÛ▒░Ùéÿ 1ÙàäýùÉ 1 cm ýØ┤ýâü ý╗ñýºÇÙèö Û▓¢ýÜ░ Ýîîýù┤ýØÿ ý£äÝùÿýä▒ýØ┤ ÙåÆý£╝Ù»ÇÙí£ ýï£ýêáýØÿ ýáüýØæýªØýØ┤ ÙÉ£Ùïñ(Fig. 1) [1,4].
Û©êÛ©░ýªØ
ý£áýØ╝Ýò£ ýáêÙîÇýáü Û©êÛ©░ýªØýØÇ Û©░ÛÁ¼ýØÿ ý×¼ýºêýùÉ Û│╝Ù»╝Ù░ÿýØæýØ┤ ý×êÙèö Û▓¢ýÜ░ýØ┤Ùïñ. ýâüÙîÇýáü Û©êÛ©░ýªØýØÇ ýï£ýêáýØä ý£äÝò£ ÙîÇÝç┤ÙÅÖÙºÑ Ùô▒ ýáæÛÀ╝ ÝÿêÛ┤ÇýØÿ Ýü¼Û©░Û░Ç ý×æÛ▒░Ùéÿ ýäØÝÜîÝÖöÛ░Ç ýï¼Ýò┤ ýèñÝàÉÝè© ÛÀ©ÙØ╝ÝöäÝè© ýé¢ý×àýØ┤ ýû┤ÙáñýÜ┤ Û▓¢ýÜ░, Ù┤ëýØ©ÙÂÇý£ä(sealing zone)ýØÿ Û©©ýØ┤Û░Ç ý®ÙÂäÝòÿýºÇ ýòèÙèö Û▓¢ýÜ░ ÛÀ©Ùª¼Û│á ÝÖÿý×ÉÛ░Ç ýáäýïáýáü Û░Éýù╝ýªØýØ┤ ý×êÙèö Û▓¢ýÜ░ýØ┤Ùïñ. ÙîÇÝç┤ÙÅÖÙºÑýØä ýØ┤ýÜ®Ýò£ ýï£ýêáýØ┤ ýù¼ýØÿý╣ÿ ýòèýØÇ Û▓¢ýÜ░ ÙïñÙÑ© Û▓¢Ùí£, ýªë Û▓¢ÙÅÖÙºÑýØ┤Ùéÿ ýóîýï¼ýïñýØä ÝåÁÝò£ ýï£ýêáýØ┤ ýØ┤Ùú¿ýû┤ýºÇÛ©░ÙÅä Ýò£Ùïñ[5].
ýï£ýêá
ýèñÝàÉÝè© ÛÀ©ÙØ╝ÝöäÝè©
ýñæý×¼ýáü ý╣ÿÙúîýùÉ ýô░ýØ┤Ùèö ýèñÝàÉÝè© ÛÀ©ÙØ╝ÝöäÝè©Ùèö ýêÿýêáýáü ý╣ÿÙúîýùÉ ýØ┤ýÜ®ÙÉÿÙèö ÛÀ©ÙØ╝ÝöäÝè©ýùÉýä£ ý░®ýòêÝòÿýù¼ ÙºîÙôñýû┤ýºä Û▓âý£╝Ùí£ ÙîÇÙÅÖÙºÑÝÖòý×ÑýªØýØÿ ÛÀ╝ý£äÙÂÇýÖÇ ýøÉý£äÙÂÇýùÉ ÛÀ©ÙØ╝ÝöäÝè©Û░Ç Ùï¼Ùª░ ýèñÝàÉÝè©Û░Ç Ù│ÁýøÉÙáÑ(radial force)ýØä ýØ┤ýÜ®Ýòÿýù¼ Ù░Çý░®ÙÉÿÛ▓î Ýò¿ý£╝Ùí£ýì¿ Ù│æÙ│ÇýØä ý╣ÿÙúîÝòá ýêÿ ý×êÛ▓î ýá£ý×æÙÉÿýùêÛ│á Ýÿäý×¼Ùèö ý┤êÛ©░ýØÿ ýá£ÝÆêÙôñýØÿ Ùï¿ýáÉýØä Ù│┤ýÖäÝò£ Û©░ÛÁ¼ÙôñýØ┤ Û░£Ù░£ÙÉÿýû┤ ýé¼ýÜ®ÙÉÿÛ│á ý×êÙïñ. ýèñÝàÉÝè© ÛÀ©ÙØ╝ÝöäÝè© ÛÀ╝ý£äÙÂÇýùÉÙèö ýï£ýêá Ýøä ýèñÝàÉÝè© ÛÀ©ÙØ╝ÝöäÝè©Û░Ç ÝÿêýòòýùÉ ýØÿÝò┤ ýøÉý£äÙÂÇÙí£ Ù░ÇÙª¼Ùèö Û▓âýØä Ù░®ýºÇÝòÿÛ©░ ý£äÝò┤ ýá£ÝÆêýØä ýâØýé░ÝòÿÙèö ÝÜîýé¼ÙºêÙïñ Ýè╣ýºòýáüýØ© Û░êÛ│áÙª¼(barb Ýÿ╣ýØÇ hook)Û░Ç Ùï¼Ùáñ ý×êÛ▒░Ùéÿ ÛÀ╝ý£äÙÂÇýùÉ ýèñÝàÉÝè©Û░Ç ýÂöÛ░Çýáüý£╝Ùí£ Ùï¼Ùáñ ý×êÛ©░ÙÅä ÝòÿÙïñ. Ù│ÁÙÂÇÙîÇÙÅÖÙºÑýùÉ Ù╣äÝò┤ ÝØëÙÂÇÙîÇÙÅÖÙºÑýØÇ ÙîÇÙÅÖÙºÑÛÂü ÙÂÇÙÂäýùÉ ÛÁ┤Û│íýØ┤ ý×êÛ│á Ýÿêýòòý£╝Ùí£ ýØ©Ýò£ ýáÇÝò¡ýØä ÙºÄýØ┤ Ù░øý£╝Ù®░ ÙîÇÙÅÖÙºÑÙ▓¢ýØÿ ÝâäÙáÑýä▒ýØ┤ ÙåÆÛ│á ýï£ýêá ýñæ ýù¡Ýûëýáü ÙîÇÙÅÖÙºÑ Ù░òÙª¼ýªØýØÿ ý£äÝùÿýä▒ýØ┤ Ýü¼ÙïñÙèö Ýè╣ýºòýØ┤ ý×êÙïñ. ÛÁ┤Û│íÙÉ£ ÙîÇÙÅÖÙºÑÛÂüýùÉ ýèñÝàÉÝè© ÛÀ©ÙØ╝ÝöäÝè©ÙÑ╝ ýï£ýêáÝòá Ùòî Ýè╣ýºòýáüý£╝Ùí£ ÙéÿÝâÇÙéÿÙèö ýâêÙÂÇÙª¼Ù¬¿ýûæ(bird beaking) ÝÿäýâüýØä ýñäýØ┤Û©░ ý£äÝò┤ ýèñÝàÉÝè© ÛÀ©ÙØ╝ÝöäÝè©ýØÿ ÛÀ╝ý£äÙÂÇ ýèñÝàÉÝè© ÙÂÇÙÂäýØä ýùåýòáÛ▒░Ùéÿ ýèñÝàÉÝè©ÙÑ╝ ýóÇ Ùìö ý┤ÿý┤ÿÝòÿÛ▓î ÙºîÙôñÛ│á Ù»©Ùª¼ ÙîÇÙÅÖÙºÑÛÂüýØÿ ÛÁ┤Û│íýùÉ Ùº×Û▓î ýò¢Û░äýØÇ ÛÁ¼ÙÂÇÙƒ¼ýºä ÝÿòÝâ£Ùí£ ýá£ý×æÝòÿÛ▒░Ùéÿ ÛÁ┤Û│íýùÉ ýóÇ Ùìö ý×ÿ ýáüýØæÝòÿÙèö ý×¼ýºêÙí£ ÙºîÙô£Ùèö Ùô▒ ÙïñýûæÝò£ Ù░®Ù▓òý£╝Ùí£ ýÁ£ýáüÝÖöÙÉ£ Û©░ÛÁ¼ÙÑ╝ ÙºîÙôñÙáñÛ│á Ùà©ÙáÑÝòÿÛ│á ý×êÙïñ. ýØ┤ýÖ©ýùÉÙÅä Û▓¢ÙÅÖÙºÑ Ùô▒ ýú╝ýÜö ÙÂäýºÇÝÿêÛ┤ÇýùÉÙÅä ýï£ýêáÝòá ýêÿ ý×êÛ▓î ÙºîÙôñýû┤ýºä Ýè╣ýêÿÝò£ ýèñÝàÉÝè© ÛÀ©ÙØ╝ÝöäÝè©(fenestrated stent graft, branched stent graft) Ùô▒ÙÅä Û░£Ù░£ÙÉÿýû┤ Ýÿäý×¼ ýØ╝ÙÂÇýùÉýä£ ýé¼ýÜ®ÙÉÿÛ│á ý×êÙïñ.
ýï£ýêá ýáä Û│äÝÜì
ýä▒Û│ÁýáüýØ© ýï£ýêáýØä ý£äÝò┤ ýï£ýêá ýáä Ù¬àÝÖòÝò£ ýÿüýâü ý×ÉÙúîÙÑ╝ Û©░Ù░ÿý£╝Ùí£ ýáòÝÖòÝò£ Û│äÝÜìýØä ýº£Ùèö Û▓âýØ┤ ýñæýÜöÝòÿÙïñ. ýØ╝Ù░ÿýáüý£╝Ùí£ ýí░ýÿüýᣠýªØÛ░ò ýáäýé░ÝÖöÙï¿ý©ÁÝÿêÛ┤Çý┤¼ýÿüýØ┤Ùéÿ ý×ÉÛ©░Û│ÁÙ¬àÝÿêÛ┤Çý┤¼ýÿüýØä ýØ┤ýÜ®Ýòÿýù¼ Ù¬®ýùÉýä£ÙÂÇÝä░ ÙîÇÝç┤Û│¿ Û▓¢ÙÂÇÛ╣îýºÇýØÿ ýÿüýâüýØä ýû╗ÙèöÙïñ. ÛÀ╝ý£äÙÂÇ Ù┤ëýØ© ÙÂÇý£äÙÑ╝ ÝÖòÙ│┤ÝòÿÛ©░ ý£äÝò┤ ýóîýçäÛ│¿ÝòÿÙÅÖÙºÑýØä ÙºëýØä ÝòäýÜöÛ░Ç ý×êÙèö Û▓¢ýÜ░ýùÉÙèö ÙçîÝÿêÛ┤ÇýØ┤Ùéÿ ý▓ÖýÂöÙÅÖÙºÑýØÿ Ýÿæý░®ýØ┤Ùéÿ ÝÅÉýçä ýù¼ÙÂÇÙÑ╝ ýòîýòäÙ│┤Û©░ ý£äÝò┤ ýÂöÛ░Çýáüý£╝Ùí£ ÙæÉÛ▓¢ÙÂÇ ýáäýé░ÝÖöÙï¿ý©ÁÝÿêÛ┤Çý┤¼ýÿüýØ┤ ÝòäýÜöÝòÿÙïñ. Û▓¢ýÜ░ýùÉ Ùö░ÙØ╝ ýØ┤Ùƒ¼Ýò£ ýÿüýâüýØä Û©░Ù░ÿý£╝Ùí£ 3ý░¿ýøÉ ýÿüýâüýØ┤Ùéÿ ÛÁ¢ýû┤ýºä ÝÿêÛ┤ÇýØä ÝÄ╝ý╣¿ý£╝Ùí£ýì¿ ýáòÝÖòÝò£ Ýò┤ÙÂÇÝòÖýáü ý£äý╣ÿ Ýÿ╣ýØÇ Û©©ýØ┤ÙÑ╝ ÝÅëÛ░ÇÝòá ýêÿ ý×êÙèö ÝöäÙí£ÛÀ©Ù׿ýØ┤ ÝòäýÜöÝòá ýêÿ ý×êÙïñ(ýÿê, TeraRecan). ýØ┤Ùƒ¼Ýò£ ÝöäÙí£ÛÀ©Ù׿ýØä ÝåÁÝò┤ ÙîÇÙÅÖÙºÑÛ│╝ Û░ü ÙÂäýºÇÝÿêÛ┤ÇýØÿ ýáòÝÖòÝò£ Ýü¼Û©░ Ù░Å ý£äý╣ÿÙÑ╝ ÝîîýòàÝòá ýêÿ ý×êÛ│á, ýèñÝàÉÝè© ÛÀ©ÙØ╝ÝöäÝè©ýØÿ ýºüÛ▓¢Û│╝ Û©©ýØ┤ÙÑ╝ ýáòÝòá Ùòî ýñæýÜöÝò£ ýáòÙ│┤ÙÑ╝ ýû╗ýØä ýêÿ ý×êÙïñ. ýáäýé░ÝÖöÙï¿ý©ÁÝÿêÛ┤Çý┤¼ýÿüýØÇ ÙîÇÙÅÖÙºÑÙ┐ÉÙºî ýòäÙïêÙØ╝ ý×ÑÛ│¿ÙÅÖÙºÑ Ù░Å ÙîÇÝç┤ÙÅÖÙºÑÛ╣îýºÇ ÝżÝò¿Ýòÿýù¼ ý░ìýû┤ýò╝ ÝòÿÙèöÙì░ ýØ┤Ùèö ýï£ýêáÝòá Ùòî ýáæÛÀ╝ ÝÿêÛ┤ÇýùÉ ÙîÇÝò£ ýáòÙ│┤ÙÑ╝ ýû╗Ùèö Û▓âýØ┤ ýñæýÜöÝòÿÛ©░ ÙòîÙ¼©ýØ┤Ùïñ.
ýáæÛÀ╝ÝÿêÛ┤Ç ÝÅëÛ░Ç
ýØ╝Ù░ÿýáüý£╝Ùí£ ýûæý¬¢ ÙîÇÝç┤ÙÅÖÙºÑýØä ýØ┤ýÜ®Ýòÿýù¼ ýï£ýêáÝòÿÛ▓î ÙÉÿÙèöÙì░ Ýò£ ý¬¢ýØÇ ýèñÝàÉÝè© ÛÀ©ÙØ╝ÝöäÝè© ýáäÙï¼ýï£ýèñÝà£, ÙïñÙÑ© Ýò£ý¬¢ýØÇ ýºäÙï¿ýÜ® ý╣┤ÝàîÝä░ÙÑ╝ ÙäúÛ©░ ý£äÝò┤ ýé¼ýÜ®ÙÉ£Ùïñ. ÙîÇÝç┤ÙÅÖÙºÑ, ý×ÑÛ│¿ÙÅÖÙºÑýØÿ Ýü¼Û©░, ÙÅÖÙºÑÛ▓¢ÝÖöýªØýØÿ ýáòÙÅä, ÝÿêÛ┤ÇýØÿ ÛÁ┤Û│íýä▒ Ùô▒ýØä ýÿüýâüýØä ýØ┤ýÜ®Ýòÿýù¼ ýé¼ýáäýùÉ ÝÅëÛ░ÇÝò£ Ýøä Û▓░ýáòÝòÿÛ▓î ÙÉ£Ùïñ. ÙîÇÛ░£ Ýü¼Û©░Û░Ç Ýü¼Ù®┤ýä£ ýäØÝÜîÝÖöÛ░Ç ýáüÛ│á ÛÁ┤Û│íýØ┤ ýáüýØÇ ÝÿêÛ┤ÇýØä Ùö░ÙØ╝ ýèñÝàÉÝè© ÛÀ©ÙØ╝ÝöäÝè©ÙÑ╝ ÙäúÛ▓î ÙÉ£Ùïñ. ÝÿêÛ┤ÇýØÿ ýºüÛ▓¢ýØ┤ ý®ÙÂäÝòÿÛ│á ýäØÝÜîÝÖöÛ░Ç ýùåÙïñÙ®┤ ÝÿêÛ┤ÇýáêÛ░£(cut-down) ýùåýØ┤ ÝÿêÛ┤ÇýºÇÝÿêÛ©░ÛÁ¼(preclose technique)ÙÑ╝ ýØ┤ýÜ®Ýòÿýù¼ ýï£ýêáýØä Ýòá ýêÿ ý×êÙïñ[6]. Ùºîýò¢ ýûæý¬¢ ÙîÇÝç┤ÙÅÖÙºÑýØÿ Ýü¼Û©░Û░Ç ý®ÙÂäý╣ÿ ýòèÙïñÙ®┤ ýØ©ýí░ÝÿêÛ┤ÇýØä ýØ┤ýÜ®Ýò£ ýÜ░ÝÜîÝÿêÛ┤ÇýØä ÙºîÙôñýû┤ ýï£ýêáÝòá ýêÿ ý×êÙïñ. ýï¼Ýò£ ýäØÝÜîÝÖöÙÑ╝ ÙÅÖÙ░ÿÝò£ Ýÿæý░®ýØ┤ ý×êÙèö Û▓¢ýÜ░ ýï£ýêáýØ┤ ÙÂêÛ░ÇÙèÑÝòá ýêÿ ý×êÛ│á Ù¼┤Ùª¼Ýòá Û▓¢ýÜ░ ÝÿêÛ┤Ç ý▓£Û│ÁýØÿ Û░ÇÙèÑýä▒ýØ┤ ý×êýû┤ ýú╝ýØÿÝò┤ýò╝ Ýò£Ùïñ.
Ù┤ëýØ©ÙÂÇý£ä Û©©ýØ┤
ÛÀ╝ý£äÙÂÇ, ýøÉý£äÙÂÇ Ù┤ëýØ©ÙÂÇý£äÛ░Ç ýáüýáêÝò£ýºÇÙÑ╝ ÝÅëÛ░ÇÝòÿÙèö Û▓âýØ┤ ýï£ýêáýØÿ ýä▒Ýî¿ÙÑ╝ ýóîýÜ░Ýò£Ùïñ. ÛÀ╝ý£äÙÂÇ Ù┤ëýØ©ÙÂÇý£äÙèö ýóîýçäÛ│¿ÝòÿÙÅÖÙºÑ ÙüØýùÉýä£ ÝØëÙÂÇÙîÇÙÅÖÙºÑÝÖòý×ÑýªØýØÿ ýï£ý×æýáÉýØ┤ ÙÉ£Ùïñ. ýØ┤ Û©©ýØ┤Û░Ç 15 mm ýØ┤ÝòÿÙØ╝Ù®┤ ýóîýçäÛ│¿ÝòÿÙÅÖÙºÑýØä Ùäÿýû┤ýä£ ýï£ýêáÝòá ýêÿÙÅä ý×êÙïñ. ýØ┤Ùòî ýóîýçäÛ│¿ÝòÿÙÅÖÙºÑýØä ý×¼Û┤ÇÙÑÿÝòá Û▓âýØ©Û░ÇýùÉ ÙîÇÝò┤ýä£Ùèö ýòäýºü Ùà╝Ù×ÇýØ┤ ÙºÄý£╝Ùéÿ[7] ýû┤ý®ö ýêÿ ýùåýØ┤ ýóîýçäÛ│¿ÝòÿÙÅÖÙºÑýØä Ùºëýòäýò╝ Ýò£ÙïñÙ®┤ ýú╝ýÜö ýïáÛ▓¢ÝòÖýáü Ýò®Ù│æýªØýØä ýÿêÙ░®ÝòÿÛ©░ ý£äÝò┤ ÙæÉÛ▓¢ÙÂÇ ÝÿêÛ┤ÇýùÉ ÙîÇÝò£ ý®ÙÂäÝò£ Û▓Çýé¼ÙÑ╝ ýï£ÝûëÝòÿýù¼ýò╝ Ýò£Ùïñ. ýØ╝Ù░ÿýáüý£╝Ùí£ ÙçîÝÿêÛ┤ÇýØÿ ÝøäÙ░®ýê£ÝÖÿýØ┤ ý®ÙÂäÝòÿýºÇ ýòèýØÇ Û▓¢ýÜ░, ýÖ╝ý¬¢ ý▓ÖýÂöÙÅÖÙºÑýØ┤ Ýü░ Û▓¢ýÜ░, ýÿñÙÑ©ý¬¢ ý▓ÖýÂöÙÅÖÙºÑýùÉ Ýÿæý░®ýØ┤ ý×êÛ▒░Ùéÿ ÙºëÝÿÇ ý×êÙèö Û▓¢ýÜ░, ýáäýùÉ Ùé┤ÝØëÙÅÖÙºÑýØä ýØ┤ýÜ®Ýòÿýù¼ Û┤ÇÙÅÖÙºÑýÜ░ÝÜîýêáýØä Ýò£ Û▓¢ýÜ░, ýÜ░ýçäÛ│¿ÝòÿÙÅÖÙºÑýØ┤ ýäáý▓£ýáüý£╝Ùí£ ý×æýØÇ Û▓¢ýÜ░ ýï£ýêá ýáä ý×¼Û┤ÇÙÑÿÙÑ╝ Ýò┤ýú╝Ùèö Û▓âýØ┤ ýóïÙïñÛ│á ýòîÙáñýá© ý×êÙïñ. ÙÿÉÝò£ Û©┤ ýèñÝàÉÝè© ÛÀ©ÙØ╝ÝöäÝè© ýï£ýêáýØä Û│äÝÜìÝòÿÙèö Û▓¢ýÜ░ ÝùêÝÿêýä▒ ý▓Öýêÿ ýåÉýâüýØÿ Û░ÇÙèÑýä▒ýØ┤ ÙåÆý£╝Ù»ÇÙí£ ý×¼Û┤ÇÙÑÿÙÑ╝ Ýò┤ýú╝Ùèö Û▓âýØ┤ ýóïýØÇÙì░ Ýè╣Ý×ê ýáäýùÉ Ù│ÁÙÂÇÙîÇÙÅÖÙºÑ ýêÿýêáýØä Ù░øýØÇ Û▓¢ýÜ░ ý©íÙÂÇ ÝÿêÙÑÿÛ░Ç Û░ÉýåîÙÉÿýû┤ ý×êý£╝Ù»ÇÙí£ ý×¼Û┤ÇÙÑÿÙÑ╝ Ýò┤ýú╝Ùèö Û▓âýØ┤ ýóïÙïñ. ýøÉý£äÙÂÇ Ù┤ëýØ©ÙÂÇý£äýØÿ Û©©ýØ┤Ùèö ÝØëÙÂÇÙîÇÙÅÖÙºÑÝÖòý×ÑýªØýØÿ ÙüØýùÉýä£ÙÂÇÝä░ Ù│ÁÛ░òÙÅÖÙºÑ(celiac artery)Û╣îýºÇýØ┤Ùïñ. Ù│ÁÛ░òÙÅÖÙºÑ ýù¡ýï£ ÝòäýÜöýùÉ Ùö░ÙØ╝ ÙºëýØä ýêÿÙèö ý×êýºÇÙºî ýØ┤ ýù¡ýï£ ýï£ýêá ýáä ý©íÙÂÇ ÝÿêÙÑÿÛ░Ç ý®ÙÂäÝò£ýºÇ ÝÖòýØ©ÝòÿÙèö Û▓âýØ┤ ýñæýÜöÝòÿÙïñ. ýâüý×ÑÛ░äÙÅÖÙºÑ(superior mesenteric artery)ýùÉ Ýÿæý░®ýØ┤ ýùåÙèö Û▓¢ýÜ░ Ù│ÁÛ░òÙÅÖÙºÑýØ┤ ÙºëÝÿÇÙÅä Ù│ä Ù¼©ýá£Û░Ç ýùåÙèö Û▓âý£╝Ùí£ Ù│┤Û│áÙÉÿÛ│á ý×êÙïñ[8].
ýèñÝàÉÝè© ÛÀ©ÙØ╝ÝöäÝè©ýØÿ ýºüÛ▓¢
ÝÿêÛ┤ÇÙ▓¢Û│╝ýØÿ Ù░Çý░®ÙáÑýØä Û░òÝÖöýï£ÝéñÛ©░ ý£äÝò┤ ÝÿêÛ┤Ç ýºüÛ▓¢Ù│┤Ùïñ 10-15% ýØ┤ýâü Ýü░ ýèñÝàÉÝè© ÛÀ©ÙØ╝ÝöäÝè©ÙÑ╝ ýäáÝâØÝòÿÛ▓î ÙÉ£Ùïñ[9]. Û░ÇÙèÑÝòÿÙïñÙ®┤ ýêÿýÂòÛ©░ Ùòî ÙîÇÙÅÖÙºÑýØÿ ýÖ©Û▓¢ýØä Û©░ýñÇý£╝Ùí£ ýèñÝàÉÝè© ÛÀ©ÙØ╝ÝöäÝè©ÙÑ╝ ýäáÝâØÝò£Ùïñ. Ù┤ëýØ©ÙÂÇý£äýØÿ ÙÅÖÙºÑ Ù¬¿ýûæýØ┤ ýøÉÝÿòýØ┤ ýòäÙïêÙØ╝Ù®┤ ý×ÑÛ▓¢Û│╝ Ùï¿Û▓¢ýØÿ ÝÅëÛÀáýØä ÛÁ¼Ýò£ Ýøä ýØ┤ÙÑ╝ Û©░ýñÇý£╝Ùí£ ýäáÝâØÝòÿÛ▓î ÙÉ£Ùïñ. Ýÿäý×¼ Û░ÇýÜ®Ýò£ ýèñÝàÉÝè© ÛÀ©ÙØ╝ÝöäÝè©ýØÿ ýÁ£ÙîÇ ýºüÛ▓¢ýØ┤ 46 mmýØ┤Ù»ÇÙí£ Ù┤ëýØ©ÙÂÇý£äýØÿ ýºüÛ▓¢ýØ┤ 40-42 mm ýØ┤ÝòÿýØ© ÝÿêÛ┤ÇýùÉýä£ ýáòÝòÿÙèö Û▓âýØ┤ ýóïÙïñ. ÛÀ╝ý£äÙÂÇ Ù┤ëýØ©ÙÂÇý£äýÖÇ ýøÉý£äÙÂÇ Ù┤ëýØ©ÙÂÇý£äýØÿ ýºüÛ▓¢ýØ┤ ý░¿ýØ┤Û░Ç ýï¼Ýòá Û▓¢ýÜ░ ÛÀ╝ý£äÙÂÇýÖÇ ýøÉý£äÙÂÇýØÿ ýºüÛ▓¢ýØ┤ ÙïñÙÑ© ýºüÛ▓¢Û░ÉýåîÝÿò ýèñÝàÉÝè© ÛÀ©ÙØ╝ÝöäÝè©ÙÑ╝ ýé¼ýÜ®Ýòá ýêÿ ý×êÙïñ.
ýèñÝàÉÝè© ÛÀ©ÙØ╝ÝöäÝè©ýØÿ Û©©ýØ┤
ÙîÇÙÂÇÙÂäýØÿ ýá£ýí░ÝÜîýé¼ÙôñýØÇ Û░ü ýá£ÝÆêÙ│äÙí£ Ýæ£ýñÇÝÖöÙÉ£ Û©©ýØ┤ýØÿ ýèñÝàÉÝè© ÛÀ©ÙØ╝ÝöäÝè©ÙÑ╝ Û░ÇýºÇÛ│á ý×êÛ│á ýÿüýâüýØä ÝåÁÝò┤ ý╣ÿÙúîÝòá ÝØëÙÂÇÙîÇÙÅÖÙºÑÝÖòý×ÑýªØýØÿ Û©©ýØ┤ÙÑ╝ ý©íýáòÝò£ Ýøä ýØ┤ýùÉ Ùº×Ùèö ýèñÝàÉÝè© ÛÀ©ÙØ╝ÝöäÝè©ÙÑ╝ Û│áÙÑ┤Û▓î ÙÉ£Ùïñ.
ýèñÝàÉÝè© ÛÀ©ÙØ╝ÝöäÝè© Ýü¼Û©░ Ù░Å Ýò┤ÙÂÇÝòÖýáü ýÜöÛÁ¼ ýí░Û▒┤
ÙîÇÙÅÖÙºÑÝÖòý×ÑýªØýØä ÝÖòýïñÝòÿÛ▓î ý╣ÿÙúîÝòÿÛ©░ ý£äÝò┤ ýáòýâü ÙîÇÙÅÖÙºÑ Ùé┤ýùÉ ý®ÙÂäÝò£ Ù┤ëýØ©ÙÂÇý£äÙÑ╝ ÝÖòÙ│┤ÝòÿÙèö Û▓âýØÇ ýñæýÜöÝòÿÙïñ. ÙÿÉÝò£ ýáäÙï¼ýï£ýèñÝà£ýØ┤ ÙîÇÛ░£ 20F ýØ┤ýâü ýºüÛ▓¢ýØ┤ Ýü¼Û©░ ÙòîÙ¼©ýùÉ ý®ÙÂäÝò£ ýáæÛÀ╝ÝÿêÛ┤ÇýØä ÝÖòÙ│┤ÝòÿÙèö Û▓âÙÅä ýñæýÜöÝòÿÙïñ. ýØ┤Ùƒ¼Ýò£ Û▓âÙôñýØÇ ýÿüýâüýØä ý×ÿ ÙÂäýäØÝò¿ý£╝Ùí£ýì¿ ýû╗ýØä ýêÿ ý×êÙïñ. Û░ü ÝÜîýé¼Ù│ä ýá£ÝÆêÙºêÙïñ ýÜöÛÁ¼ÙÉÿÙèö Û©░ýñÇýØ┤ ÙïñÙÑ┤Û©░ ÙòîÙ¼©ýùÉ Û░ü ýá£ÝÆêýØÿ Ýè╣ýºòýØä ýêÖýºÇÝòá ÝòäýÜöÛ░Ç ý×êÙïñ.
ÙîÇÙÅÖÙºÑÛÂüýØä ý╣¿Ù▓öÝòÿÙèö ÝØëÙÂÇÙîÇÙÅÖÙºÑÝÖòý×ÑýªØ
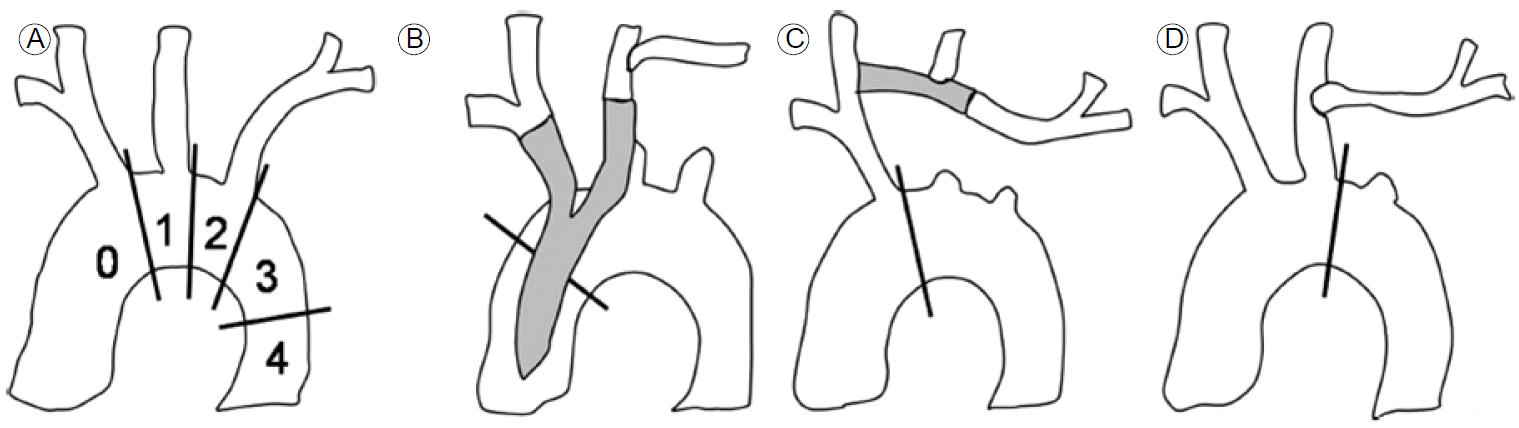
Û▓¢ýÜ░ýùÉ Ùö░ÙØ╝ýä£ ÛÀ╝ý£äÙÂÇ Ù┤ëýØ©ÙÂÇý£äýØÿ Û©©ýØ┤Û░Ç ý®ÙÂäÝòÿýºÇ ýòèýØä Û▓¢ýÜ░ ýóîýçäÛ│¿ÝòÿÙÅÖÙºÑýØä Ùäÿýû┤ýä£ ýèñÝàÉÝè© ÛÀ©ÙØ╝ÝöäÝè©ÙÑ╝ ýï£ýêáÝòá ýêÿÙÅä ý×êÙèöÙì░ ýØ┤Ùòî ýú╝ýÜö ÙÂäýºÇÝÿêÛ┤ÇýØÿ ýÜ░ÝÜîýêáýØ┤ ÝòäýÜöÝòá ýêÿÙÅä ý×êÙïñ(Fig. 2). Ishimaru [10]Ùèö ÛÀ╝ý£äÙÂÇ Ù┤ëýØ©ÙÂÇý£äýØÿ ý£äý╣ÿýùÉ Ùö░ÙØ╝ 5Û░£ýØÿ ÛÁ¼ýù¡ý£╝Ùí£ ÙéÿÙêá ÛÁ¼ÙÂäÝòÿýÿÇÙïñ(Fig. 2A).
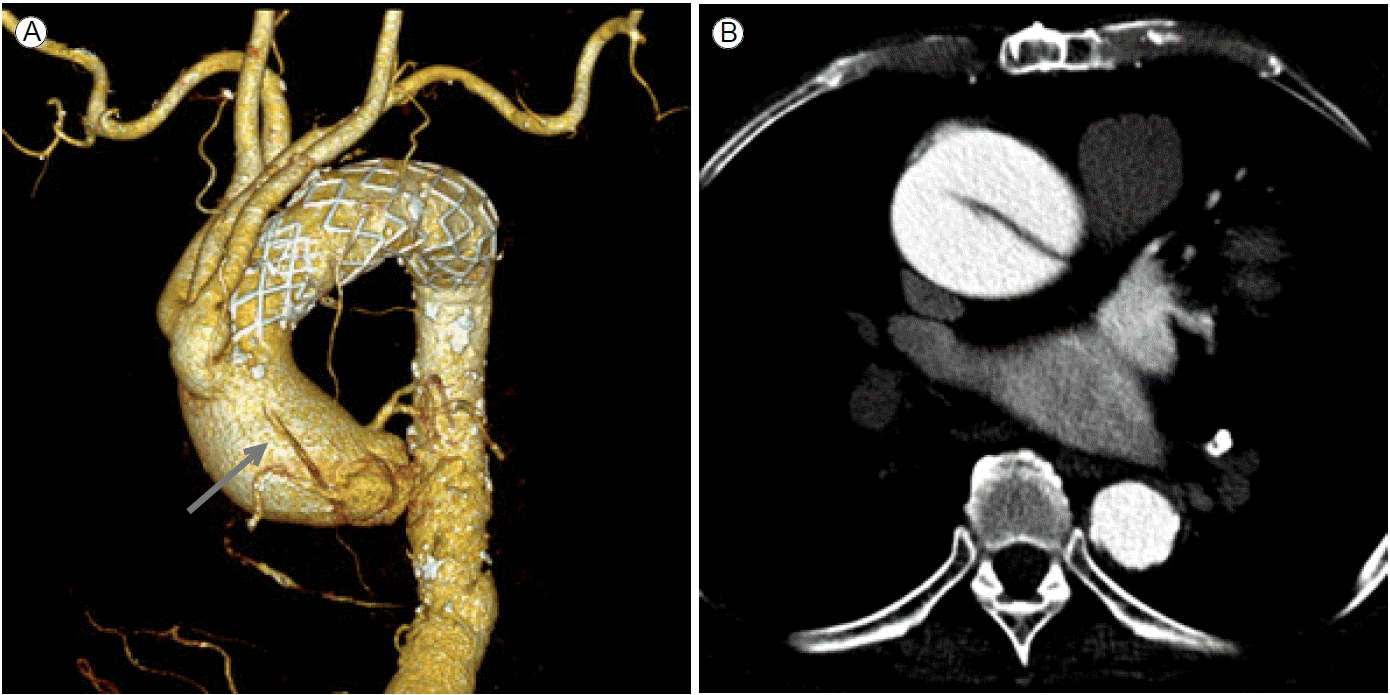
Ùºîýò¢ zone 0/1ýùÉ ýèñÝàÉÝè© ÛÀ©ÙØ╝ÝöäÝè©ÙÑ╝ ýï£ýêáÝò£ÙïñÙ®┤ ýï£ýêá ýáä ýÖäÙæÉÙÅÖÙºÑýØ┤Ùéÿ ýóîý┤ØÛ▓¢ÙÅÖÙºÑýØä ýóÇ Ùìö ÛÀ╝ý£äÙÂÇ ý¬¢ý£╝Ùí£ ýÜ░ÝÜîýêáÝòÿýù¼ ÛÀ╝ý£äÙÂÇ Ù┤ëýØ©ÙÂÇý£äÙÑ╝ ý®ÙÂäÝ×ê ÝÖòÙ│┤Ýò£ Ýøä ýèñÝàÉÝè© ÛÀ©ÙØ╝ÝöäÝè©ÙÑ╝ ýï£ýêáÝòÿÛ▓î ÙÉ£Ùïñ(Fig. 3). ýÜ░ÝÜîýêá ýùåýØ┤ ýóîýçäÛ│¿ÝòÿÙÅÖÙºÑýØä ÙºëÙèö Û▓âýùÉ ÙîÇÝò┤ýä£Ùèö ýòäýºü Ùà╝Ù×ÇýØ┤ ýù¼ýºÇÛ░Ç ý×êÙèöÙì░ ýØ╝Ù░ÿýáüý£╝Ùí£ ýï£ýêá ýáä ÙæÉÛ▓¢ÙÂÇ ÝÿêÛ┤ÇÙôñýØä ý®ÙÂäÝ×ê Û▓Çýé¼Ýò£ Ýøä ý×¼Û┤ÇÙÑÿ ýù¼ÙÂÇÙÑ╝ Û▓░ýáòÝòÿÛ▓î ÙÉ£Ùïñ. ýêÿýêáýáü Ù░®Ù▓òýØÇ ÙïñýûæÝòÿÙïñ.
Ýò®Ù│æýªØ
1. ÝØëÙÂÇÙîÇÙÅÖÙºÑ Ù│æÙ│ÇýùÉ ÙîÇÝò£ ýñæý×¼ýáü ý╣ÿÙúîýÖÇ Û┤ÇÙá¿ÙÉ£ ýé¼ÙºØÙÑáýØÇ 5-6% ýáòÙÅä Ù│┤Û│áÙÉÿÛ│á ý×êÙèöÙì░[1,11] ýØ┤Ùèö ÙîÇÙÅÖÙºÑ ýºêÝÖÿýùÉ Ùö░ÙØ╝ ÙïñýûæÝòÿÛ▓î ÙéÿÝâÇÙé£Ùïñ. Ýîîýù┤ÙÉÿýºÇ ýòèýØÇ ÝØëÙÂÇ ÙîÇÙÅÖÙºÑÝÖòý×ÑýªØýØÿ ýñæý×¼ýáü ýï£ýêáýØÿ Ùï¿Û©░(30ýØ╝ ýØ┤Ùé┤) ýé¼ÙºØÙÑáýØÇ 2%ýØ© Ù░ÿÙ®┤ Ýîîýù┤ÙÉ£ ÝØëÙÂÇ ÙîÇÙÅÖÙºÑÝÖòý×ÑýªØýØÿ ý╣ÿÙúî Ùï¿Û©░ ýé¼ÙºØÙÑáýØÇ 23%ýùÉ ýØ┤ÙÑ©Ùïñ[12]. ýÂöýáü Û©░Û░äýùÉ Ùö░ÙØ╝ýä£ÙÅä ÙïñÙÑ┤Û▓î ÙéÿÝâÇÙéÿÙèöÙì░ 1, 2, 3Ùàä ýé¼ÙºØÙÑáýØ┤ Û░üÛ░ü 5.8, 16, 28%Ùí£ Ù│┤Û│áÙÉÿÛ│á ý×êÙïñ[1]. ýêÿýêáýáü ý╣ÿÙúîýùÉ Ù╣äÝò┤ ýñæý×¼ýáü ýï£ýêáýØ┤ Ùï¿Û©░ ýé¼ÙºØÙÑáýØä Û░Éýåîýï£ÝéñÛ©░Ùèö Ýûêý£╝Ùéÿ ýØ┤Ùƒ¼Ýò£ ÝÜ¿Û│╝Ùèö 1ÙàäýØ┤ ýºÇÙéÿÙ®┤ýä£ ýâüýçäÙÉÿÙèö Û▓âý£╝Ùí£ ýòîÙáñýá© ý×êÙïñ[13].
2. ÙîÇÙÅÖÙºÑ ýêÿýêá Ýøä ýâØÛ©░Ùèö ýïáÛ▓¢ÝòÖýáü Ýò®Ù│æýªØýØÇ ý╣ÿÙ¬àýáüý£╝Ùí£ ÝÖÿý×ÉýØÿ ýé¼ÙºØ, ýºêÝÖÿ, ýéÂýØÿ ýºêÛ│╝ Ù░ÇýáæÝò£ ýù░Û┤ÇýØ┤ ý×êÙïñ. ýñæý×¼ýáü ýï£ýêá Ýøä ýâØÛ©░Ùèö ÙçîÝÿêÛ┤Ç ýºêÝÖÿýØÇ 3-5%Ùí£ ýØ╝Ù░ÿýáüýØ© ýï¼ý×ÑýêÿýêáýØÿ ÛÀ©Û▓âÙÅä Ù╣äýèÀÝòÿÙïñ[1,4]. ÙîÇÙÅÖÙºÑ ýñæý×¼ýáü ýï£ýêáýØ┤ ýï¼ÝÅÉýÜ░ÝÜîÙÑ╝ Ýö╝ÝòÿÛ│á ÙçîÝÿêÛ┤ÇýØÿ ÝùêÝÿêÛ│╝ Ù»©ýä©ÝÿêýáäýâëýáäýªØýØä ýñäýØ┤Û©░Ùèö Ýûêý£╝Ùéÿ ýù¼ýáäÝ×ê ÙåÆýØÇ ýêÿý╣ÿýØ┤Ùïñ. ýñæý×¼ýêáÛ│╝ Û┤ÇÙá¿ÙÉ£ ÙçîÝÿêÛ┤Ç ýºêÝÖÿýØÿ ÙîÇÙÂÇÙÂäýØÇ ýâëýáäýªØýùÉ ýØÿÝò£ Û▓âý£╝Ùí£ ýú╝Ùí£ ýï£ýêáÝòá Ùòî ýé¼ýÜ®ÝòÿÙèö ý▓áýäáýØ┤Ùéÿ ýèñÝàÉÝè© ÛÀ©ÙØ╝ÝöäÝè©ýØÿ ýí░ý×æÛ│╝ýáòýùÉýä£ Ù░£ýâØÝò£Ùïñ. ÝûÑÝøäýùÉÙèö ýØ┤Ùƒ¼Ýò£ Û©░ÛÁ¼ÙôñýØ┤ Ù│æýØ┤ ý×êÙèö ÙîÇÙÅÖÙºÑÛ│╝ ýáæý┤ëýØä ýÁ£ýåîÝÖöÝòÿÙèö Ù░®Ù▓òý£╝Ùí£ ýáæÛÀ╝ÝòÿÛ▒░Ùéÿ ýèñÝàÉÝè© ÛÀ©ÙØ╝ÛÀ©ÙØ╝Ýöä ýäñý╣ÿÝòá Ùòî ýØ╝ýï£ýáüý£╝Ùí£ ÙçîÝÿêÛ┤ÇýØä Û░ÇÙèö ÙÅÖÙºÑýØä ý░¿Ùï¿ÝòÿÙèö Ù░®Ù▓ò Ýÿ╣ýØÇ ÝòäÝä░ Ùô▒ýØä ýØ┤ýÜ®Ýòÿýù¼ ÝÿêýáäýØ┤ ÙéáÙØ╝Û░ÇÙèö Û▓âýØä Ù░®ýºÇÝòÿÙèö ýï£ýêáÙ▓òÙôñýØ┤ ÙÅäýøÇýØ┤ ÙÉá Û▓âý£╝Ùí£ Ù│┤ýØ©Ùïñ.
3. ýñæý×¼ýáü ýï£ýêáÛ│╝ Û┤ÇÙá¿ÙÉ£ ý▓ÖýêÿýåÉýâüýØÇ Û│╝Û▒░ýØÿ 5-7%Ù│┤Ùïñ ýñäýû┤ ýÁ£ÛÀ╝ýùÉÙèö 2-3% ýáòÙÅä Ù│┤Û│áÙÉÿÛ│á ý×êÙïñ[14]. Û░Çý×Ñ ýñæýÜöÝò£ ýÜöýåîÙèö ýñæý×¼ýáü ýï£ýêáÙí£ ýØ©Ýò┤ ý▓ÖýêÿÙí£ Û░ÇÙèö ÙÅÖÙºÑýØ┤ ýû╝ÙºêÙéÿ Û┤æÙ▓öý£äÝòÿÛ▓î ÙºëÝ×êÙâÉ ÝòÿÙèö Û▓âýØ┤Ùïñ. ý▓ÖýêÿÙí£ Û│ÁÛ©ëÙÉÿÙèö ÝÿêýòíýØÿ ÙîÇÙÂÇÙÂäýØÇ ý▓ÖýÂöÙÅÖÙºÑýùÉýä£ Û©░ýøÉÝòÿÙèö ýáäý▓ÖýêÿÙÅÖÙºÑÛ│╝ Ýøäý▓ÖýêÿÙÅÖÙºÑýØä ÝåÁÝò┤ Û│ÁÛ©ëÙÉ£Ùïñ. ýØ┤ÙôñýØ┤ ÝØëÙÂÇ, ýÜöýÂö, ý▓£Û│¿ÙÅÖÙºÑ ÛÀ©Ùª¼Û│á ÝòÿÙ│ÁÙÅÖÙºÑ(hypogastric artery)Û│╝ ýù░Û▓░ÙÉÿýû┤ ý▓ÖýêÿýùÉ ÝÿêýòíýØä Û│ÁÛ©ëÝòÿÛ▓î ÙÉ£Ùïñ. ýØ┤ÙáçÛ▓î Û▒░Ù»©ýñäý▓ÿÙƒ╝ ýù«ýù¼ ý×êÙèö ýí░ÛÀ©Ùºî ÝÿêÛ┤ÇÙôñýØ┤ ýñæý×¼ýáü ýï£ýêáÙí£ ýØ©Ýò┤ ýØ╝ÙÂÇ ÝÿêÛ┤ÇýØ┤ ÙºëÝ×êÛ▓î ÙÉÿÙ®┤ ÝÿêýòíýØÿ ÝØÉÙªäýØ┤ Ù│ÇÝòÿÙ®┤ýä£ ýï£ýêá Ýøä Ù®░ý╣á ÙÅÖýòê ýáüýØæÛ©░Û░äýØä Û▒░ý╣ÿÙ®┤ýä£ ý▓ÖýêÿýùÉ ÝÿêýòíýØä Û│ÁÛ©ëÝòÿÛ▓î ÙÉ£Ùïñ. ýØ╝Ù░ÿýáüý£╝Ùí£ ÝØëÙÂÇÙîÇÙÅÖÙºÑýùÉ ýèñÝàÉÝè© ÛÀ©ÙØ╝ÝöäÝè©ÙÑ╝ ýï£ýêáÝòÿÙèö Û▓¢ýÜ░ ýØ┤Ùƒ¼Ýò£ ÝÿêÛ┤ÇÙôñýØ┤ ýù░Û▓░ÙÉÿýû┤ ý×êýû┤ ýï£ýêáÙí£ ýØ©Ýò£ ý▓Öýêÿ ýåÉýâüýØ┤ ýâØÛ©░Ùèö Û▓¢ýÜ░Ùèö ÙºñýÜ░ Ùô£Ù¼╝Û│á ÙïñÙºî ýØ┤ýáäýùÉ ÙîÇÙÅÖÙºÑ ýêÿýêáýØä Ù░øýòÿÛ▒░Ùéÿ ÝÿêÛ┤ÇýØ┤ ýåÉýâüÙÉ£ Û▓¢ýÜ░, ÙÅÖÙºÑ Û▓¢ÝÖöýªØýØ┤ ýòäýú╝ ýï¼Ýò£ Û▓¢ýÜ░ ý▓Öýêÿ ýåÉýâüýØÿ Û░ÇÙèÑýä▒ýØÇ ý╗ñýºÇÛ▓î ÙÉ£Ùïñ. ÛÀ© ýÖ©ýØÿ ý£äÝùÿýØ©ý×ÉÙí£Ùèö ýï£ýêá ýñæ ÝÿêýòòýØ┤ Ùé«Û▓î ý£áýºÇÙÉÿÛ▒░Ùéÿ ýïáýåÉýâüýØ┤ ÙÅÖÙ░ÿÙÉ£ Û▓¢ýÜ░ýØ┤Ùïñ. ÙîÇÙÅÖÙºÑ ÝÖòý×ÑýªØýùÉýä£ ýñæý×¼ýáü ýï£ýêáýØÇ ýêÿýêáýáü ý╣ÿÙúîýùÉ Ù╣äÝò┤ ý▓ÖýêÿýåÉýâüý£╝Ùí£ ýØ©Ýò£ ÙºêÙ╣äýØÿ ý£äÝùÿýä▒ýØ┤ ýáüýØÇ ÝÄ©ýØ┤Ùïñ. ýØ┤Ùèö ýêÿýêáýáü ý╣ÿÙúî ýï£ ÙîÇÙÅÖÙºÑýØä ýØ╝ýï£ ý░¿Ùï¿(clamping)Ýò¿ý£╝Ùí£ýì¿ ý▓ÖýêÿýØÿ ÝùêÝÿêÛ│╝ ÙÂÇýóàýØä ý£áÙ░£ÝòÿÛ│á ý▓ÖýêÿÛ░òÙé┤ ýòòÙáÑýØä ýÿ¼Ùª¼Û©░ ÙòîÙ¼©ýØ┤Ùïñ. ý▓Öýêÿýòí Ù░░ýòíýØ┤ ýØ┤Ùƒ¼Ýò£ ý▓Öýêÿ ýåÉýâüýØä ýñäýØ╝ ýêÿ ý×êÙèö Ù░®Ù▓ò ýñæýØÿ ÝòÿÙéÿýØ┤Ùïñ. ýØ┤ýÖÇ ÙìöÙÂêýû┤ ÝÿêýòòýØä ýÿ¼Ùª¼Û│á ýï¼Ù░òý£كëýØä ýªØÛ░Çýï£ÝéñÙ®░ ýñæýï¼ýáòÙºÑýòòýØä Ùû¿ýû┤Ù£¿Ùª¼Û│á ýòäýÜ©Ùƒ¼ Ù╣êÝÿêÛ│╝ ýáÇýé░ýåîýªØýØä Û░ÖýØ┤ ÛÁÉýáòÝòÿÙèö Û▓âýØ┤ ýñæýÜöÝòÿÙïñ. ÙÿÉ ÝòÿÙéÿ Û░äÛ│╝Ýò┤ýä£ ýòêÙÉá ýáÉýØÇ ý▓Öýêÿýòí Ù░░ýòí ý×Éý▓┤Û░Ç ýâüÙï╣Ýò£ Ýò®Ù│æýªØýØ┤ ÙÅÖÙ░ÿÙÉá ýêÿ ý×êÙèö ýï£ýêáýØ┤ÙØ╝Ùèö ýáÉýØä Ýò¡ýâü ýù╝ÙæÉýùÉ ÙæÉÛ│á Û╝¡ ÝòäýÜöÝò£ Û▓¢ýÜ░ýùÉ ÝòÿÙèö Û▓âýØ┤ ýóïÙïñ. ÝØëÙÂÇ ÙîÇÙÅÖÙºÑÝÖòý×ÑýªØýØÿ ýñæý×¼ýáü ý╣ÿÙúîýùÉ ý×êýû┤ ÙÿÉ ÙïñÙÑ© Ùà╝ýáÉ ýñæýùÉ ÝòÿÙéÿÛ░Ç ýï£ýêá ýñæ ýóîýçäÛ│¿ÝòÿÙÅÖÙºÑýØÿ ÝÅÉýçäýùÉ Û┤ÇÝò£ Û▓âýØ┤Ùïñ. ýòäýºü ýªØÛ▒░Û░Ç ý®ÙÂäÝòÿýºÇ ýòèýºÇÙºî Ýÿäý×¼ýØÿ Ýæ£ýñÇ ý╣ÿÙúî ýºÇý╣¿ýØÇ ÙîÇÙÅÖÙºÑ ýèñÝàÉÝè© ÛÀ©ÙØ╝ÝöäÝè© ýï£ýêá ýáä ÝòäýÜöÝò£ Û▓¢ýÜ░ ýóîýçäÛ│¿ÝòÿÙÅÖÙºÑýØä ýÜ░ÝÜîýêáýØä ÝåÁÝò┤ ý×¼Û▒┤ÝòÿÙèö Û▓âýØ┤Ùïñ. ýù░ÛÁ¼ýùÉ Ùö░ÙØ╝ ÙïñÙÑ© Û▓░Û│╝ÙÑ╝ Ù│┤ýØ┤Û│á ý×êýºÇÙºî ýÁ£ÛÀ╝ Ù®öÝâÇÙÂäýäØ ý×ÉÙúîÙÑ╝ Ù│┤Ù®┤ ýÿêÙ░®ýáü ýóîýçäÛ│¿ÝòÿÙÅÖÙºÑ ýÜ░ÝÜîýêáýØä ÝòÿýºÇ ýòèÙèö Û▓¢ýÜ░ Ùçîýí©ýñæÛ│╝ ý▓Öýêÿ ýåÉýâüýØ┤ ÙåÆÙïñÙèö Ù│┤Û│áÛ░Ç ý×êýùêÙïñ. ýóîÙé┤ÝØëÙÅÖÙºÑýØä ýØ┤ýÜ®Ýò£ Û┤ÇÙÅÖÙºÑ ýÜ░ÝÜîýêáýØä Ù░øýòÿÛ▒░Ùéÿ ýóîý©íÝîöýØä ýØ┤ýÜ®Ýòÿýù¼ Ýÿêýòí Ýê¼ýäØýØä Ù░øÙèö Û▓¢ýÜ░, Û▓¢ÙÅÖÙºÑýØ┤Ùéÿ ý▓ÖýÂöÙÅÖÙºÑýùÉ ÙÅÖÙºÑÛ▓¢ÝÖöÙí£ ýØ©Ýò┤ Ýÿæý░®ýØ┤ ý×êÙèö Û▓¢ýÜ░ýùÉÙèö ýóîýçäÛ│¿ÝòÿÙÅÖÙºÑ ý×¼Û▒┤ýêáýØä Ýòá Û▓âýØä ÛÂîÛ│áÝòÿÛ│á ý×êÙïñ.
4. ÝÿêÛ┤Ç ýåÉýâü: Ýè╣Ý×ê ÝÿêÛ┤ÇýØÿ ÛÁ┤Û│íýØ┤ ýï¼ÝòÿÛ▒░Ùéÿ Û©░ýí┤ýØÿ Ýÿæý░® Ù│æÙ│ÇýØ┤ ý×êÙèö Û▓¢ýÜ░ýùÉÙèö Ýü░ ýºüÛ▓¢ýØÿ ÙÅäý×àÛ┤ÇýØ┤Ùéÿ ýèñÝàÉÝè© ÛÀ©ÙØ╝ÝöäÝè© ýáäÙï¼ýï£ýèñÝà£ýØÿ ýé¼ýÜ®ý£╝Ùí£ ýØ©Ýòÿýù¼ ÝÿêÛ┤ÇýØÿ Ù░òÙª¼ ÙÿÉÙèö Ýîîýù┤ Ùô▒ýØ┤ ÙéÿÝâÇÙéá ýêÿ ý×êÙïñ. ÛÀ© Ù░ûýùÉ Û░òýºüÝÿò Û░ÇýØ┤Ùô£ ýÖÇýØ┤ýû┤ýØÿ ý×ÿÙ¬╗ÙÉ£ ýé¼ýÜ®ý£╝Ùí£ ÙîÇÙÅÖÙºÑýØÿ ÙÂäýºÇÙí£ ýé¢ý×àÙÉ£ Û▓¢ýÜ░ýùÉÙèö ÝÿêÛ┤Ç ýåÉýâüý£╝Ùí£ ýØ©Ýò£ ýï¼Ýò£ Ýò®Ù│æýªØýØ┤ ÙéÿÝâÇÙéá ýêÿ ý×êÙïñ.
5. ýâëýáäýªØ: ýèñÝàÉÝè© ÛÀ©ÙØ╝ÝöäÝè©, Û░ÇýØ┤Ùô£ ýÖÇýØ┤ýû┤ ÙÿÉÙèö ÝÆìýäáÙÅäý×É Ùô▒ýØÿ ýé¼ýÜ®ý£╝Ùí£ ýØ©Ýòÿýù¼ ÙîÇÙÅÖÙºÑ Ùé┤ ÙÿÉÙèö ÙîÇÙÅÖÙºÑÝÖòý×ÑýªØ Ùé┤ ýí┤ý×¼ÝòÿÙèö ýú¢ýâüÛ▓¢ÝÖöÙ░ÿýØÿ ýØ╝ÙÂÇÙéÿ ÙÿÉÙèö ÝÿêýáäÙôñýØ┤ ýøÉý£äÙÂÇÙéÿ ÙîÇÙÅÖÙºÑ ÙÂäýºÇÙí£ ýâëýáäÙÉá ýêÿ ý×êÙïñ.
6. ÙîÇÙÅÖÙºÑÙÂäýºÇýØÿ ÝÅÉýçä: ýèñÝàÉÝè© ÛÀ©ÙØ╝ÝöäÝè©ýØÿ ýé¢ý×àý£╝Ùí£ ýØ©Ýòÿýù¼ ÙîÇÙÅÖÙºÑ ÙÂäýºÇýØÿ Û©░ýï£ÙÂÇÛ░Ç ÝÅÉýçäÙÉÿýû┤ ý×ÑÛ©░ýØÿ ÝùêÝÿêýØ┤ ÙéÿÝâÇÙéá ýêÿ ý×êÙïñ.
7. ýï£ýêá Ýøä ýªØÝøäÛÁ░(post-implant syndrome): ýØ╝Ù░ÿýáüý£╝Ùí£ 40Ôäâ ýØ┤ÝòÿýØÿ ýù┤ýØ┤Ùéÿ ý▓ÿýºÉ, Ùô▒ÝåÁýØ┤ ÙÅÖÙ░ÿÝòÿÙèö ýªØýâüý£╝Ùí£ ýï£ýêá Ýøä 10ýØ╝Û╣îýºÇ ýºÇýåìÙÉá ýêÿ ý×êÙïñ. Ù│┤Û│áýùÉ Ùö░ÙØ╝ýä£Ùèö 50% ýáòÙÅäÛ╣îýºÇ ÙéÿÝâÇÙé£ÙïñÛ│á Ýò£Ùïñ.
8. ÝÿêÛ┤Ç Ùé┤ Ùêäýêÿ(endoleak): ýï£ýêá Ýøä ýâØÛ©© ýêÿ ý×êÙèö ÝÿêÛ┤Ç Ùé┤ ÙêäýêÿÙèö ýú╝ýÜöÝò£ Ýò®Ù│æýªØ ýñæýØÿ ÝòÿÙéÿÙí£ ýóàÙÑÿýùÉ Ùö░ÙØ╝ ÝØëÙÂÇÙîÇÙÅÖÙºÑ ÝÖòý×ÑýªØýØÿ ýºäÝûëýØä ýûÁýá£ÝòÿÛ©░ ý£äÝò┤ ý╣ÿÙúîÛ░Ç ÝòäýÜöÝòÿÙïñ. 1Ýÿò ÝÿêÛ┤Ç Ùé┤ ÙêäýêÿÙèö ýèñÝàÉÝè© ÛÀ©ÙØ╝ÝöäÝè©Û░Ç Ù░Çý░®ÙÉÿÙèö Ù┤ëýØ© ÙÂÇý£äýùÉ Ù░£ýâØÝòÿÙèö Û▓âý£╝Ùí£ Ù░ÿÙô£ýï£ ý╣ÿÙúîÙÑ╝ ýÜöÝò£Ùïñ. 2Ýÿò ÝÿêÛ┤Ç Ùé┤ ÙêäýêÿÙèö ÝØëÙÂÇ ÙîÇÙÅÖÙºÑÝÖòý×ÑýªØÛ│╝ ýù░Û▓░ÙÉ£ ÙÂäýºÇ ÝÿêÛ┤ÇýØä ÝåÁÝò┤ ÝÿêÙÑÿÛ░Ç ýù¡ÙÑÿÝòÿýù¼ ÝÖòý×ÑýªØÙé┤Ùí£ Ùôñýû┤ýÿñÙèö Û▓âý£╝Ùí£ ýØ╝Ù░ÿýáüý£╝Ùí£ ý╣ÿÙúîÛ░Ç ÝòäýÜöý╣ÿ ýòèý£╝Ùéÿ ýÂöýáü Û▓Çýé¼ýùÉýä£ ýØ┤Ùí£ ýØ©Ýò┤ ÝÖòý×ÑýªØýØ┤ ý╗ñýºÇÙ®┤ ýÂöÛ░ÇýáüýØ© ý╣ÿÙúîÛ░Ç ÝòäýÜöÝòá ýêÿ ý×êÙïñ. 3Ýÿò ÝÿêÛ┤Ç Ùé┤ ÙêäýêÿÙèö Ù│æÙ│ÇýØ┤ Û©©ýû┤ 2Û░£ ýØ┤ýâüýØÿ ýèñÝàÉÝè© ÛÀ©ÙØ╝ÝöäÙÑ╝ ýï£ýêáÝòÿÙèö Û▓¢ýÜ░ ýä£Ùí£ Û▓╣ý╣ÿÙèö ÙÂÇý£äýùÉýä£ ÙêäýêÿÛ░Ç Ù░£ýâØÝòÿÙèö Û▓âý£╝Ùí£ ýØ┤ ÙÿÉÝò£ Ù░£ýâØ Ùï╣ýï£ ý╣ÿÙúîÛ░Ç ÝòäýÜöÝòÿÙïñ. 4Ýÿò ÝÿêÛ┤Ç Ùé┤ ÙêäýêÿÙèö ýèñÝàÉÝè© ÛÀ©ÙØ╝ÝöäÝè© ý×¼ýºê ý×Éý▓┤ýØÿ Ù¼©ýá£Ùí£ Ù░£ýâØÝòÿÙèö Û▓âý£╝Ùí£ ýØ╝Ù░ÿýáüý£╝Ùí£ ý╣ÿÙúîÛ░Ç ÝòäýÜöÝòÿýºÇ ýòèý£╝Ùéÿ ÝØëÙÂÇ ÙîÇÙÅÖÙºÑÝÖòý×ÑýªØýØ┤ ý╗ñýºÇÙèö ýûæýâüýØ┤Ù®┤ ý╣ÿÙúîÛ░Ç ýÂöÛ░ÇýáüýØ© ý╣ÿÙúîÛ░Ç ÝòäýÜöÝòá ýêÿ ý×êÙïñ. 5Ýÿò ÝÿêÛ┤Ç Ùé┤ ÙêäýêÿÙèö ÙÜ£ÙáÀÝò£ ÝÿêÛ┤Ç Ùé┤ ÙêäýêÿÛ░Ç Û┤Çý░░ÙÉÿýºÇ ýòèý£╝Ù®┤ýä£ ÝØëÙÂÇ ÙîÇÙÅÖÙºÑÝÖòý×ÑýªØýØ┤ ý╗ñýºÇÙèö Û▓¢ýÜ░ ýØÿýï¼Ýò┤Ù│╝ ýêÿ ý×êÙèöÙì░ ýØ┤Ùèö ýèñÝàÉÝè© ÛÀ©ÙØ╝ÝöäÝè© Ùé┤ ýòòÙáÑýØ┤ ÝØëÙÂÇ ÙîÇÙÅÖÙºÑÝÖòý×ÑýªØýùÉ ýáäÙï¼ÙÉÿÙ®┤ýä£ ý╗ñýºÇÙèö Û▓âý£╝Ùí£ ýâØÛ░üÝòÿÛ│á ý×êÙèöÙì░ ÝØëÙÂÇ ÙîÇÙÅÖÙºÑÝÖòý×ÑýªØýØ┤ ý╗ñýºÇÙèö ýûæýâüýØ┤Ù®┤ ýù¡ýï£ ýÂöÛ░ÇýáüýØ© ý╣ÿÙúîÛ░Ç ÝòäýÜöÝòÿÙïñ.
ýù¡Ýûëýáü ÙîÇÙÅÖÙºÑ AÝÿò Ù░òÙª¼ýªØ
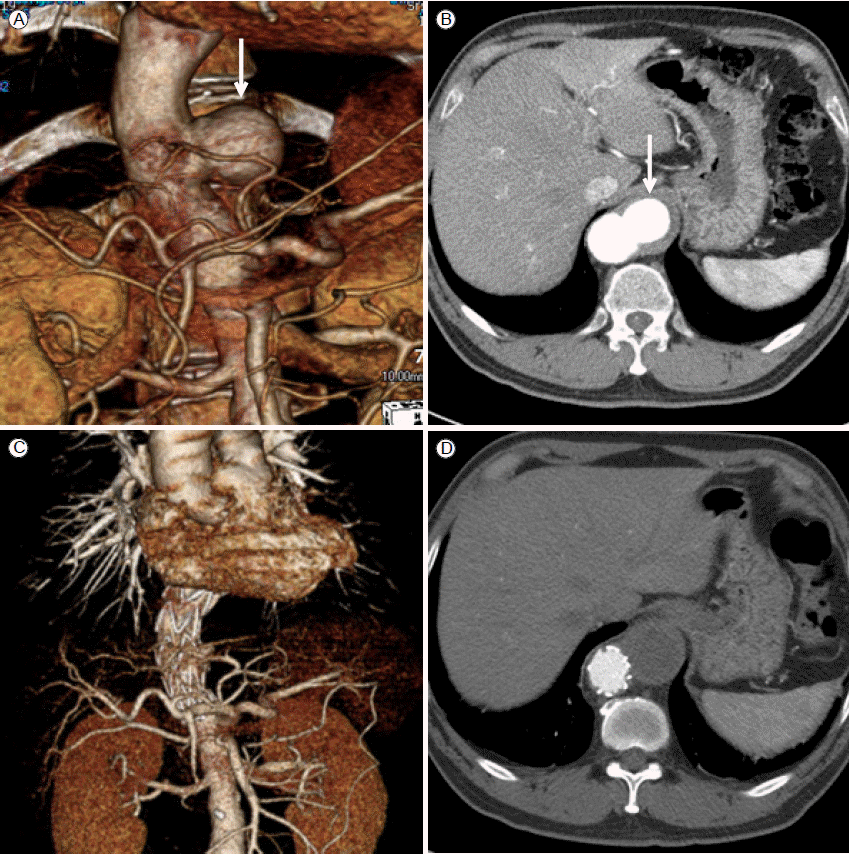
ÝØëÙÂÇ ÙîÇÙÅÖÙºÑÝÖòý×ÑýªØ ýñæý×¼ýáü ýï£ýêáýùÉ ý×êýû┤ Û░Çý×Ñ ý╣ÿÙ¬àýáüýØ© Ýò®Ù│æýªØý£╝Ùí£ 1.3-6.8%Ùí£ Ù│┤Û│áÙÉÿÛ│á ý×êÙïñ[15]. ÙîÇÛÀ£Ù¬¿ ýù░ÛÁ¼ Û▓░Û│╝ÙÑ╝ Ù│┤Ù®┤ Ù░£ýâØÝò£ 83%ýØÿ ÝÖÿý×ÉýùÉýä£ ýØ┤ýáäýùÉ ÙîÇÙÅÖÙºÑ Ù░òÙª¼ýªØýØÿ Ù│æÙáÑýØ┤ ý×êýùêÛ│á 30%ýùÉýä£ ýï£ýêá 3Û░£ýøö ýØ┤ÝøäýùÉ Ù░£ýâØÝò£ÙïñÛ│á ÝòÿýÿÇÙïñ[16]. ÛÀ© ýøÉýØ©ýùÉ ÙîÇÝò┤ýä£Ùèö ÙÜ£ÙáÀÝòÿÛ▓î ÛÀ£Ù¬àÙÉÿýºÇ ýòèýòÿýºÇÙºî ÙîÇÛ░£ ý▓áýäáýØ┤Ùéÿ ÙÅäÛ┤ÇýùÉ ýØÿÝò┤ Ù░£ýâØÝòÿÛ▒░Ùéÿ Ýÿ╣ýØÇ ýèñÝàÉÝè© ÛÀ©ÙØ╝ÝöäÝè©ýØÿ Ù╗úÙ╗úÝò¿, Ýü¼Û©░ýØÿ ý░¿ýØ┤ ÛÀ©Ùª¼Û│á ÛÀ╝ý£äÙÂÇýùÉ ýèñÝàÉÝè©Û░Ç Ùï¼Ùáñý×êÙèö ýèñÝàÉÝè© ÛÀ©ÙØ╝ÝöäÝè©ýùÉ ýØÿÝò┤ Ù░£ýâØÝòá ýêÿ ý×êÛ│á ýØ┤Ùƒ¼Ýò£ Û©░ÛÁ¼ÙôñÛ│╝ Ù¼┤Û┤ÇÝòÿÛ▓î ÙîÇÙÅÖÙºÑ ýºêÝÖÿýØÿ ýºäÝûëÝòÿÙ®┤ýä£ Ù░£ýâØÝòá ýêÿÙÅä ý×êÙïñ(Fig. 4).
Ýò┤Û▓░Ýò┤ýò╝ Ýòá Û│╝ýá£
ýáèýØÇ ÝÖÿý×ÉýùÉýä£ýØÿ ýñæý×¼ýáü ýï£ýêá
ýù¡ýé¼ýáüý£╝Ùí£ ýñæý×¼ýáü ý╣ÿÙúîÙèö ýêÿýêáýØÿ Û│áý£äÝùÿÛÁ░ýØ© Û│áÙá╣ýØÿ ÝÖÿý×ÉÙôñýØä ý£äÝò┤ ÙÅäý×àÙÉÿýû┤ Ù░£ýáäÙÉÿýû┤ ýÖöÙïñ. ÝòÿýºÇÙºî ýêÿýêáýØ┤ Û░ÇÙèÑÝò£ ýáèýØÇ ÝÖÿý×ÉÙôñÙÅä ýêÿýêáýùÉ Ù╣äÝò┤ Ùì£ ý╣¿ýèÁýáüýØ© ýñæý×¼ýáü ý╣ÿÙúîÙÑ╝ ýäáÝÿ©Ýò¿ý£╝Ùí£ýì¿ ýñæý×¼ýáü ý╣ÿÙúîýØÿ ýáüýØæýªØýùÉ ÙîÇÝò┤ ý×¼ýáòÙª¢Ýòá ÝòäýÜöÛ░Ç ý×êÙïñ. Û│áÙá╣ýØÿ ÝÖÿý×ÉýùÉ Ù╣äÝò┤ ýáèýØÇ ÝÖÿý×ÉÙôñýØÇ Ù┤ëýØ©ýºÇýù¡ýØÿ ÙîÇÙÅÖÙºÑýØÿ Ýü¼Û©░Û░Ç ý×æÛ│á ýáæÛÀ╝ÝÿêÛ┤ÇýØ┤ ý×æý£╝Ù®░ ÙîÇÙÅÖÙºÑÛÂüýØÿ ÛÁ┤Û│íýØ┤ ýï¼ÝòÿÙïñ. Ù│æÙ│ÇýØ┤ ýùåÙèö ýáòýâüÙîÇÙÅÖÙºÑýØÇ ýï£Û░äýØ┤ ýºÇÙéÿÙ®┤ýä£ ýáÉýáÉ ý╗ñýºÇÙèö Û▓âý£╝Ùí£ ýòîÙáñýá© ý×êÙèöÙì░ ýáèýØÇ ÝÖÿý×ÉÙôñýùÉýä£ ýèñÝàÉÝè© ÛÀ©ÙØ╝ÝöäÝè©ÙÑ╝ ýï£ýêáÝòÿÙèö Û▓¢ýÜ░ ýèñÝàÉÝè© ÛÀ©ÙØ╝ÝöäÝè©Û░Ç ý╗ñýºÇÙèö ÙîÇÙÅÖÙºÑýØä Ùö░ÙØ╝Û░ÇýºÇ Ù¬╗Ýò¿ý£╝Ùí£ýì¿ ýºÇýù░ÙÉ£ ÝÿêÛ┤Ç Ùé┤ ÙêäýêÿÛ░Ç ýâØÛ©© Û░ÇÙèÑýä▒ýØ┤ ÙåÆÙïñ. ÙÿÉ ÙïñÙÑ© Ù¼©ýá£ýáÉýØÇ ýñæý×¼ýáü ý╣ÿÙúî Ýøä ýØ╝ýáò Û░äÛ▓®ý£╝Ùí£ ýÂöýáü Û▓Çýé¼ÙÑ╝ ýï£ÝûëÝòÿÛ▓î ÙÉÿÙèöÙì░ ýú╝Ùí£ ýáäýé░ÝÖöÙï¿ý©ÁÝÿêÛ┤Çý┤¼ýÿüýØä ýØ┤ýÜ®ÝòÿÛ▓î ÙÉÿÛ│á ýØ┤ Û▓¢ýÜ░ ýºÇýåìýáüýØ© Ù░®ýé¼ýäá Ùà©ý£ýùÉ Ùö░ÙÑ© ý£äÝùÿýä▒ýØ┤ ý×êÙïñ. Ùö░ÙØ╝ýä£ ýáèýØÇ ÝÖÿý×ÉÙôñýùÉýä£Ùèö ýØ┤Ùƒ¼Ýò£ ýáÉÙôñýØä Û│áÙáñÝòÿýù¼ ýñæý×¼ýáü ý╣ÿÙúî ýù¼ÙÂÇÙÑ╝ ýïáýñæÝòÿÛ▓î Û▓░ýáòÝòÿýù¼ýò╝ ÝòÿÛ│á Û░ÇÙèÑÝòÿÙïñÙ®┤ ýêÿýêáýáü ý╣ÿÙúîÙÑ╝ ÝòÿÙèö Û▓âÙÅä ýóïýØÇ Ù░®Ù▓òýØ┤Ùïñ.
Û▓░ Ùíá
Ýÿäý×¼ ÝØëÙîÇ ÙîÇÙÅÖÙºÑÝÖòý×ÑýªØýùÉýä£ ýñæý×¼ýáü ý╣ÿÙúîÙèö Ùì£ ý╣¿ýèÁýáüýØ© ý╣ÿÙúîÙ▓òý£╝Ùí£ Ýæ£ýñÇ ý╣ÿÙúîýØ© ýêÿýêáýØÿ ÙºÄýØÇ ÙÂÇÙÂäýØä ÙîÇý▓┤ÝòÿÛ│á ý×êÙïñ. ÝûÑÝøä Û©░ÛÁ¼ýØÿ Ù░£Ùï¼Û│╝ Û©░ýêáýØ┤ Ù░£ýáäÝòÿÙ®┤ýä£ ýØ┤Ùƒ¼Ýò£ ÝÿäýâüýØÇ ýáÉýáÉ Û░ÇýåìÝÖöÙÉá Û▓âý£╝Ùí£ Ù│┤ýØ©Ùïñ. ÝòÿýºÇÙºî ý┤êÛ©░ýØÿ Û│áÙ¼┤ýáüýØ© Û▓░Û│╝ýùÉÙÅä ÙÂêÛÁ¼ÝòÿÛ│á ý×ÑÛ©░ýáüýØ© ýä▒ýáüýùÉ ÙîÇÝò┤ýä£Ùèö ýòäýºüÙÅä ýù░ÛÁ¼ Û▓░Û│╝Û░Ç ý®ÙÂäÝòÿýºÇ ýòèÙïñ. ÝûÑÝøä ý╣ÿÙúîýØÿ ÝÜ¿Û│╝ýÖÇ ýòêýáòýä▒ýùÉ ÙîÇÝò£ ýºÇýåìýáüýØ© ýù░ÛÁ¼ÙôñýØ┤ ÝòäýÜöÝòá Û▓âý£╝Ùí£ Ù│┤ýØ©Ùïñ.




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






