 |
 |
| Korean J Med > Volume 95(1); 2020 > Article |
|
мҡ”м•Ҫ
м ҠмқҖ лӮҳмқҙм—җ л°ңлі‘н•ң м·ҢмһҘм•”мқҖ л§Өмҡ° л“ңл¬јм§Җл§Ң, мһҗмІҙмқҳ лӮҳмҒң мҳҲнӣ„ л•Ңл¬ём—җ 진лӢЁкіј н•Ёк»ҳ нҷҳмһҗк°Җ л°ӣлҠ” м—¬мғқмқҳ мҶҗмӢӨмқҙ л§үлҢҖн•ҳлӢӨ. к·ёлҹ¬лҜҖлЎң мқјл°ҳм Ғмқё мң„н—ҳмқёмһҗм—җ лҢҖн•ң м§ҖмӢқмқ„ нҶ лҢҖлЎң м ҠмқҖ лӮҳмқҙм—җ л°ңлі‘н•ҳлҠ” м·ҢмһҘм•”мқҳ мң„н—ҳмқёмһҗлҘј нҷ•мқён•ҳкі кі мң„н—ҳкө°м—җ лҢҖн•ң м •кё°м Ғмқё 추м Ғ кІҖмӮ¬к°Җ н•„мҡ”н•ҳлӢӨ. мҡ”м•Ҫн•ҳл©ҙ ліё мҰқлЎҖлҠ” 20лҢҖ м ҠмқҖ лӮҳмқҙмқҳ лӮЁмһҗм—җм„ң л°ңлі‘н•ң м·ҢмһҘм•” мҰқлЎҖмқҙлӢӨ. мң м „м Ғ мң„н—ҳмқёмһҗлҠ” лҡңл ·н•ҳм§Җ м•Ҡм•ҳмңјл©°, лҢҖмӢ м—җ мһҘкё°к°„мқҳ нқЎм—°кіј л§Ңм„ұм·ҢмһҘм—ј лі‘л Ҙмқҙ м·ҢмһҘм•” л°ңмғқм—җ кё°м—¬н–ҲмңјлҰ¬лқј м¶”м •лҗңлӢӨ. лӮҳмқҙк°Җ м Ҡм–ҙлҸ„ мқҙлҹ¬н•ң мң„н—ҳмқёмһҗк°Җ мЎҙмһ¬н•ңлӢӨл©ҙ м·ҢмһҘм•” л°ңмғқ к°ҖлҠҘм„ұмқ„ кі л Өн•ҙм•ј н•ңлӢӨ. мқҙ кІҪмҡ° м Ғк·№м Ғмқё 진лӢЁ кІҖмӮ¬к°Җ м·ҢмһҘм•” мЎ°кё° 진лӢЁм—җ лҸ„мӣҖлҗ мҲҳ мһҲкі , мЎ°м Ҳ к°ҖлҠҘн•ң мң„н—ҳ мқёмһҗк°Җ мЎҙмһ¬н•ңлӢӨл©ҙ мқҙлҘј мӨ„мқҙкұ°лӮҳ м—Ҷм• л ӨлҠ” л…ёл Ҙмқҙ н•„мҡ”н•ҳлӢӨлҠ” кІғмқ„ ліё мҰқлЎҖлҘј нҶөн•ҙ л°°мҡё мҲҳ мһҲм—ҲлӢӨ.
Abstract
Pancreatic cancer is one of the most lethal malignancies worldwide. The risk of developing pancreatic cancer increases with age. Pancreatic cancer is seen mostly in the elderly; patients under the age of 30 years are rare. Known risk factors for pancreatic cancer include genetic mutations, smoking, chronic pancreatitis, and diabetes mellitus. We report a case of pancreatic cancer in a 27-year-old man without the PRSS1 mutation. Chronic pancreatitis and smoking may have contributed to the development of pancreatic cancer in this patient. We also conducted a literature review on early onset pancreatic cancer.
лҢҖн•ңлҜјкөӯ мЈјмҡ” м•” нҶөкі„м—җ мқҳн•ҳл©ҙ м·ҢмһҘм•”мқҖ лӮЁл…Җ м „мІҙ мқёкө¬ 10л§Ң лӘ…лӢ№ мЎ°л°ңмғқлҘ 14.6лӘ…, м—°л № н‘ңмӨҖнҷ” л°ңмғқлҘ 7.2лӘ…мңјлЎң к°Ғк°Ғ 8мң„м—җ н•ҙлӢ№н•ҳл©°, мқёкө¬ 10л§Ң лӘ…лӢ№ мЎ°мӮ¬л§қлҘ 12.3лӘ…, м—°л № н‘ңмӨҖнҷ” мӮ¬л§қлҘ 5.8лӘ…мңјлЎң к°Ғк°Ғ 5мң„лҘј м°Ём§Җн•ңлӢӨ[1]. м·ҢмһҘм•”мқҳ 5л…„ м•”мғқмЎҙмңЁ көӯм ң 비көҗ кІ°кіјм—җ л”°лҘҙл©ҙ лҜёкөӯ 8.5% [2], мқјліё 7.7%, лҢҖн•ңлҜјкөӯ 10.5%лЎң к°Ғкөӯм—җм„ң кіөнҶөм ҒмңјлЎң л§Өмҡ° л¶Ҳлҹүн•ң кІ°кіјлҘј ліҙмқҙкі мһҲлӢӨлҠ” кІғмқ„ м•Ң мҲҳ мһҲлӢӨ.
лӮҳмқҙлҠ” м·ҢмһҘм•”мқҳ мЈјмҡ” мң„н—ҳмқёмһҗлЎң, 80% мқҙмғҒмқҳ нҷҳмһҗк°Җ 60м„ё мқҙмғҒмқҳ л…ёл…„кё°м—җ л°ңлі‘н•ҳлҠ” кІғмңјлЎң м•Ңл Өм ё мһҲлӢӨ[3]. ліҙкұҙліөм§Җл¶Җм—җм„ң л°ңн‘ңн•ң 2015л…„ көӯлӮҙ нҶөкі„ кІ°кіјм—җлҸ„ м·ҢмһҘм•”мқҳ к°ҖмһҘ нҳёл°ң м—°л №мқҖ 70м„ём—җм„ң 74м„ё мӮ¬мқҙлЎң ліҙкі лҗҳм—ҲлӢӨ. н•ңнҺё, 2016л…„ мҳҒкөӯ нҶөкі„м—җ л”°лҘҙл©ҙ 1л…„к°„ 진лӢЁлҗң 747кұҙмқҳ м·ҢмһҘм•” нҷҳмһҗ мӨ‘ 29м„ё мқҙн•ҳлҠ” 2.1% (16/747)м—җ н•ҙлӢ№н•ҳмҳҖкі , мқјліёмқҳ н•ң м—°кө¬м—җм„ңлҸ„ 29м„ё мқҙн•ҳлҠ” 0.1% (1/908)м—җ н•ҙлӢ№н•ҳмҳҖлӢӨ[4]. көӯлӮҙ ліҙкұҙліөм§Җл¶Җ м•” л“ұлЎқ нҶөкі„ кІ°кіјм—җ л”°лҘҙл©ҙ, 2015л…„ н•ң н•ҙ лҸҷм•Ҳ 20лҢҖ м·ҢмһҘм•” л°ңмғқмһҗ мҲҳлҠ” м „мІҙ нҷҳмһҗ 6,342лӘ… мӨ‘ 16лӘ…мңјлЎң 0.2%лҘј м°Ём§Җн•ҳмҳҖлӢӨ[5]. мқҙмІҳлҹј 20лҢҖ м·ҢмһҘм•” л°ңлі‘мқҖ к·№нһҲ л“ңл¬јкё° л•Ңл¬ём—җ к°ҖмЎұл Ҙкіј мң м „м„ұ м§ҲнҷҳлҸ„ мқҳмӢ¬н•ҙм•ј н•ҳл©°, лӢӨлҘё м·ҢмһҘм•” л°ңлі‘ мң„н—ҳ мқёмһҗм—җ лҢҖн•ң кІҖнҶ лҸ„ л°ҳл“ңмӢң н•„мҡ”н•ҳлӢӨ.
20лҢҖ м—°л №кө°м—җм„ң л°ңмғқн•ң м·ҢмһҘм•” нҶөкі„мҷҖ лҢҖмЎ°м ҒмңјлЎң көӯлӮҙ л¬ён—Ң ліҙкі лҠ” м—ҶлӢӨ. м Җмһҗл“ӨмқҖ л§Ңм„ұм·ҢмһҘм—јкіј нқЎм—°л Ҙ мҷё м•Ңл Ө진 мң„н—ҳ мқёмһҗк°Җ м—Ҷм—ҲлҚҳ л§Ң 27м„ёмқҳ м ҠмқҖ лӮЁмһҗ нҷҳмһҗм—җм„ң л°ңмғқн•ң м·ҢмһҘм•” мҰқлЎҖлҘј л¬ён—Ңкі м°°кіј н•Ёк»ҳ ліҙкі н•ҳлҠ” л°”мқҙлӢӨ.
нҷҳмһҗ: 27м„ё лӮЁмһҗ
мЈјмҶҢ: нҷ©лӢ¬кіј к°Җл ӨмӣҖмҰқ
нҳ„лі‘л Ҙ: лӮҙмӣҗ 1л…„ 8к°ңмӣ” м „, нҷ©лӢ¬мқ„ мЈјмҶҢлЎң мҷёл¶Җ лі‘мӣҗмқ„ л°©л¬ён•ҙм„ң ліөл¶Җ мҙҲмқҢнҢҢ кІҖмӮ¬лҘј мӢңн–үл°ӣм•ҳлӢӨ. ліөл¶Җ мҙҲмқҢнҢҢ кІҖмӮ¬ кІ°кіј мЈјм·ҢкҙҖкіј к°„мҷёлӢҙлҸ„ нҷ•мһҘ мҶҢкІ¬мқҙ нҷ•мқёлҗҳм–ҙ м—ӯлҸҷ м „мӮ°нҷ”лӢЁмёөмҙ¬мҳҒ(dynamic computed tomography [CT])мқ„ 추к°Җ мӢңн–үл°ӣм•ҳкі (Fig. 1), м·ҢмһҘ л‘җл¶Җ м ҖмқҢмҳҒ мў…кҙҙк°Җ кҙҖм°°лҗҳм—ҲлӢӨ. н•ҙлӢ№ лі‘мӣҗм—җм„ң лӮҙмӢңкІҪ мҙҲмқҢнҢҢ кІҖмӮ¬(endoscopic ultrasonography, EUS)лҘј мӢңн–үн•ҳмҳҖкі м·ҢмһҘ мў…кҙҙлҘј м°ҫмқ„ мҲҳ м—Ҷм–ҙм„ң м·ҢмһҘ мғқкІҖмқҖ мӢңн–үн•ҳм§Җ м•Ҡм•ҳлӢӨ. нҷ©лӢ¬мқ„ лҸҷл°ҳн•ң к°„ мғқнҷ”н•ҷ кІҖмӮ¬ мқҙмғҒкіј лӢҙлҸ„ нҷ•мһҘ мҶҢкІ¬мқҙ мһҲм–ҙ, лӮҙмӢңкІҪ м—ӯн–үм„ұ м·ҢлӢҙкҙҖ мЎ°мҳҒмҲ (endoscopic retrograde cholangio-pancreatography, ERCP)мқ„ мӢңн–үн•ҳм—¬(Fig. 2), мҙқлӢҙкҙҖ нҳ‘м°© л¶Җмң„м—җ лҢҖн•ҳм—¬ мЎ°м§Ғ мғқкІҖ(endobiliary biopsy)мқ„ мӢңн–үн•ҳмҳҖкі , лӢҙкҙҖм—җ мҠӨн…җнҠёлҘј мӮҪмһ…н•ҳмҳҖлӢӨ. мЎ°м§Ғ кІҖмӮ¬ кІ°кіј, м•…м„ұ м„ёнҸ¬лҠ” кҙҖм°°лҗҳм§Җ м•Ҡм•ҳлӢӨ. 3к°ңмӣ” нӣ„ CT кІҖмӮ¬лҘј 추м Ғ мӢңн–үн•ҳмҳҖкі , мқҙм „м—җ кҙҖм°°лҗҳм—ҲлҚҳ м·ҢмһҘ л‘җл¶Җмқҳ м ҖмқҢмҳҒ мў…кҙҙлҠ” лҚ”мқҙмғҒ кҙҖм°°лҗҳм§Җ м•Ҡм•„(Fig. 1), мқҙм „ CTм—җм„ң кҙҖм°°лҗҳм—ҲлҚҳ м·ҢмһҘ л‘җл¶Җ м ҖмқҢмҳҒ мў…кҙҙлҠ” м—јмҰқм„ұ к°Җм„ұмў…м–‘(inflammatory pseudotumor)мңјлЎң нҢҗлӢЁлҗҳм—ҲлӢӨ. н•ҳм§Җл§Ң м—¬м „нһҲ мЈјм·ҢкҙҖ нҷ•мһҘ мҶҢкІ¬мқҙ кҙҖм°°лҗҳм–ҙ ERCP мӢңмҲ мқ„ нҶөн•ҙ м·ҢкҙҖ мЎ°мҳҒмҲ мқ„ мӢңн–үн•ҳкі (Fig. 2) мЈјм·ҢкҙҖ лӮҙм—җ мҠӨн…җнҠёлҘј мӮҪмһ…н•ҳмҳҖмңјл©°, мқҙл•Ң мқҙм „м—җ л„Јм—ҲлҚҳ лӢҙкҙҖ мҠӨн…җнҠёлҠ” м ңкұ°н•ҳмҳҖлӢӨ. м·ҢкҙҖмЎ°мҳҒмҲ мҶҢкІ¬мқҖ м·Ңл‘җл¶Җ мЈјм·ҢкҙҖ нҳ‘м°©кіј лҸҷл°ҳн•ҳм—¬ мғҒлҘҳ мЈјм·ҢкҙҖ л°Ҹ 분м§Җм·ҢкҙҖмқҳ нҷ•мһҘмқҙ кҙҖм°°лҗҳм—ҲлӢӨ. н•ңнҺё, нҷҳмһҗлҠ” лӢҙкҙҖмҠӨн…җнҠёлҘј м ңкұ°н•ң м§Җ 2к°ңмӣ” нӣ„, нҷ©лӢ¬мқҙ мһ¬л°ңн•ҳм—¬ лӢӨмӢң CTлҘј мӢңн–үн•ҳмҳҖкі , мҙқлӢҙкҙҖ нҷ•мһҘ мҶҢкІ¬мқҙ мһ¬нҷ•мқёлҗҳм–ҙ лӢҙкҙҖм—җ мҠӨн…җнҠёлҘј мһ¬мӮҪмһ…н•ҳмҳҖлӢӨ.
нҷҳмһҗлҠ” мІ« нҷ©лӢ¬ л°ңмғқ нӣ„ 8к°ңмӣ”м§ё, м„ңмҡём•„мӮ°лі‘мӣҗм—җ мқҳлў°лҗҳм—ҲлӢӨ. м„ңмҡём•„мӮ°лі‘мӣҗм—җм„ң ERCP мӢңмҲ мқ„ мӢңн–үн•ҳм—¬ лӢҙкҙҖ, м·ҢкҙҖ мҠӨн…җнҠёлҘј лӘЁл‘җ м ңкұ°н•ҳмҳҖкі , мҠӨн…җнҠё м ңкұ° нӣ„м—җ мӢңн–үн•ң CT кІҖмӮ¬м—җм„ң мқҙм „мқҳ м·ҢмһҘ л‘җл¶Җ м ҖмқҢмҳҒ мў…кҙҙлҠ” кҙҖм°°лҗҳм§Җ м•Ҡм•ҳлӢӨ. м„ңмҡём•„мӮ°лі‘мӣҗ 추м Ғ 1к°ңмӣ”, 7к°ңмӣ”м§ё, к°Ғк°Ғ мӢңн–үн•ң CT кІҖмӮ¬ кІ°кіј мЈјм·ҢкҙҖ л°Ҹ к°„мҷёлӢҙкҙҖ нҷ•мһҘ мҶҢкІ¬мқҙ мқҙм „кіј ліҖнҷ”к°Җ м—Ҷм–ҙ л§Ңм„ұм·ҢмһҘм—јм—җ лҸҷл°ҳлҗң м·ҢлӢҙкҙҖ нҳ‘м°©мңјлЎң 진лӢЁн•ҳкі , 1л…„л§ҲлӢӨ мҷёлһҳ 추м Ғмқ„ кі„нҡҚн•ҳмҳҖлӢӨ. к·ёлҹ¬лӮҳ нҷҳмһҗлҠ” мІ« нҷ©лӢ¬ л°ңмғқ нӣ„ 1л…„ 8к°ңмӣ” нӣ„, м „мӢ мҶҢм–‘к°җмқ„ мЈјмҶҢлЎң м„ңмҡём•„мӮ°лі‘мӣҗм—җ мһ¬мһ…мӣҗн•ҳмҳҖлӢӨ.
кіјкұ°л Ҙ: нҷҳмһҗлҠ” 10л…„ м „ 충мҲҳлҸҢкё°м—јмңјлЎң ліөк°•кІҪ 충мҲҳлҸҢкё°м Ҳм ңмҲ мқ„ мӢңн–үн•ң мҲҳмҲ л Ҙмқҙ мһҲм—ҲлӢӨ.
к°ҖмЎұл Ҙ: м§Ғкі„к°ҖмЎұмңјлЎң л¶ҖлӘЁмҷҖ л‘җ лӘ…мқҳ лҲ„лӮҳк°Җ мһҲм—ҲлӢӨ. лӘЁл‘җ м·ҢмһҘм—јкіј м·ҢмһҘм•”мқ„ 비лЎҜн•ҳм—¬ лӢӨлҘё м•” к°ҖмЎұл ҘмқҖ м—Ҷм—ҲлӢӨ.
мӮ¬нҡҢл Ҙ: мқҢмЈјл ҘмқҖ 9л…„ м „(л§Ң 18м„ё)л¶Җн„° 1мЈјм—җ 3нҡҢ лӮҙм§Җ 4нҡҢ, 1нҡҢ лӢ№ мҶҢмЈј 3лі‘м”© л§Ҳм…”мҷ”мңјл©°, 4к°ңмӣ” м „л¶Җн„° кёҲмЈј мӨ‘мқҙм—ҲлӢӨ. нқЎм—°л ҘмқҖ 15л…„ м „(л§Ң 12м„ё)л¶Җн„° мӢңмһ‘, л§Өмқј 1к°‘ н”јмӣҢмҳЁ 15к°‘л…„мқҳ нҳ„н–ү нқЎм—°к°ҖмҳҖлӢӨ. кіјлӢӨ нқЎм—°к°Җ(heavy smoker)лҘј көӯм ңнҷҳкІҪм—°кө¬ л°Ҹ кіөмӨ‘ліҙкұҙм Җл„җ(International Journal of Environmental Research and Public Health)мқҳ м •мқҳм—җ л”°лқј л§Өмқј н•ҳлЈЁ 20к°ңн”јмқҳ нқЎм—° мӨ‘мқҙкұ°лӮҳ 20к°‘л…„мқҳ нқЎм—°л Ҙмқҙ мһҲлҠ” нҷҳмһҗлЎң, кіјлӢӨ мқҢмЈјмһҗ(heavy drinker)лҠ” лҜёкөӯм§Ҳлі‘нҶөм ңмҳҲл°©м„јн„°(Centers for Disease Control and Prevention)мқҳ м •мқҳм—җ л”°лқј лӮЁм„ұ кё°мӨҖ н•ҳлЈЁм—җ 5мһ” мқҙмғҒ мқҢмЈјн•ҳкұ°лӮҳ, 1мЈј лҸҷм•Ҳ 15мһ” мқҙмғҒмқҳ мқҢмЈјл Ҙмқ„ к°Җ진 нҷҳмһҗлЎң м •мқҳн• л•Ң, ліё мҰқлЎҖ нҷҳмһҗлҠ” кіјлӢӨ нқЎм—°к°Җмқҙмһҗ кіјлӢӨ мқҢмЈјмһҗмҳҖлӢӨ.
мӢ мІҙ кІҖмӮ¬ мҶҢкІ¬: нҳҲм•• 124/79 mmHg, нҳёнқЎмҲҳ 16нҡҢ/분, л§Ҙл°•мҲҳ 57нҡҢ/분, мІҙмҳЁ 36.6в„ғмҳҖкі , мІҙмӨ‘ 78 kg, мӢ мһҘ 180 cm, BMI 23.98лЎң нҷ•мқёлҗҳм—ҲлӢӨ. кё°нғҖ мӢ мІҙ кІҖ진м—җм„ң нҠ№мқҙ мҶҢкІ¬мқҖ ліҙмқҙм§Җ м•Ҡм•ҳлӢӨ.
кІҖмӮ¬мӢӨ мҶҢкІ¬: мқјл°ҳнҳҲм•Ў кІҖмӮ¬м—җм„ң л°ұнҳҲкө¬ 8,200/mmВі, нҳҲмғүмҶҢ 14.0 g/dL, нҳҲмҶҢнҢҗ 343,000/mm3лЎң м •мғҒ мҶҢкІ¬мқҙм—ҲлӢӨ. мғқнҷ”н•ҷ кІҖмӮ¬м—җм„ң м•„мҠӨнҢҢлҘҙн…ҢмқҙнҠём•„лҜёл…ём „лӢ¬нҡЁмҶҢ 29 U/L, м•ҢлқјлӢҢм•„лҜёл…ём „лӢ¬нҡЁмҶҢ 16 U/LлЎң м •мғҒлІ”мң„м—җ мһҲм—Ҳкі , м•Ңм№јлқјмқё мқёмӮ°л¶„н•ҙнҡЁмҶҢ 179 U/L, к°җл§Ҳ-кёҖлЈЁнғҖл°Җм „мқҙнҡЁмҶҢ 209 IU/L, мҙқ л№ҢлҰ¬лЈЁл№Ҳ 12.6 mg/dL, м§Ғм ‘ л№ҢлҰ¬лЈЁл№Ҳ 10.8 mg/dLлЎң мғҒмҠ№лҗҳм–ҙ мһҲм—ҲлӢӨ. м•„л°Җлқјм•„м ңлҠ” 68 U/L, лҰ¬нҢҢм•„м ңлҠ” 71 U/LмҳҖлӢӨ. нҳҲмІӯ мҪңл ҲмҠӨн…ҢлЎӨмқҖ 88 mg/dLлЎң м •мғҒлІ”мң„м—җ мһҲм—ҲлӢӨ. мў…м–‘н‘ңм§ҖмһҗлҠ” CA 19-9 25.1 U/mL, CEA 2.8 ng/mLлЎң м •мғҒлІ”мң„м—җ мһҲм—ҲлӢӨ. нҳҲмІӯ л©ҙм—ӯкёҖлЎңл¶ҲлҰ°G л°Ҹ G4лҠ” к°Ғк°Ғ 851.0 mg/dL (700-1,600 mg/dL), 15 mg/dL (< 140 mg/dL)мҳҖлӢӨ. PRSS1мҷҖ SPINK1 мң м „мһҗ лҸҢм—°ліҖмқҙ кІҖмӮ¬ кІ°кіј, лӘЁл“ м—јкё° м„ңм—ҙ м •мғҒмқҙл©° лҸҢм—°ліҖмқҙлҠ” кҙҖм°°лҗҳм§Җ м•Ҡм•ҳлӢӨ.
л°©мӮ¬м„ л°Ҹ лӮҙмӢңкІҪ мҳҒмғҒ мҶҢкІ¬: м—ӯлҸҷ м „мӮ°нҷ”лӢЁмёөмҙ¬мҳҒ кІ°кіј, 진н–үлҗң мҙқлӢҙкҙҖкіј м·ҢкҙҖ нҷ•мһҘ мҶҢкІ¬кіј н•Ёк»ҳ м·ҢмһҘ л‘җл¶Җ м ҖмқҢмҳҒ мў…кҙҙк°Җ кҙҖм°°лҗҳм—ҲлӢӨ(Fig. 1). EUS кІҖмӮ¬лҘј мӢңн–үн•ҳмҳҖкі , м·ҢмһҘ л‘җл¶Җм—җ м Җм—җмҪ”м„ұ лі‘ліҖмқҙ нҷ•мқёлҗҳм–ҙ EUS мң лҸ„н•ҳ м·ҢмһҘ мғқкІҖмқ„ мӢңн–ү(22-G core biopsy needle; AcquireTM, Boston Scientific, Spencer, IN, USA)н•ҳмҳҖлӢӨ(Fig. 3). мқҙм–ҙм„ң ERCPлҘј мӢңн–үн•ҳмҳҖкі , мҙқлӢҙкҙҖ нҳ‘м°©л¶Җм—җм„ң мЎ°м§Ғ мғқкІҖмқ„ мӢңн–үн•ҳмҳҖмңјл©°, лӢҙкҙҖкіј мЈјм·ҢкҙҖм—җ к°Ғк°Ғ мҠӨн…җнҠёлҘј мӮҪмһ…н•ҳмҳҖлӢӨ(Fig. 4). мғқкІҖ лі‘лҰ¬ кІ°кіј м·ҢмһҘ л‘җл¶Җ мғқкІҖ, лӢҙкҙҖ лӮҙ мғқкІҖ мЎ°м§Ғ лӘЁл‘җ м·ҢкҙҖ м„ м•”мў…мңјлЎң нҷ•мқёлҗҳм—ҲлӢӨ. лі‘кё° кІ°м •мқ„ мң„н•ҙ мӢңн–үн•ң F-18 fluoro-D-deoxyglucose м–‘м „мһҗ л°©м¶ңлӢЁмёөмҙ¬мҳҒ(positron emission tomography-CT) кІ°кіј, м·ҢмһҘ л‘җл¶Җм—җ maxSUV 5.0мқҳ кі лҢҖмӮ¬м„ұ лі‘ліҖмқҙ мһҲм—Ҳкі , мӣҗкІ© м „мқҙ мҰқкұ°лҠ” нҷ•мқёлҗҳм§Җ м•Ҡм•„ к·јм№ҳ м Ҳм ңлҘј кі„нҡҚн•ҳмҳҖлӢӨ.
м№ҳлЈҢ л°Ҹ кІҪкіј: нҷҳмһҗлҠ” м·ҢмӢӯмқҙм§ҖмһҘм Ҳм ңмҲ мқ„ мӢңн–үл°ӣм•ҳкі , мҲҳмҲ лі‘лҰ¬ кІҖмІҙ мҶҢкІ¬мқҖ м·ҢмһҘ л‘җл¶Җмқҳ 2.8 Г— 2.3 Г— 1.8 cm нҒ¬кё°мқҳ, мӨ‘л“ұлҸ„ 분нҷ”лҸ„лҘј ліҙмқҙлҠ” м·ҢкҙҖ м„ м•”мў…(pT2N1M0)мңјлЎң мөңмў… ліҙкі лҗҳм—ҲлӢӨ(Fig. 5). нҷҳмһҗлҠ” мҲҳмҲ нӣ„ н•©лі‘мҰқ м—Ҷмқҙ нҮҙмӣҗн•ҳмҳҖмңјл©°, м·ҢмһҘмЈјліҖл¶Җ лҰјн”„м Ҳ м „мқҙк°Җ нҷ•мқёлҗҳм–ҙ мў…м–‘лӮҙкіјм—җм„ң мҲ нӣ„ ліҙмЎ°н•ӯм•”нҷ”н•ҷмҡ”лІ•мқ„ мӢңн–ү мӨ‘мқҙлӢӨ.
м§ҖлӮң 10л…„к°„ нғҖ м•”мў… м№ҳлЈҢлІ•мқҳ л№ лҘё м„ұмһҘкіј лҢҖмЎ°м ҒмңјлЎң м·ҢмһҘм•”мқҖ м—¬м „нһҲ 5л…„ мғқмЎҙмңЁмқҙ 10% мқҙн•ҳлЎң л§Өмҡ° л¶Ҳлҹүн•ҳлӢӨ. м•„м§Ғ мЎ°кё° л°ңлі‘(early-onset) м·ҢмһҘм•”мңјлЎң 분лҘҳн•ҳлҠ” м—°л № кё°мӨҖм—җ лҢҖн•ҳм—¬ лӘ…нҷ•н•ң м •мқҳлҠ” м—ҶмңјлӮҳ, лӢӨмҲҳмқҳ м—°кө¬ л…јл¬ёл“ӨмқҖ 40м„ёлҘј кё°мӨҖмңјлЎң н•ңлӢӨ[4,6]. 40м„ё мқҙн•ҳмқҳ м ҠмқҖ м—°л №м—җ л°ңмғқн•ң м·ҢмһҘм•”мқҖ лӮҳмқҙ мқҙмҷёмқҳ мң„н—ҳмқёмһҗмҷҖ л°ңлі‘ кё°м „м—җ лҢҖн•ң м ‘к·јмқҙ н•„мҡ”н•ҳл©°, кі л №м—җм„ң л°ңмғқн•ҳлҠ” м·ҢмһҘм•”кіјлҠ” лӢӨлҘј мҲҳ мһҲлӢӨ.
м·ҢмһҘм•” л°ңлі‘мқҳ м—ӯн•ҷкіј мң„н—ҳ мқёмһҗлҘј лӢӨлЈ¬ лҸ…мқјмқҳ лӢӨкё°кҙҖ мҪ”нҳёнҠё м—°кө¬[3]м—җм„ң, нқЎм—°мқҖ м·ҢмһҘм•” л°ңмғқмқ„ 1.5л°°м—җм„ң 3л°° лҶ’мқҙлҠ” кІғмңјлЎң ліҙкі лҗҳм—ҲлӢӨ. л¶ҒлҜёмҷҖ мң лҹҪ л“ұ лӢӨк°ңкөӯм—җм„ң мӢңн–үн•ң м—°кө¬[7]м—җм„ң м·ҢмһҘм•” л°ңмғқкіј кҙҖл Ёлҗң нқЎм—°кё°к°„кіј нқЎм—° м–‘мқҳ мҡ©лҹү-л°ҳмқ‘ кҙҖкі„лҘј ліҙкі н•ҳмҳҖлӢӨ. нҳ„н–ү нқЎм—°к°ҖлҠ” м·ҢмһҘм•” л°ңмғқмқҳ көҗ차비(odds ratio)к°Җ 2.2мҳҖкі , нқЎм—°лҹүмқҙ л§Һкі нқЎм—°кё°к°„мқҙ кёёмҲҳлЎқ м·ҢмһҘм•” л°ңмғқмқҙ лҚ” мҰқк°Җн•Ёмқ„ нҷ•мқён•ҳмҳҖлӢӨ. н•ңнҺё, лҸ…мқјмқҳ м—°кө¬[3]м—җм„ң л§Ңм„ұм·ҢмһҘм—јмқҖ м·ҢмһҘм•” л°ңмғқм—җ мһҲм–ҙм„ң көӯм Ғ, м„ұлі„кіј лҸ…лҰҪм ҒмңјлЎң 16л°° лҶ’мқҖ мғҒлҢҖм Ғ мң„н—ҳлҸ„лҘј к°Җм§Җл©° 10л…„л§ҲлӢӨ 2%м”© м·ҢмһҘм•” л°ңмғқ мң„н—ҳлҸ„к°Җ лҲ„м Ғ мҰқк°ҖлҗЁмқ„ ліҙкі н•ҳмҳҖлӢӨ. лҳҗлӢӨлҘё м·ҢмһҘм•” л°ңлі‘мқҳ мң„н—ҳмқёмһҗмқё мғҒм—јмғүмІҙ мҡ°м„ұ мң м „м„ұ м·ҢмһҘм—ј(PRSS1 мң м „мһҗ ліҖмқҙ лҸҷл°ҳ)мқҖ м·ҢмһҘм•” л°ңлі‘мқҳ мғҒлҢҖм Ғ мң„н—ҳлҸ„лҘј 53л°° лҶ’мқҙл©°, 70м„ёк№Ңм§Җ м·ҢмһҘм•” л°ңмғқмқҳ лҲ„м Ғ мң„н—ҳлҸ„к°Җ 40%м—җ мңЎл°•н•ҳлҠ” кІғмңјлЎң м•Ңл Өм ё мһҲлӢӨ. лӢӨл§Ң, л§Ңм„ұ м—јмҰқм„ұ мҶҗмғҒкіј м№ҳмң кіјм •мқ„ кІӘмңјл©ҙм„ң л°ңлі‘н•ҳкё° л•Ңл¬ём—җ м·ҢмһҘм—ј л°ңлі‘кіј м·ҢмһҘм•” л°ңмғқ мӮ¬мқҙм—җ нҸүк· 40л…„мқҙ мҶҢмҡ”лҗҳлҠ” кІғмңјлЎң ліҙкі н•ҳмҳҖлӢӨ. мң лҹҪмқҳ лӢӨк°ңкөӯ кіөлҸҷ м—°кө¬[8]м—җм„ңлҸ„ мң м „м„ұ м·ҢмһҘм—ј нҷҳмһҗкө°мқҖ 50м„ё мқҙнӣ„м—җ 비лЎңмҶҢ м·ҢмһҘм•”мқҳ лҲ„м Ғ мң„н—ҳлҸ„к°Җ мҰқк°Җн•ҳлҠ” кІғмңјлЎң ліҙкі н•ң л°” мһҲлӢӨ.
н•ңнҺё, м ҠмқҖ лӮҳмқҙм—җ л°ңмғқн•ң м·ҢмһҘм•” нҷҳмһҗм—җм„ң м·ҢмһҘм•” л°ңлі‘мқҳ мң„н—ҳ мқёмһҗлҘј лӢӨлЈ¬ н•ң м—°кө¬[9]м—җм„ң, мЎ°кё° л°ңлі‘ м·ҢмһҘм•” нҷҳмһҗкө°мқҳ нҳ„н–ү нқЎм—°к°Җ 비мңЁмқҙ 56%лЎң лҶ’кі , нқЎм—° мӢңмһ‘ м—°л №мқҙ 19.8м„ёлЎң л§Өмҡ° лӮ®м•ҳлӢӨ. л°ҳл©ҙ, мқјл°ҳм Ғмқё м·ҢмһҘм•” л°ңлі‘ мң„н—ҳмқёмһҗлЎң м•Ңл Ө진 л§Ңм„ұм·ҢмһҘм—јмқҖ мЎ°кё° л°ңлі‘ м·ҢмһҘм•” нҷҳмһҗкө°м—җ л§Ңм„ұм·ҢмһҘм—ј нҷҳмһҗк°Җ нҸ¬н•Ёлҗҳм§Җ м•Ҡм•„м„ң м ҠмқҖ лӮҳмқҙм—җ л°ңмғқн•ҳлҠ” м·ҢмһҘм•”кіј л§Ңм„ұм·ҢмһҘм—јкіјмқҳ м—°кҙҖмқҙ м—ҶлӢӨкі ліҙкі н•ҳмҳҖлӢӨ. мқјліёмқҳ м—°кө¬[6]м—җм„ңлҸ„ л§Ңм„ұм·ҢмһҘм—јмқҖ м ҠмқҖ лӮҳмқҙм—җ л°ңмғқн•ң м·ҢмһҘм•” нҷҳмһҗм—җм„ң мң„н—ҳ мқёмһҗлЎңм„ң нҶөкі„м Ғ мқҳлҜёлҘј к°–м§Җ лӘ»н•ҳмҳҖлӢӨ. к·ёлҹ¬лӮҳ л§Ңм„ұм·ҢмһҘм—јмқҖ мҙҲкё°м—җлҠ” мҰқмғҒ нҳёмҶҢк°Җ м—Ҷкұ°лӮҳ 비нҠ№мқҙм Ғмқё кІҪмҡ°к°Җ нқ”н•ҳл©°, л§Ңм„ұм·ҢмһҘм—ј мҙҲкё°м—җлҠ” мҳҒмғҒ кІҖмӮ¬ мҶҢкІ¬лҸ„ нҠ№лі„н•ң мқҙмғҒ мҶҢкІ¬мқ„ ліҙмқҙм§Җ м•Ҡмқ„ мҲҳ мһҲлӢӨ. л”°лқјм„ң, мқҙл“Ө м—°кө¬м—җм„ң мҙҲкё° л§Ңм„ұм·ҢмһҘм—ј 진лӢЁмқ„ мң„н•ҳм—¬ м Ғк·№м Ғмқё кІҖмӮ¬л“Ө(мҳҲлҘј л“Өм–ҙ м·ҢмһҘ кё°лҠҘ кІҖмӮ¬)мқ„ мӢңн–үн•ҳм§Җ м•Ҡм•ҳлӢӨл©ҙ мҙҲкё° л§Ңм„ұм·ҢмһҘм—ј нҷҳмһҗлҘј лҶ“м№ мҲҳ мһҲлӢӨ. лҳҗ, л§Ңм„ұм·ҢмһҘм—ј мҙҲкё° мҰқмғҒмқҙ м• л§Өн•ҳм—¬ м •нҷ•н•ң л§Ңм„ұм·ҢмһҘм—јмқҳ мң лі‘кё°к°„мқ„ мёЎм •н•ҳкё°лҸ„ м–ҙл өлӢӨ. мқҙлҹ¬н•ң мқҙмң л“ӨлЎң м ҠмқҖ лӮҳмқҙм—җ л°ңмғқн•ң м·ҢмһҘм•”м—җм„ң л§Ңм„ұм·ҢмһҘм—јкіјмқҳ кҙҖкі„лҘј мҷ„м „нһҲ л¶Җм •н•ҳкё°лҠ” м–ҙл өлӢӨкі мғқк°Ғн•ңлӢӨ. н•ңнҺё, мң лҹҪмқҳ лӢӨк°ңкөӯ кіөлҸҷм—°кө¬[8]м—җм„ң мң м „м„ұ м·ҢмһҘм—јмқҖ м ҠмқҖ лӮҳмқҙм—җ л°ңлі‘н•ң м·ҢмһҘм•”кіјмқҳ нҶөкі„м Ғ м—°кҙҖм„ұмқҙ м—ҶмқҢмқ„ ліҙкі н•ҳмҳҖкі , мқјліёмқҳ м—°кө¬[6]м—җм„ңлҸ„ мЎ°кё° л°ңлі‘ м·ҢмһҘм•” нҷҳмһҗл“Өмқҳ к°ҖмЎұл Ҙ, мң м „ліҖмқҙ лӘЁл‘җ л§Ңкё° л°ңлі‘ м·ҢмһҘм•” нҷҳмһҗмҷҖ м°Ёмқҙк°Җ м—Ҷм—ҲлӢӨ. мҰү, мЎ°кё° л°ңлі‘ м·ҢмһҘм•”мқҖ мң м „м Ғ мҡ”мқёліҙлӢӨлҸ„ лӢӨм–‘н•ң мІҙм„ёнҸ¬ лҸҢм—°ліҖмқҙм—җ кё°мқён•ҳл©°, лӮҳмқҙ мҷём—җ л°ңлі‘ мң„н—ҳмқёмһҗм—җ лҢҖн•ң мһ¬кі к°Җ н•„мҡ”н•ҳлӢӨлҠ” мӢңмӮ¬м җмқ„ лӮЁкІјлӢӨ.
м·ҢмһҘм•” л°ңмғқм—җ лҢҖн•ң лҸ…лҰҪ мң„н—ҳмқёмһҗл“Өмқҙ кіөмЎҙн•ҳлҠ” нҶөн•© лӘЁнҳ•(integrated model)мқ„ м ңмӢңн•ң н•ң нӣ„н–Ҙм Ғ нҷҳмһҗ-лҢҖмЎ°кө° м—°кө¬[10]м—җм„ң, мң„н—ҳмқёмһҗ мҲҳм—җ л”°лқј м·ҢмһҘм•” мң„н—ҳлҸ„лҘј ліҙкі н•ң л°” мһҲлӢӨ. ліё нҷҳмһҗм—җ м Ғмҡ©н•ҳл©ҙ 3м җ(кіјлӢӨ нқЎм—°к°Җ 1м җ, л§Ңм„ұм·ҢмһҘм—ј 2м җ)мңјлЎң, лҢҖмЎ°кө°ліҙлӢӨ 22.4л°° лҶ’мқҖ м·ҢмһҘм•” л°ңмғқ мң„н—ҳлҸ„лҘј мҳҲмғҒн•ҙ ліј мҲҳ мһҲлӢӨ. м•һмңјлЎң м „н–Ҙм Ғ м—°кө¬к°Җ л’·л°ӣм№ЁлҗңлӢӨл©ҙ м–‘м§Ҳмқҳ к·јкұ°лЎң м ңмӢңн• мҲҳ мһҲкІ мңјлӮҳ м–ҙлҰ° лӮҳмқҙм—җ л°ңмғқн•ң м·ҢмһҘм•” нҷҳмһҗкө°мқҳ нқ¬мҶҢм„ұ, 진лӢЁ лӢ№мӢң нҷҳмһҗмҷҖ к°Җкі„лҸ„ кө¬м„ұмӣҗмқҳ м ҠмқҖ м—°л №мңјлЎң мқён•ҙ кө¬м„ұмӣҗмқҳ м•” л°ңмғқ 추м Ғмқҙ н•„мҡ”н•ң м җ л“ұмқҳ н•ңкі„лҘј к·№ліөн•ҙм•ј н•ңлӢӨ.
ліё мҰқлЎҖмқҳ нҷҳмһҗлҠ” л§Ңм„ұм·ҢмһҘм—јмқ„ к°Җ진 нҳ„н–ү л°Ҹ кіјлӢӨ нқЎм—°к°ҖмҳҖлӢӨ. ліё мҰқлЎҖ нҷҳмһҗмқҳ м·ҢмһҘм•” л°ңмғқм—җлҠ” нқЎм—°кіј л§Ңм„ұм·ҢмһҘм—јмқҙ кё°м—¬н•ң м җмқҙ м»ёлӢӨкі мғқк°ҒлҗңлӢӨ. ліё мҰқлЎҖ нҷҳмһҗмқҳ нқЎм—° мӢңмһ‘ м—°л №мқҖ л§Ң 12м„ёлЎң мқҙнғҲлҰ¬м•„мқҳ м—°кө¬[9]м—җм„ң мЎ°кё° л°ңлі‘ м·ҢмһҘм•” нҷҳмһҗкө°мқҳ нҸүк· нқЎм—° мӢңмһ‘ м—°л №мқё 19.8м„ёліҙлӢӨлҸ„ м–ҙл ёлӢӨ. л¶ҒлҜёмҷҖ мң лҹҪ л“ұ лӢӨк°ңкөӯмқҳ м—°кө¬[7] кІ°кіјм—җ ліё мҰқлЎҖ нҷҳмһҗлҘј м Ғмҡ©н•ҙ ліҙл©ҙ, н•ҳлЈЁ 20к°ңн”ј нқЎм—°к°ҖлЎң лҸ…лҰҪм Ғмқё м·ҢмһҘм•” л°ңмғқ мң„н—ҳлҸ„к°Җ 2.3л°°, л…ём¶ңкё°к°„ 15л…„мқҙлҜҖлЎң 1.46л°° лҚ” лҶ’м•ҳлӢӨ. л§Ңм„ұм·ҢмһҘм—јмқҳ мёЎл©ҙм—җ мһҲм–ҙм„ң ліё мҰқлЎҖмқҳ нҷҳмһҗлҠ” мІҳмқҢ нҷ©лӢ¬мқҙ л°ңмғқн•ҳкі мӢңн–үн•ң мІ« ERCP мҶҢкІ¬ мғҒ, мғҒлӢ№нһҲ 진н–үлҗң л§Ңм„ұм·ҢмһҘм—ј мҶҢкІ¬мқ„ ліҙмҳҖлӢӨ(Fig. 2). мқҙлҘј нҶөн•ҙ нҷҳмһҗ лӮҳмқҙлҠ” 비лЎқ м Ҡм§Җл§Ң л§Ңм„ұм·ҢмһҘм—јмқ„ м•“мқҖ кё°к°„мқҖ мІ« нҷ©лӢ¬ л°ңмғқ мқҙм „ мөңмҶҢ мҲҳл…„ м „мңјлЎң кұ°мҠ¬лҹ¬ мҳ¬лқјк°Ҳ к°ҖлҠҘм„ұмқҙ мһҲмңјл©°, л§Ңм„ұм·ҢмһҘм—ј мһҗмІҙк°Җ м·ҢмһҘм•” л°ңмғқм—җ м–ҙлҠҗ м •лҸ„ мҳҒн–Ҙмқ„ лҜёміӨмқ„ кІғмңјлЎң мғқк°ҒлҗңлӢӨ. мң м „м Ғ мҡ”мқё мёЎл©ҙмқ„ ліҙм•ҳмқ„ л•Ң, ліё мҰқлЎҖ нҷҳмһҗлҠ” м·ҢмһҘм—јкіј м·ҢмһҘм•” лӘЁл‘җ к°ҖмЎұл Ҙмқҙ м—Ҷм—Ҳкі , PRSS1 кІҖмӮ¬ кІ°кіј м •мғҒмңјлЎң м ҠмқҖ лӮҳмқҙм—җ л°ңмғқн•ң м·ҢмһҘм•”мқҖ мң м „ м°ЁмқҙліҙлӢӨлҸ„ мІҙм„ёнҸ¬ лҸҢм—°ліҖмқҙк°Җ м—°кҙҖлҗ к°ҖлҠҘм„ұмқҙ лҶ’мқ„ мҲҳ мһҲлӢӨлҠ” м•һм„ м—°кө¬ кІ°кіјл“ӨлЎң м„ӨлӘ…н• мҲҳ мһҲлҠ” мһ„мғҒ м–‘мғҒмқ„ ліҙмҳҖлӢӨ.
ліё мҰқлЎҖ нҷҳмһҗлҠ” м ҠмқҖ лӮҳмқҙм—җ мӢңмһ‘н•ң нқЎм—°кіј кіјлӢӨ мқҢмЈјм—җ кё°мқён•ң л§Ңм„ұм·ҢмһҘм—јмқҙ м·ҢмһҘм•” л°ңлі‘м—җ лҸ…лҰҪм Ғмқё мң„н—ҳмқёмһҗлЎң мһ‘мҡ©н•ҳмҳҖлӢӨкі м¶”м •н•ҙ ліј мҲҳ мһҲлӢӨ. м ҠмқҖ лӮҳмқҙм—җ л°ңмғқн•ң м·ҢмһҘм•”мқҖ к·№нһҲ л“ңл¬јм§Җл§Ң мң„н—ҳмқёмһҗк°Җ 충분н•ҳл©ҙ м ҠмқҖ лӮҳмқҙм—җм„ң м·ҢмһҘм•” л°ңмғқмқҳ к°ңм—°м„ұмқҙ мһҲкё° л•Ңл¬ём—җ кёҲм—°, кёҲмЈјлҘј нҶөн•ҙ л§Ңм„ұм·ҢмһҘм—јмңјлЎңмқҳ 진н–үмқ„ л§үлҠ” л…ёл Ҙмқҙ н•„мҡ”н•ҳлӢӨлҠ” көҗнӣҲмқ„ м–»м—ҲлӢӨ.
REFERENCES
1. Jung KW, Won YJ, Kong HJ, Lee ES. Prediction of cancer incidence and mortality in Korea, 2018. Cancer Res Treat 2018;50:317вҖ“323.



2. Jemal A, Ward EM, Johnson CJ, et al. Annual report to the nation on the status of cancer, 1975-2014, featuring survival. J Natl Cancer Inst 2017;109:djx030.


4. Ohmoto A, Yachida S, Kubo E, et al. Clinicopathologic features and germline sequence variants in young patients (вүӨ40 years old) with pancreatic ductal adenocarcinoma. Pancreas 2016;45:1056вҖ“1061.


5. KOSIS. Relative survival rate for 5 years by 24 kinds of cancer, cancer occurrence time and gender [Internet]. Daejeon (KR): KOSIS, c2019. [cited 2018 Jun 11]. Available from: http://kosis.kr/statHtml/statHtml.do?orgId=117&tblId=DT_117N_A00023&vw_cd=MT_ZTITLE&list_id=101_11744&seqNo=&lang_mode=ko&language=kor&obj_var_id=&itm_id=&conn_path=MT_ZTITLE
6. Eguchi H, Yamaue H, Unno M, et al. Clinicopathological characteristics of young patients with pancreatic cancer. Pancreas 2016;45:1411вҖ“1417.


7. Bosetti C, Lucenteforte E, Silverman DT, et al. Cigarette smoking and pancreatic cancer: an analysis from the international pancreatic cancer case-control consortium (Panc4). Ann Oncol 2012;23:1880вҖ“1888.


8. Howes N, Lerch MM, Greenhalf W, et al. Clinical and genetic characteristics of hereditary pancreatitis in Europe. Clin Gastroenterol Hepatol 2004;2:252вҖ“261.


(A) The initial dynamic computed tomography (CT) (arterial phase) image shows an ill-defined hypoattenuating lesion in the pancreatic head (arrowheads). (B) CT at the 5-month follow-up. The previously noted pancreatic head lesion has disappeared. (C) CT at the 20-month follow-up. A focal mass-like lesion in the pancreatic head (arrowheads) was newly detected.

FigureВ 1.
(A) Cholangiogram shows a stricture in the intrapancreatic portion of the common bile duct (arrows). (B) Three months later, pancreatogram shows proximal pancreatic duct stricture (arrows) with upstream dilatation, including side branches (arrowheads).

FigureВ 2.
Endoscopic ultrasonography (EUS) findings. (A) EUS image shows a hypoechoic mass in the pancreatic head (arrowheads). (B) An EUS-guided fine needle aspiration and biopsy was performed.
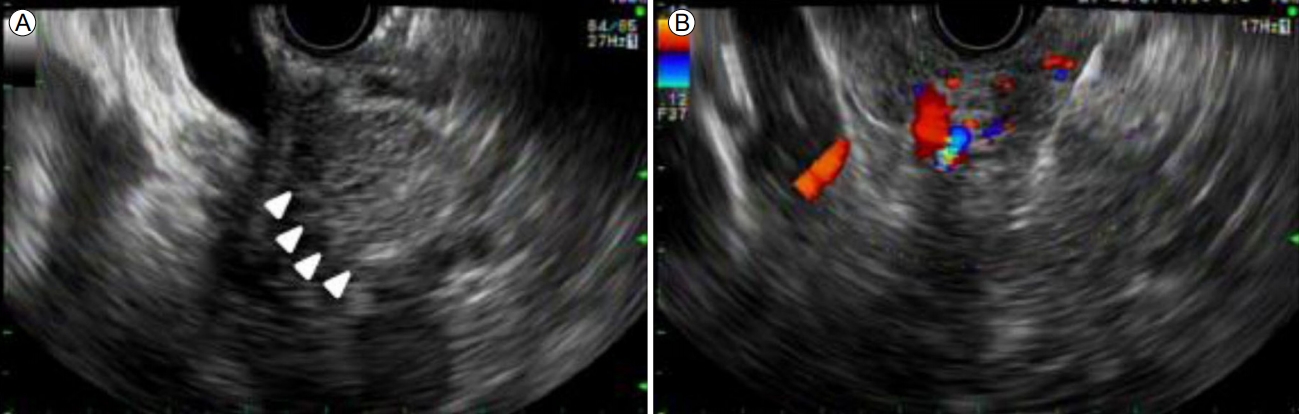
FigureВ 3.
Endoscopic retrograde cholangiopancreatography findings. (A) The intrapancreatic portion of the common bile duct was narrowed (arrowheads) and contrast could not fill the proximal bile duct. Pancreatic stent was already present. (B) Targeted biopsy of the biliary stricture was performed before biliary stent insertion.
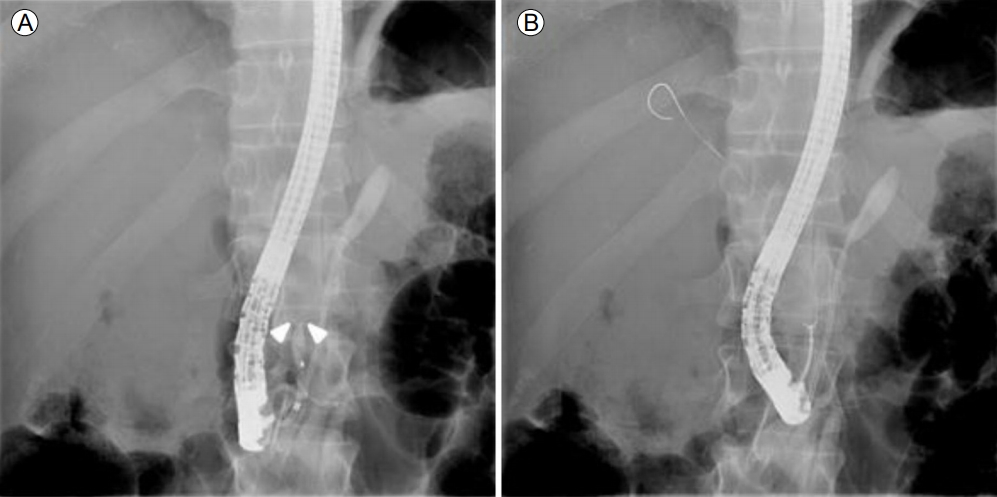
FigureВ 4.
Histological examination of the resected pancreaticoduodenectomy specimen. (A) Gross image of the resected specimen. An ill-defined 2.8-cm mass (arrowheads) is located at the head of the pancreas alongside the main pancreatic duct. (B) High-power field view (Г—100). Tumor-infiltrated glands (arrows) and nodal metastasis (arrowheads) are evident in the background of the desmoplastic reaction (*).




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




