서 론
아자티오프린(azathioprine)과 6-mercaptopurine (6-MP) 등 티오퓨린을 기반으로 한 약제들은 염증성 장질환 및 자가면역 간염, 장기이식 그리고 다양한 자가면역성 질환에서 가장 흔히 사용되는 약제이다[1]. 티오퓨린계 약제들의 부작용은 티오퓨린-메틸전환효소(thiopurine-methyltransferase, TPMT)의활성도에 따른 티오구아닌 대사물질(tioguanine metabolite)의 농도와 관련된 “용량-의존성(dose-dependent)” 부작용 그리고 용량과 관계없이 나타나는 특이반응(idiosyncratic reaction)및 알레르기반응(allergic reaction)이 포함되는 “용량-비의존성(dose-independent)” 부작용으로 구분하여 나타날 수 있다. 용량-의존성 부작용에는 골수 독성, 간염, 악성 종양, 기회감염 등이 포함되며, 용량-비의존성 부작용에는 골수 독성, 췌장염, 간염 및 발진, 발열, 관절통 등이 포함된다[2].
아자티오프린 혹은 6-MP 치료로 인한 간 독성은 용량-의존성 및 용량-비의존성 부작용 두 가지 형태 모두에서 발생할 수 있다. 용량-비의존성으로 발생한 간 독성은 대개 치료 시작 후 수주 이내에 발생하며[3], 알칼리포스파타제(alkaline phosphatase, ALP) 및 빌리루빈 상승과 아미노전달효소 상승을 동반한 담즙정체형 간기능 검사 이상 소견을 보인다[4]. 반면 용량-의존성의 간독성은 동양혈관 확장(sinusoidal dilatation), 결절성 재생증식(nodular regenerative hyperplasia), 간 섬유화(fibrosis), 자색반병(peliosis hepatis) 그리고 정맥폐쇄병(veno-occlusive disease) 등의 형태로 나타난다[5]. 이러한 병리조직학적인 변화는 치료 후 수개월 혹은 수년 이후에 발생하며, 간 혈관계의 손상으로 인한 것으로 생각되고 있으며, 가역성에 대하여는 아직 밝혀진 바 없다[6]. 간 혈관계의 손상으로 인한 간 혈류의 감소는 간세포의 과증식과 결절 형성을 유발시키고, 이는 간 결절성 재생증식으로 이어지게 되며, 결국 비경화성 문맥 고혈압(non-cirrhotic portal hypertension)과 비장비대를 일으킨다[7]. 저자들은 아자티오프린으로 치료 중인 크론병 환자에게서 비경화성 문맥 고혈압이 발생한 1예를 경험하였기에 문헌고찰과 함께 보고하는 바이다.
증 례
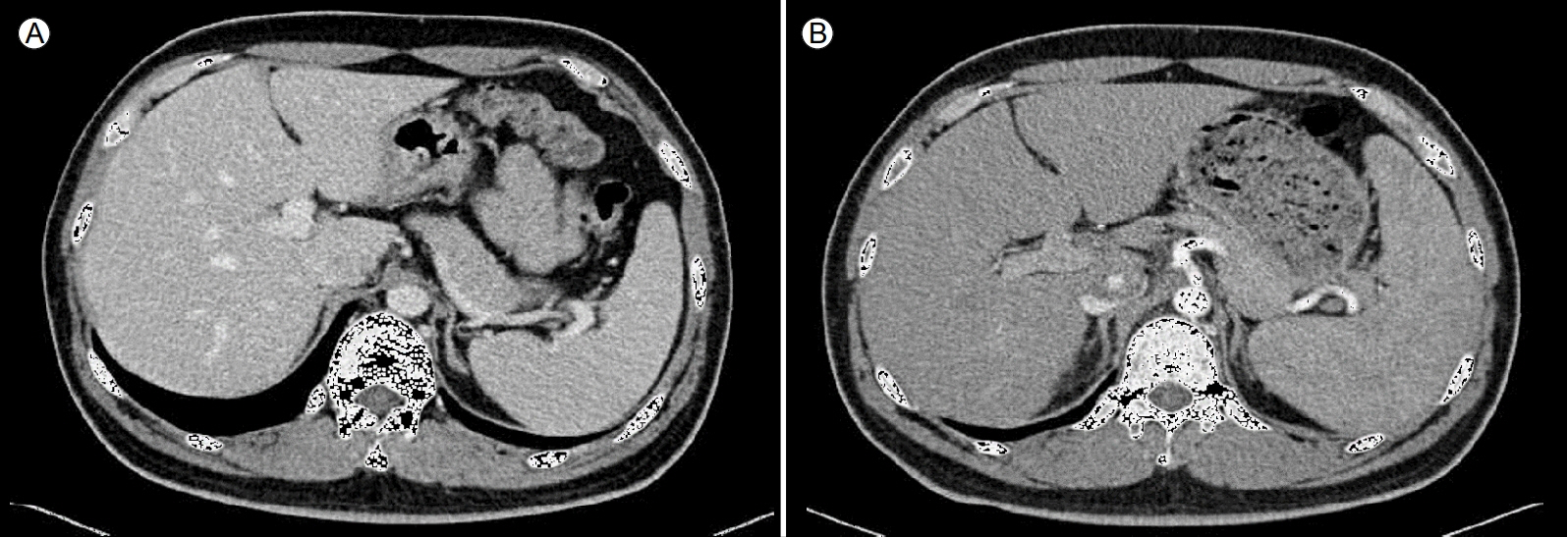
14개월 전 크론병으로 진단받은 후 아자티오프린 하루 125 mg과 메살라진(mesalazine) 하루 2,000 mg으로 치료받고 있던 27세 남자가 대구 파티마병원에서 치료를 지속하기 위해 방문하였다. 치료 시작 전 시행한 혈액 검사에서 백혈구 6,610 /uL, 혈색소 14.2 g/dL, 혈소판 수 320,000/uL, 아스파라진산 아미노전이효소(AST) 13 U/L, 알라닌 아미노 전이효소(ALT) 9 U/L로 정상 소견이 관찰되었다. 내원 당시 환자는 몸무게 70 kg, 생체 징후는 정상이었으며 간헐적으로 반복되는 경미한 복통을 호소하고 있었다. 치료를 지속하기에 앞서 기본적인 혈액 검사와 상부 및 하부 내시경을 시행하였다. 혈액 검사에서 백혈구 3,980/uL, 혈색소 14.0 g/dL, 혈소판 수 133,000/uL, 프로트롬빈 시간 11.4초, 적혈구 침강속도(erythrocyte sedimentation rate) 5 mm/hr, C-반응성 단백(C-reactive protein) 0.21 mg/dL, 총단백 7.6 g/dL, 알부민 4.6 g/dL, 총빌리루빈 0.47 mg/dL, AST 52 U/L, ALT 61 U/L, ALP 230 IU/L, r-GTP 209 IU/L, 혈청 요소질소 15.5 mg/dL, 혈청 크레아티닌 0.83 mg/dL, 혈청 나트륨/칼륨 142 mEq/L, 3.8 mEq/L로 경미한 혈소판 수 감소 및 경미한 AST/ALT 상승 이외에 특이 소견은 관찰되지 않았다. 상부위장관 내시경에서 크론병 진단 당시에는 존재하지 않았던 경도의 식도 정맥류가 관찰되었으며(F1, Cb, Li) (Fig. 1), 대장내시경에서는 말단 회장의 점막 발적 및 원위부 횡행 결장에 용종, 항문연에 함몰 병변(dimpling lesion) 등이 관찰되었다(Crohn’s disease[L3, B1p], quiescent stage) (Fig. 2). 상부위장관 내시경에서 식도 정맥류가 관찰되며, 혈소판 수 감소, AST/ALT 상승 소견 등을 바탕으로 간경화를 의심하여 간 역동적 computed tomography (liver dynamic CT), 간 탄성 초음파, 자가면역 간질환을 포함한 여러 가지 간질환을 감별하기 위한 혈액 검사 등 추가적인 검사를 시행하였다. 환자는 술은 마시지 않아 알코올성 간질환은 배제하였다. 간 역동적 CT에서는 만성간질환 및 간비장비대 소견(Fig. 3) 이외 특이 소견은 관찰되지 않았으며, 간 탄성 초음파에서는 평균 압력 6.5 kPa, F1소견으로 정상 간 탄성도를 보였다. 혈액 검사 결과 자가면역 간질환(autoimmune hepatitis) 및 윌슨병(Wilson’s disease), a1-항트립신 결핍(a1-antitrypsin deficiency) 간질환, 다른 바이러스성 간질환 등이 배제되었다. 또한 티오퓨린 대사 이상 확인을 위하여 TPMT 검사를 시행하였으며, 정상 소견이 관찰되었다. 이상의 검사에서 간질환을 일으킬 만한 특별한 원인이 없었기에 간생검을 시행하였다. 생검한 조직으로 병리조직학적 검사를 시행하였으며, 헤마톡실린 & 에오신(hematoxylin & eosin, H&E) 염색 및 간의 구조 및 섬유화 확인을 위하여 레티큘린(reticulin) 염색과 트리크롬(trichrome)염색을 같이 시행하였다. H&E 염색에서는 간경화를 고려할만한 섬유화는 저명하지 않았으며, 간 소엽(lobule) 및 간 문맥 주변 구역(periportal area)의 염증 소견도 미세하였다. 또한 간세포의 과형성(hyperplasia)으로 인해 주변의 간세포들이 압박되어 위축(atrophy)된 모습이 관찰되었다. 레티큘린염색의 저배율 소견에서는 이러한 간세포의 구조를 더 명확히 관찰할 수 있었으며, 결절화(nodularity) 소견이 관찰되어 간 결절성 재생증식에 합당한 소견으로 나타났다(Fig. 4). 트리크롬 염색 결과는 음성이었다. 이상의 결과를 바탕으로 환자는 아자티오프린으로 인한 간 결절성 재생증식증으로 비경화성 문맥 고혈압까지 진행하게 된 증례로 진단하였다. 이후 환자는 아자티오프린을 중단하였으며, 경과 관찰 도중 장폐색 등 크론병 증상이 악화되어 아달리무맙으로 약제 변경 후 외래 추적 관찰 중이다. 현재 약 1년간 아자티오프린 중단 상태로 식도정맥류는 악화 혹은 호전 소견 없이 유지되고 있으며, 혈액 검사에서도 혈소판 수 129,000/uL, AST 41 U/L, AST 43 U/L로 특별한 변동 사항은 없는 상태이다.
고 찰
저자들은 아자티오프린으로 치료 중인 환자에게서 간수치 상승과 혈소판 수치 감소 그리고 새롭게 발생한 식도정맥류 소견이 관찰되어 간질환에 대한 여러 가지 검사를 시행하였다. 검사 결과 간 결절성 재생증식증으로 인한 비경화성 문맥 고혈압으로 진단하였다.
아자티오프린과 6-MP와 같은 티오퓨린계 약물들은 염증성 장질환의 치료 목적으로 매우 효과적이고 광범위하게 사용되는 대표적인 면역억제제이다. 이 약물들은 크론병 및 궤양성 대장염에서 관해를 유도하고 유지시키며, 스테로이드의존성 환자들에게 스테로이드 사용을 감소시키는 역할을 한다[8]. 하지만 약물 독성의 문제로 인하여 치료에 제한적이라는 한계성이 있고, 최고 약 25%의 환자들이 약물의 부작용으로 인하여 치료를 중단하였으며, 간 독성의 유병률은 0-32%까지 발생한다는 보고가 있다[9]. 아자티오프린의 부작용은 “용량-의존성” 및 “용량-비의존성”의 두 가지 형태로 나타날 수 있는데, 간 독성의 경우 양 군 모두에서 발생할 수 있으며, “용량-비의존성” 간 독성은 주로 혈액 검사에서 약간의 간기능 검사 이상 소견으로 발생하게 되며 약제를 중단할 시 회복된다. 하지만 “용량-의존성” 간 독성은 다양한 형태의 병리조직학적 이상 소견을 동반하는 경우가 많으며, 약제 중단 시 회복 여부에 대하여는 아직 밝혀진 바 없다[3-6].
“용량-의존성” 간 독성에 의한 병리조직학적 변화는 동양혈관 확장, 결절성 재생증식, 간섬유화, 자색반병 그리고 정맥폐쇄병 등의 형태로 나타나게 된다[5]. 이 중 결절성 재생증식증은 간의 섬유화 소견 없이 간 실질이 다수의 미만성 결절로 대치되는 병변으로서 결절 형성으로 인한 압박으로 위축된 간세포로 구성되어 있는 드문 질환이다[10]. 현재까지 보고된 증례가 많지 않기 때문에 병인학(etiology)이나 자연경과가 잘 알려지지 않았으며, 간 실질의 균일하지 못한 혈액 공급이 원인으로 생각되고 있다. 만약 증상이 발생한다면 주로 문맥압 상승으로 인한 합병증의 형태로 나타나게 된다[10]. 여러 약물 중 퓨린계의 약물인 아자티오퓨린, 6-MP, 6-티오구아닌(6-thioguanin, 6-TG) 등이 결절성 재생증식증과 관련이 있는 것으로 알려져 있으며, 장기이식(신장, 간, 골수 등) 이후 면역억제제로 퓨린계 약물을 사용한 환자들에게서 결절성 재생증식증이 발생하였다는 몇몇 보고들이 있다[6,10].
본 증례의 경우 크론병 치료를 위해 아자티오프린 투약 후 결절성 재생증식증이 발생하였으며, 이로 인한 문맥압 상승으로 인하여 식도정맥류가 발생한 것으로 보인다. 이처럼 크론병 환자에게서 아자티오프린 투약 중 결절성 재생증식증으로 문맥 고혈압의 합병증이 발생한 증례는 국외에서도 드물며, 국내에서는 아직 보고가 없다. 일단 식도정맥류가 발생하면 추후 식도정맥류 출혈이라는 심각한 합병증으로 이어질 수 있으며, 이러한 합병증은 생명을 위협할 수 있어 빠른 발견이 중요할 것으로 생각된다. 따라서 아자티오프린 등의 퓨린계 면역억제제를 사용하는 환자들에게서 정기적인 혈액 검사 등을 시행하여 간 수치 및 혈소판 수치 등을 면밀히 확인하는 것이 필요할 것으로 보인다. 만약 이러한 변화들이 관찰된다면 결절성 재생증식증의 가능성을 염두해두고 추가적인 검사가 진행되어야 할 것이다.






 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






