헬리코박터 파일로리 제균 치료의 최신 동향
The Current Strategy of Helicobacter pylori Eradication
Article information
Trans Abstract
Helicobacter pylori (H. pylori) is the main cause of most gastroduodenal diseases. Triple therapy including two antibiotics, amoxicillin and clarithromycin, and a proton pump inhibitor given for a week has been recommended as the treatment of choice since the revision of the Korean H. pylori Clinical Practice Guidelines in 2013. However, antimicrobial resistance significantly decreased the cure rate of H. pylori eradication to 63.9%. Thus, the new H. pylori treatment regimen would be needed to increase the eradication rate in Korea. Recently, the update of clinical practice guideline for treatment of H. pylori was developed by conducting a meta-analysis. In this review, the recommended H. pylori eradication regimen in current 2020 guideline will be discussed.
서 론
헬리코박터 파일로리균(Helicobacter pylori, H. pylori) 감염은 만성 전정부 위염, 소화성궤양, 점막연관림프조직형 위림프종(gastric mucosa-associated lymphoid tissue lymphoma), 위선암 등의 가장 중요한 원인으로 알려져 있다[1-5]. 우리나라를 포함한 일본 및 중국과 같은 동아시아 국가들의 경우 전 세계에서 위암 발생률이 가장 높은 국가로 보고되었으며, 특히, 우리나라의 경우 2017년 국내 암등록 통계 자료에 의하면 위암 표준화 발생률이 인구 100,000명당 32명으로 갑상선암을 제외한 전체 암종 중에 가장 높았다. 2018년 발표된 자료에 의하면 전 세계에서 위암 발생률 1위로 알려져, 향후 위암의 원인인 H. pylori의 제균 치료의 필요성이 더욱 대두되었다[6]. 2013년에 개정된 H. pylori 진단 및 치료에 대한 임상진료 지침을 바탕으로 현재 우리나라의 국민건강보험체계에서 H. pylori 제균요법은 표준3제요법(프로톤펌프 억제제[proton pump inhibitor, PPI] + 2개의 항생제[amoxicillin, clarithromycin 또는 metronidazole])을 일주일간 사용하는 경우에만 인정하고 있다[7]. 일반적으로, H. pylori 제균 치료는 적절한 항생제와 PPI의 조합을 이용하며, 제균율이 80% 이상 되어야 하는데[8], 이러한 표준3제요법 치료의 성공률은 과거에는 효과적인 것으로 보고되었지만 항생제 내성률의 증가와 함께 H. pylori 제균율이 감소하여 현재는 약 70-80% 정도로 보고되고 있다[9]. 이처럼 제균율이 낮아진 원인으로는 항생제 사용의 증가에 따른 H. pylori에서 항생제 내성의 증가로 생각되는데, 우리나라에서 일차 제균 치료요법으로 가장 많이 사용되는 clarithromycin에 대한 내성이 그 원인으로 알려져 있으며[10-13], 2018년 대한상부위장관·헬리코박터학회에서 주도한 전국 다기관연구에서 clarithromycin에 대한 내성률은 17.8%로 보고되었다[10]. 유럽에서 발표된 Maastricht V Consensus에서는 clarithromycin 내성률이 15-20% 초과인 지역에서 항생제 감수성 검사 없이, clarithromycin을 기본으로 한 표준3제요법을 일차 치료로 사용하지 않을 것을 권고하였지만[14], 현재 의료보험 적용기준 및 여러 가지 이유로 우리나라의 실제 진료 현장에서 적용하기가 쉽지는 않아 혼선이 초래된다. 또한, 2개 이상의 항생제에 관한 내성을 가진 다제내성의 빈도도 20% 이상으로 나타나고 있어서[10,11], 1차 제균 치료 실패 시 다음으로 선택할 제균요법을 선택하는 데 있어 어려움이 있다. 최근 대한상부위장관·헬리코박터학회에서 발표한 H. pylori 진료 지침에서는 과거발표된 임상 근거를 바탕으로 체계적 문헌 고찰과 메타분석을 시행하여 표준3제요법 7일 치료의 대안으로 기존에 시도된 다양한 H. pylori 제균요법을 국내에서 사용할 수 있는 일차요법으로 제시하였다[9]. 이에 본고에서는 개정된 가이드라인에서 제시한 H. pylori 치료에 있어 다양한 제균요법에 대한 고찰과 어떠한 제균요법이 임상에서 효과적일지에 관해 논하고자 한다.
본 론
한국에서 H. pylori 항생제 내성률 근거 치료 전략
H. pylori 제균요법의 적절한 선택을 위해서는 항생제 내성률과 약물 치료에 따른 제균율을 고려해야 한다. 제균요법에 가장 많이 사용하고 중요한 항생제로 metronidazole, clarithromycin, amoxicillin, levofloxacin 등이 있는데, 항생제들의 2003년도부터 2018년도까지 단일 기관에서 항생제 내성 변화율을 보고한 연구에 따르면, 591명의 환자에서 분석한 2003-2005년도 clarithromycin, metronidazole 및 levofloxacin의 일차 내성률은 각각 21.2%, 36.4% 및 4.5%였지만, 2017-2018년 도의 경우 45.9%, 43.2% 및 62.2%로 내성률이 증가한 소견을 보였다[11]. 대한상부위장관·헬리코박터학회에서 전향적 다기관 연구로 시행한 전국 항생제 내성률 조사(349명)에서 clarithromycin, metronidazole, amoxicillin, tetracycline, levofloxacin, and ciprofloxacin의 내성률은 17.8%, 29.5%, 9.5%, 0%, 37.0%, 및 37.0%였고, 이 중 25.2%의 환자에서 두 가지 이상의 항생제에서 내성을 가지는 것으로 보고되었다[10].
적합한 헬리코박터 파일로리 제균 치료법의 조건으로 계획서순응분석(per protocol analysis)에서 90% 이상, 치료의도분석(intention-to-treat analysis)에서 80% 이상 치료 성공률을 보여야 하는데, 이러한 치료 성공에 영향을 미치는 중요한 요소 중 하나가 항생제에 대한 내성 유무이다[15]. 치료에 관한 2009년 진료 지침에서는 일차치료로 clarithromycin을 포함하는 PPI 3제요법 1주 내지 2주 투여를 추천(증거 수준: 높음, 권고 등급: 높음)하였고, 일차치료에 실패한 경우 이차치료로 bismuth, PPI, metronidazole, tetracycline 사제요법의 1주 내지 2주 투여를 추천하였다(증거 수준: 중등도, 권고 등급:높음) [15]. 일반적으로 일정한 지역에서 H. pylori의 제균 효과를 예측하기 위해서는 사용되는 약제의 항생제 내성의 패턴을 정확하게 알아야한다[16]. Maastricht V에서는 clarithromycin 내성률의 기준을 15%가 넘을 경우 항생제 감수성 검사 없이 표준3제요법의 치료를 지양하도록 권하고 있으며(증거 수준: 낮음, 권고 등급: 약함), 이러한 높은 clarithromycin 내성률을 보이는 지역에서는 bismuth 포함 4제요법, bismuth를 포함하지 않는 4제요법 또는 동시 치료를 1차 제균요법으로 권하고 있다[14]. Clarithromycin 내성률의 경우 우리나라에서는 대략 17.8-31.0% 전후로 보고되어 있어 15% 이상의 고내성지역에 해당하며 metronidazole 내성의 경우 30% 이상 40% 미만으로 보고되고 있어, clarithromycin 및 metronidazole의 이중내성의 유병률은 대략 15% 미만으로 낮은 지역으로 분류할 수 있다[16]. 이는 현재 1차 제균요법으로 주로 사용되는 표준3제요법의 경우 일차 제균요법으로서의 한계점을 객관적으로 보여주는 근거로 제시되어 임상에 있어 적절한 H. pylori 일차 제균요법에 대한 고민을 안겨주었다.
개정된 가이드라인에 따른 헬리코박터 파일로리 1차 제균치료
2020년 대한상부위장관·헬리코박터학회에서 권고한 H. pylori의 일차치료요법으로는 1) 표준3제요법, 2) bismuth를 포함하지 않는 4제요법(순차 치료, 동시 치료 등), 3) clarithromycin 내성 검사 후 표준3제요법 선택, 4) 일부 환자에서 bismuth 포함 4제요법을 사용할 수 있음을 권고하였다(Fig. 1).
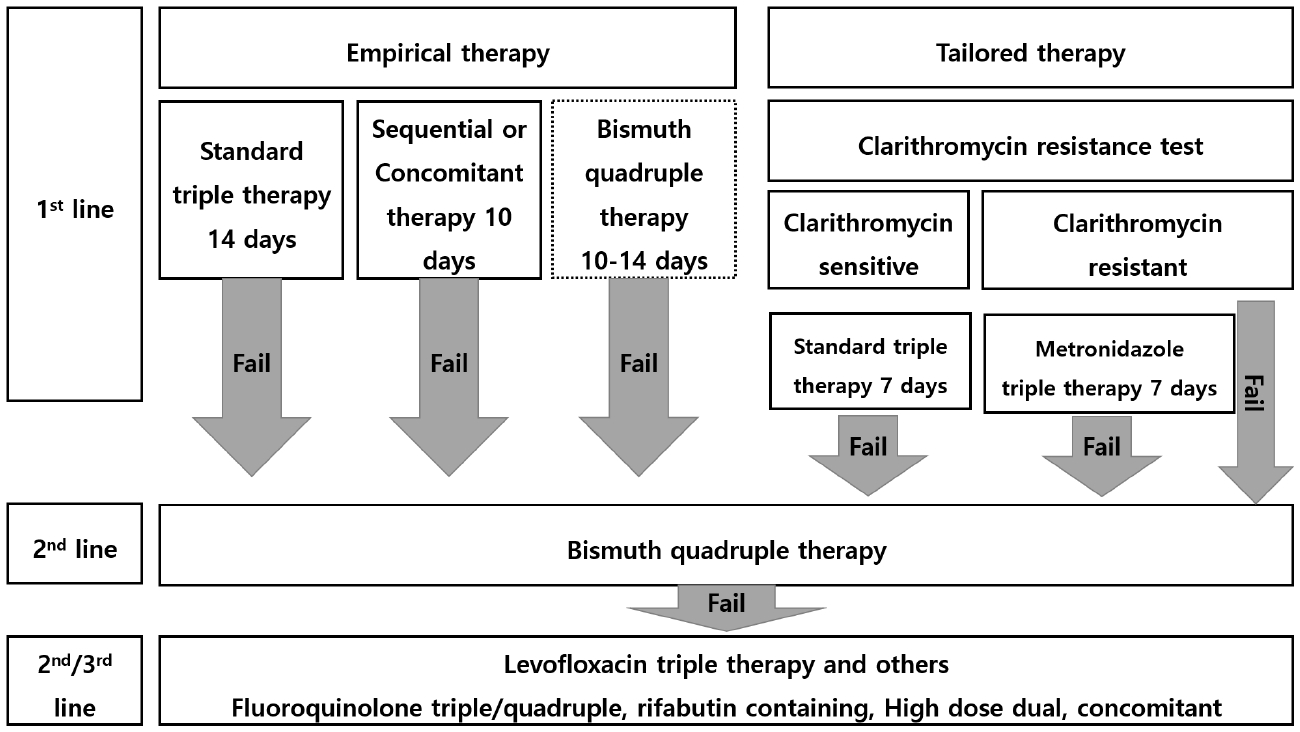
Proposed algorithm for the treatment of Helicobacter pylori infection in 2020 guideline. Standard Triple therapy, Proton pump inhibitor (PPI) standard dose + amoxicillin (1 g) + clarithromycin (500 mg) twice per day; Sequential Therapy, PPI (standard dose)+amoxicillin (1 g) then, PPI standard dose + amoxicillin (1 g) + clarithromycin (500 mg) + metronidazole (500 mg) twice per day; Concomitant therapy, PPI standard dose + amoxicillin (1 g) + clarithromycin (500 mg) + metronidazole (500 mg) twice per day; Metronidazole based triple therapy, PPI standard dose + amoxicillin (1 g) + metronidazole (500 mg) twice per day; Bismuth quadruple therapy, PPI (standard dose) twice per day + Bismuth subcitrate (120 mg) four times per day + Tetracycline (500 mg) four times per day + Metronidazole (500 mg) three times per day, Bismuth quadruple therapy as a first-line therapy is dotted because it is less preferred than other regimens.; Levofloxacin triple therapy, PPI standard dose + amoxicillin (1 g) twice per day + levofloxacin (500 mg) once a day or (250 mg) twice per day; Levofloxacin quadruple therapy PPI (standard dose) twice per day + levofloxacin (500 mg) once a day + Bismuth subcitrate (120 mg) four times per day + amoxicillin (1 g) twice per day; Rifabutin containing therapy. PPI standard dose + amoxicillin (1 g) + rifabutin (150 mg) twice per day; High dose dual therapy, PPI standard dose twice per day + amoxicillin (> 3 g/day and 3 times).
표준3제요법
개정된 가이드라인에서는 1차 제균 치료로 표준3제요법(PPI 표준용량, amoxicillin 1 g, clarithromycin 500 mg 하루 2회) 14일 치료를 권고하였다(근거 수준: 중간, 권고 강도: 강함) [9]. 2014년에 발표된 국내 표준3제요법에 대한 104개의 연구를 분석한 메타분석(meta-analysis) 결과 상, 1998년부터 2013년까지 표준3제요법의 제균율이 유의하게 감소하였는데, 전반적인 제균율은 intention to treat (ITT) 분석에서 74.6% (95% CI 72.1-77.2%), per protocol (PP) 분석에서 82.0% (95% CI 80.8-83.2%)였다. 제균율은 1998년부터 2013년까지 ITT, PP 분석 모두 유의하게 감소하는 양상을 보여서(p<0.001), 효과적인 H. pylori 제균 치료의 기준인 ITT 분석에서 80% 이상, PP 분석에서 90% 이상의 제균율에 미치지 못하는 결과를 보여주었다[9]. 2007년 이후 표준3제요법을 이용한 randomized controlled trials를 대상으로 체계적 문헌 검색(총 26개의 연구)에서 도출된 표준3제요법의 ITT 제균율은 71.6% (95% CI 69.9-73.3%)였고, PP 제균율은 79.6% (95% CI 76.6-82.2%)였다. 치료 기간에 따른 표준3제요법의 제균율을 보기 위하여 7일, 10일, 14일 치료의 제균율에 대한 하위 분석 상 7일 표준3제요법의 ITT 제균율은 70.0% (95% CI 68.5-71.4%), 10일 치료 73.7% (95% CI 69.8-77.2%), 14일 치료 78.1% (95% CI 75.2-80.7%)로, 14일 치료의 제균율이 7일이나 10일 치료에 비해 유의하게 높았으나(각각 p<0.01), 7일과 10일 치료의 제균율 간에는 유의한 차이가 없었다[9]. 국내에서 시행한 다기관 무작위 연구에서도 7일 표준3제요법의 제균율은 ITT 상 63.9%, PP 상 71.4%의 제균율을 보여주어, 1차 치료로서 7일요법을 사용하기에는 한계점을 보여주었다[17]. 과거 14일 치료의 제균율은 PP 분석 상 81.9-90.8%로 보고되고는 있지만[18-23], 다른 연구에서는 14일 표준3제요법의 ITT 제균율은 76.4% (95% CI 73.3-79.2%)로 알려졌으며[24], 최근에 발표된 국내 무작위연구에서도 7일과 14일의 제균율은 ITT 상 64.0% (114/178) 및 66.0% (126/191), PP 분석 상 78.5% (106/135) 및 78.6% (114/143)로 알려져 있어[25], 14일 표준3제요법을 1차 치료로 선택하기에는 여전히 부족한 부분이 남아있다(Table 1).
순차 치료
1차 제균 치료로 10일 순차 치료(양성자펌프억제제 표준 용량과 amoxicillin 1 g 하루 2회 5일간 사용 후 양성자 펌프억제제 표준 용량, clarithromycin 500 mg, metronidazole 500 mg 하루 2회 5일간)를 권고하였다(근거 수준: 높음, 권고 강도: 강함)[9]. 순차 치료는 PPI와 amoxicillin을 초기 5일간 사용한 후, 6일부터 10일까지 5일간 PPI, clarithromycin과 metronidazole을 투여하는 방법이다. 2000년경 처음 순차 치료가 소개되었는데, ITT 기준 98%의 높은 제균율을 보고하여 향후 제균 치료에 있어 1차 치료로 큰 기대를 받게 되었다. 처음 5일간의 PPI와 amoxicillin을 투여로 약 50%에 이르는 제균율을 기대할 수 있고, 이후 시행하는 PPI + clarithromycin + metronidazole의 3제요법은 위점막에서 세균의 밀도가 낮을수록 제균율이 높다는 것을 고려하여 투약하는 방법을 고안한 것이다[26]. 2005년 이후 발표된 국내에서 행해진 제균 치료 관련 무작위 배정 연구들에 기반한 메타분석에 따르면 10일 이상의 순차 치료에 의한 제균 효과는 ITT 기준 76.3% 정도였으며[9], 2011년 이후 무작위 배정 연구들에서 70.0-85.9% 정도의 ITT 기준 제균율을 보여주어 표준3제요법과 비교하였을 때 대체로 우월한 성적을 나타내었다[9,21,23,27-30]. 하지만 이후 발표된 전 세계적인 순차 치료의 제균율은 처음보다 낮게 보고되고 있으며, clarithromycin에 대한 내성이 순차 치료의 효과를 떨어뜨리는 것이 알려져 있고, metronidazole에도 동시 내성을 나타낼 경우 효과가 크게 감소하므로 H. pylori의 clarithromycin 내성률이 높은 나라에서는 그 효과가 제한적일 수 있다는 것을 시사하여 Maastricht V/Florence에서도 이러한 지역에서는 일차 제균요법으로는 권하지 않음을 명시하였다[14]. 대한상부위장관·헬리코박터학회에서 시행한 전향적 다기관 무작위 배정 연구에서도 10일 순차치료의 제균율은 ITT 상 76.3%, PP 상 85.0%로 7일 표준3제요법보다는 높은 제균율을 보여 일차 제균요법에서 ITT 상 만족할 만한 결과를 얻지 못하였는데[17], 이는 복용 순응도 등이 다른 제균요법에 비해 복잡한 점이 원인일 수 있다. 국내 및 국외의 기존 연구들을 종합해 볼 때, 10일 순차 치료는 7일과 10일 표준3제요법에 비하여 유의하게 제균율이 높았으나, 14일 표준3제요법과는 유사한 제균율을 보이는 것으로 나타났으며, clarithromycin 단독내성의 경우 제균율은 83.9%, clarithromycin 및 metronidazole 이중 내성의 경우 제균율은 36.4% 정도로 감소하는 것으로 보고되었다[31,32]. 이번 가이드라인에서도 일차 제균요법으로 14일 표준3제요법과 10일 순차치료를 모두 권고하였으나, 국내 단일기관에서 시행한 14일 표준3제요법과 10일 순차치료의 무작위 비교연구에서는 10일 순차 치료가 14일 표준3제요법에 비해 ITT (85.9% vs. 75.0%, p= 0.006), 및 PP (92.6% vs. 85%, p= 0.019)로 보고된 바가 있어 향후 추가적인 연구가 필요한 상황이다[21].
동시 치료
개정된 가이드라인에서는 1차 제균 치료로 10일 동시 치료(PPI 표준 용량, clarithromycin 500 mg, amoxicillin 1 g, metronidazole 500 mg 하루 2회)를 권고하였다(근거 수준: 높음, 권고강도: 강함) [9]. 동시치료는 표준3제요법에 비하여 많은 항생제를 짧은 기간 투여함으로써 비용, 부작용, 항생제 내성을 줄이려는 의도에서 개발되었다. 국내 6개 연구에서 1,897명의 환자를 대상으로 한 메타분석에서 동시치료의 제균율은 ITT 82.5% (95% CI 71.0-94.1) 및 PP 91.50% (95% CI 83.8-99.2)를 보였으며, 치료 기간은 5일부터 14일까지 다양하였으나 투여기간에 따른 제균율 차이는 관찰되지 않았다[33].
개발된 가이드라인에서 동시치료의 적절한 기간을 분석한 하위 연구에서, 10일 동시 치료의 제균율은 ITT 분석 85%, PP 분석 91%였고, 14일 동시 치료의 제균율은 ITT 분석 86%, PP 분석 94%로 표준3제요법보다 높았고, 10일 동시 치료와 14일 동시 치료의 제균율은 차이를 보이지 않았다[9]. 일반적으로 동시 치료요법의 경우 clarithromycin 내성이 높은 지역에서 보다 높은 제균율을 획득할 수 있는 장점이 있지만, metronidazole 내성이 높은 지역에서 그 효능에 대해서는 불확실하다. Clarithromycin 내성이 높은 지역에서 단기간의 표준3제요법은 그 효과가 크게 떨어지며, 동시 치료가 순차 치료에 비하여 우세를 보인다는 국외의 보고들이 많으며[31,32], 이와 유사하게 최근 동시 치료와 순차 치료의 제균율을 비교한 무작위 배정 연구에서도 clarithromycin 내성 균주만을 대상으로 분석하였을 때 동시 치료의 제균율이 93.3% vs. 53.9% (p= 0.029)로 유의하게 높은 것으로 보고되었다[34,35]. 이에 Maastricht V/Florence 진료 지침에서는 clarithromycin 내성률이 15% 이상으로 높은 지역에서는 bismuth 4제요법이나 동시 치료법을 선택할 것을 추천하고 있다[14].
또한 동시 치료법은 순차 치료에 비하여 투약 방법이 복잡하지 않다는 장점이 있으나, 부작용 발생 빈도가 높다는 보고도 일부 있다. 또한 동시요법을 사용하여 H. pylori 제균에 실패한 경우 2차 제균 치료로 사용할 수 있는 제균요법이 마땅하지 않기에 우선적으로 사용하는 데 있어 어려움을 줄 수 있다.
Clarithromycin 내성 검사에 기반한 표준3제요법
발표된 가이드라인에 따르면 7일 동안의 표준3제요법을 1차 제균요법으로 사용하고자 할 때에는 중합효소연쇄반응 또는 염기서열법을 이용한 clarithromycin 내성 검사를 권고하였다(근거 수준: 낮음, 권고 강도: 강함) [9]. 이전 국내 및 Maastricht V/Florence 지침에서 권유하고 있는 1차 치료법은 표준3제요법이며, clarithromycin 내성이 의심되는 경우 대안으로 bismuth-포함 사제요법을 권유하고 있다[14]. 제균 치료의 가장 이상적인 방법은 각각의 개인 해당 균주에 대한 항생제 내성 검사를 시행하여 적극적으로 적절한 항생제를 선택하는 맞춤 치료법이지만, H. pylori는 배양이 까다롭고, 배양 성공률이 일반적으로 70-80%로 알려져 있으며, 더욱이 자체 배양 여건이 없는 대부분의 병원은 검체 이송과 조직처리 과정의 오류로 배양의 오염 및 실패 등으로 배양을 하는데 어려움이 많다[36,37]. 이에, H. pylori를 직접 배양하는 것이 어려워 항생제 내성에 대한 분자생물학적인 기전의 연구를 바탕으로 최근 중합효소연쇄반응 검사(polymerase chain reaction, PCR) 기반 광범위 연구에서 밝혀진 각각의 항생제에 대한 H. pylori 내성 기전을 바탕으로 한 검사 방법이 도입되고 요양급여가 확대되면서 국내에서도 보편화 되었다[38]. 더욱이 clarithromycin에 대한 내성은 대부분 23S rRNA gene의 2142 혹은 2143 위치의 점 돌연 변이에 의하여 일어나는데, 주로 점 돌연변이의 위치는 주로 염기서열 2142와 2143 위치에 adenine이 guanine으로 치환되는 경우(A2142G, A2143G)이며, 드물게 2142 위치에 adenine이 cytosine으로 치환되는 경우(A2142C)와 그 외에도 A2115G, G2141A, A2142T, T2182C를 보고하고 있지만[38,39], 국내의 경우 여러 연구 상 대부분의 clarithromycin 내성은 대부분이 A2143G 변이로 확인되었다[40-42].
국내에서는 H. pylori의 항생제 내성 분석 분자진단 시약이 가장 앞서가는 분자진단시스템 중 하나인데, 국내에 허가된 제품은 (주) 씨젠(Seoul, Korea)의 Seeplex® H. pylori-ClaR ACE 제품과 고리매개 등온증폭법(loop-mediated isothermal gene amplification)을 이용한 (주) 엠모니터(Daegu, Korea)의 Isopollo™ H.pylori & ClaR 등이 등록되어 있다. 국제적으로는 여러 종류의 항생제 내성균에 대한 여러 형태의 제품이 개발되어 있는데, Hain Lifescience사의 H. pylori 진단시약, GenoType HelicoDR의 경우 clarithromycin과 fluoroquinolone에 대해 동시에 내성을 평가할 수 있으며, 나아가 real-time PCR법을 사용하여 3종류의 항생제 beta-lactams, fluoroquinolones, and macrolides 관련 내성을 검출하는 진단시약과 진단기기(medical device)도 개발이 되어 있는 상태이다. 이러한 PCR 방법은 82-90% 이상으로 상대적으로 높은 민감도 및 95% 이상의 특이도를 나타내는 우수성이 있는 검사이기에, 이를 이용한 H. pylori에서 clarithromycin 항생제 감수성 검사에 따른 치료 맞춤요법을 시행한 국내 연구의 제균 성공률은 PP 분석 상 90% 이상의 뛰어난 결과를 보여주었다[12,43,44]. 하지만 clarithromycin 내성이 있는 경우 제균율은 66.2-87.5%로 전체적인 제균율에 비해 떨어지는데[12,45], 이는 일반적으로는 제균 전 clarithromycin 내성을 확인한 경우에 선택할 수 있는 약제는 metronidazole을 근간으로 하는 metronidazole 기반 3제요법이나 bismuth-포함 사제요법으로 clarithromycin 및 metronidazole 동시 내성을 갖는 균주에서는 이러한 제균요법의 효능이 떨어질 가능성이 높을 것으로 생각되어, 이러한 경우 metronidazole 내성을 극복하기 위해 기간을 늘리는 14일 bismuth-포함 4제요법을 고려해야할 것이다. 맞춤 치료의 비용은 14일 동안의 경험적 표준3제요법의 비용과 거의 동등하여 비용-효과 측면에서도 열등하지 않은 것으로 나타나[43], 향후 의료보험 및 검사의 편이성 등이 보완될 경우 H. pylori 일차 제균요법으로 임상에서 가장 이상적인 방법이 될 것이다.
Clarithromycin과 metronidazole 동시 내성을 극복하기 위한 구제요법
표준3제요법으로 치료가 실패한 환자들의 H. pylori 균주에서는 clarithromycin 내성을 가지고 있을 확률이 높다. 이러한 경우 bismuth 포함 4제요법 14일요법을 변경된 가이드라인에서 권고하였다(근거 수준: 높음, 권고 강도: 강함) [9]. 과거, Bismuth 4제요법을 이용한 구제 치료로서 효능은 RTC에서 제균율이 75.5% (95% CI 71.6-79.1%)로 알려져 있으며, 치료기간을 10일에서 14일로 늘릴 경우 7일 치료요법보다 제균율이 81.6% (95% CI 76.9-85.6%; I2 = 29.6%)로 7일 치료요법의 제균율 68.4% (95% CI 53.0-73.5%; I2 = 73.8%)보다 유의하게 높았다(p< 0.01) [9]. 국내 연구에서도 2003년부터 2017년까지 15년간 bismuth 4제요법의 성공률을 분석한 결과 ITT 상 78.8%, PP 상 89.5%의 제균율을 보였으며, 매년 그 제균 성공률에 있어 차이는 없는 것으로 보고되었다[46]. 또한, metronidazole 내성을 가진 균주에서 bismuth 사제요법을 비교 분석한 연구에서, metronidazole 성장저해최소농도(minimum inhibitory concentration, MIC)가 8-32 μg/mL인 경우 제균 성공률은 92.8%로 높았으나, MIC가 높은(> 32 μg/mL) 균주에서는 제균율이 60%로 보고되었으며, 치료 기간을 14일로 연장하였을 경우 높은 metronidazole 내성(MIC > 32 μg/mL)을 가진 균주에서 66.6%의 제균율을 보여주었다[47]. 반면에 동시 치료 10일요법의 경우, clarithromycin 내성이 높은 지역에서 일차 치료로 사용하였을 경우 제균율은 ITT 및 PP 분석 상 91.5% (95% CI 86.2-94.8)와 95% (95% CI 90.4-97.4)의 제균율을 보여주었지만 2차 치료로 사용하였을 경우 ITT 및 PP 분석 상 60.6% (95% CI 43.6–75.3) 및 64.5% (95% CI 46.9–78.8)로 제균율이 급격히 감소하였다[48]. 하위 분석 상 clarithromycin 또는 metronidazole 단독 내성을 가진 경우 제균율은 91% (43/47)로 높게 나타났지만, 동시 내성을 가진 환자에서는 제균율은 55%(12/22)로 낮게 나타나[48], 낮은 이중 내성을 보이는 국가에서는 구제요법으로 사용을 고려해 볼 수 있지만, 일차치료에서 clarithromycin을 포함하는 제균요법을 사용할 경우 동시 치료의 효과는 불확실한 편이다. 이와 같은 결과를 바탕으로 현재 우리나라에서 일차치료로 clarithromycin을 포함하는 제균요법을 선택 후 치료에 실패할 경우 이차치료로는 14일 bismuth 사제요법을 우선적으로 선택하는 것이 바람직할 것으로 생각된다.
Levofloxacin 삼제요법
가이드라인에서는 1차 혹은 2차 치료로서 bismuth 4제요법에 실패한 경우 levofloxacin 포함 3제요법을 고려할 수 있음을 명시하고 있다(근거 수준: 매우 낮음, 권고 강도: 약함) [9]. 현재 우리나라에서 보고된 연구에 따르면 levofloxacin 내성률은 23.2-62.2% [10,11,49]로 다양하게 보고되고 있지만, 최근 발표된 다기관 연구에 의하면 이전 제균 치료를 받지 않은 환자들의 H. pylori 균주에서 두 개 이상의 항생제 내성을 보이는 88명의 분석 결과 clarithromycin과 metronidazole의 이중 내성을 보이는 경우, 73.9% (17/23)에서 levofloxacin 내성을 보였다[10]. 이러한 항생제 내성 결과는 H. pylori 이차 제균요법에서 실패한 환자의 경우 levofloxacin 삼제요법의 치료 성공률이 극히 낮을 것을 예측할 수 있는데, 이는 2017년 우리나라 14개 기관의 후향적 코호트 연구에서 삼차 치료에서 levofloxacin 3제요법의 제균율은 56.9% (62/109)로 만족하지 못하는 결과로 뒷받침된다[50]. 이에 효과적인 3차 치료요법에 대해 levofloxacin 4제요법, 순차요법, rifabutin 포함요법 등의 연구가 보고되었으나 아직까지 만족할 만한 제균율을 보이지 않으며, 우리나라에서 무작위연구 등으로 연구된 적이 없어 추가적인 근거가 필요한 상황이다.
결 론
2020년 개정된 가이드라인에서는 H. pylori의 일차 제균요법으로 2003년 개정된 가이드라인에 비해 다양한 제균 치료 방법을 제시하고 있다. 이는 임상에서 어떠한 약제를 선택해야 할 지 혼란을 줄 수 있을 것으로 생각이 되나, H. pylori의 clarithromycin에 대한 내성률이 증가함에 따라 기존의 7일간의 표준3제요법을 대신해, 보다 효과적인 치료를 선택하고자 한 방안으로 치료 기간을 늘리거나 순차 치료나 동시 치료와 같은 bismuth를 포함하지 않는 4제요법, clarithromycin 내성 검사를 이용하는 방법 등 최근 국내 및 국외 연구들의 근거를 바탕으로 한 치료 방법의 선택을 넓힌 데 큰 의의가 있으며, 향후 국가 보험에서 이러한 가이드라인을 보장하기 위한 노력이 뒤따라야 할 것이다. 하지만 가이드라인에서 제시한 내용 중에 clarithromycin과 metronidazole 동시 내성에 관한 치료 전략에는 아직까지 한계점을 보이고 있다. 이는 H. pylori 배양 및 균 내성에 따른 각각의 치료요법에 대한 제균율을 분석해야 하는데, 이를 위해서는 많은 수의 H. pylori 균주의 내성을 파악해야 하기에 향후 이에 대한 전향적인 연구가 필요한 상황이다. 향후 제안된 가이드라인에 따른 제균요법 별 각각의 제균 성공률에 대한 연구가 이루어진다면, 국내에서 보다 효과적이며 효율적인 H. pylori 일차 제균요법이 제시될 것으로 생각된다.
