만성 림프구성 백혈병에 대한 최신 지견
An Updated Review of Chronic Lymphocytic Leukemia
Article information
Trans Abstract
Chronic lymphocytic leukemia (CLL), characterized by monoclonal B-cell accumulation and highly variable clinical manifestations that range from an indolent to an aggressive course, is rare in Korea. Asymptomatic patients with early stage CLL can be followed up without treatment; however, those with active or advanced disease require treatment immediately after diagnosis, for symptom alleviation and prolonging survival. Previously, chemotherapy using cytotoxic agents was the only therapeutic option available for patients with CLL. Research has provided a deeper understanding of the pathophysiology of the disease, and novel agents such as monoclonal antibodies and small-molecule inhibitors that target specific sites on leukemic cells have been introduced. The advent of these new drugs has led to improved clinical outcomes in patients with CLL. Currently, Bruton’s tyrosine kinase inhibitors or B-cell lymphoma-2 inhibitors are recommended as frontline therapy, prior to the administration of cytotoxic agents or combination therapy with monoclonal antibodies. In this article, we review the diagnosis and prognosis of CLL, in addition to the clinical implications of the various therapeutic options.
서 론
만성 림프구성 백혈병(chronic lymphocytic leukemia, CLL)은 단클론 증식한 성숙한 림프구들이 골수를 비롯하여 말초 혈액 및 림프 조직에 축적되는 질환으로 국내에서는 비교적 드문 질환에 속한다. 작은 림프구성 림프종(small lymphocytic leukemia, SLL)은 림프구들이 말초혈액보다는 림프절이나 림프구에 침착하여 림프절 비대를 형성하는 질환으로 CLL과 동일한 질환으로 간주된다. 무증상의 CLL 환자는 치료를 하지 않고 경과 관찰하며 지내다 증상이 발생하거나 병이 진행하는 속도가 빨라지면 치료를 시작하게 된다. 세포 독성 항암제와 단클론 항체를 병합하는 항암 면역 치료가 치료의 기준이었다. 그러나 최근 세포 신호 전달을 억제하여 항암효과를 내는 경구 소분자억제제(small-molecule inhibitors)가 CLL 치료에 괄목할 만한 효과를 보여 항암제 없는(chemo-free) 요법으로 치료 패러다임의 변화가 이루어지고 있다. 이에 본 종설에서는 CLL의 이해를 돕기 위해 임상 양상, 진단 및 예후에 대해 리뷰하고 치료의 최신 지견에 대해 살펴보고자 한다.
본 론
역학
서구 사회에서 CLL은 매우 흔한 백혈병 중의 하나로 미국에서는 급성 골수성 백혈병 다음으로 높은 발생률을 보여 1년에 10만 명당 3-5명 정도 발생하는 것으로 알려졌다[1,2]. 여성보다는 남성에서 조금 더 흔하고, 인종별로도 발생률에 차이가 있어 서구인에 비해 아시아인이나 흑인에게는 상대적으로 드물게 발병한다[2]. 국내 암 발생률 데이터베이스(Korean National Cancer Incidence Database)를 통한 통계에 따르면 1999년부터 2012년까지 보고된 65,948명의 림프구성 혈액암 환자 중 CLL/SLL 환자는 1,495명으로 전체 림프구성 혈액암 중 2.2% 정도를 차지하였으며 연령 표준화를 이용한 통계에서도 CLL은 인구 10만 명당 0.31명의 발생률로 서구 사회에 비해 1/10-1/20배는 낮게 발생하는 것으로 보고되었다[3]. 한편 CLL의 첫 진단 시 나이도 인종적 차이를 보이는데, 백인에서 발병 연령의 중앙값은 70세 전후로 보고되었으나 아시아인은 60세 전후에 주로 발병한다고 보고되고 있다[4]. 국내 연구에서도 CLL 환자의 진단 시 평균 연령은 61세로 보고되어, 서양인과 확연히 차이가 있음이 확인되었는데[5,6], 이러한 CLL의 인종적 차이는 유전적 특성의 차이나 식습관과 같은 문화적 차이 등에 의할 것으로 생각되나 정확한 원인은 알려져 있지 않다[4,7]. 국내 몇몇 연구에 의하면 한국인의 CLL은 면역표현형 검사에서 CD22, FCM의 발현 비율이 높은 비전형적인 특징을 보이는 경우가 많고[5,6], TP53, ATM, SF3B1 등 CLL의 예후와 관련된 유전자 돌연변이 발현 빈도가 서양인과 다른 분포를 보인다고 보고되어[7], CLL과 관련한 인종적 차이는 유전적 프로파일 차이에 의한 것일 수도 있다.
임상 양상
CLL의 환자의 대부분은 우연히 확인된 말초혈액상 림프구 증가로 내원한다. 신체 검진 상에서 림프절 비대가 확인되는 경우가 많으며, 20-50%의 환자들에서는 간 비대 증가도 동반된다[8]. 10%의 환자들은 6개월 이내에 의도치 않은 10% 이상의 체중 감소, 설명되지 않은 열, 감염의 증거 없는 야간 발열 또는 피곤함 등과 같은 전형적인 B 증상(B symptom)을 나타내기도 한다[8,9]. CLL에서 면역 기관외 다른 장기에 림프구가 침범하는 경우는 흔하지 않으나 드물게 피부 및 중추 신경계에 침범하여 증상을 보이기도 한다[10].
CLL에서 림프구 증가와 함께 적혈구 또는 혈소판의 감소가 동반되는 경우가 있는데, CLL 세포의 골수 침범에 의한 혈구 감소가 아니라면 자가면역에 의한 용혈성 빈혈(autoimmune hemolytic anemia, AIHA) 또는 면역성 혈소판 감소증(immune thrombocytopenia, ITP)과 관련이 있을 수 있다. CLL의 자가면역성은 CLL 세포에 의해 자극 받은 T세포가 B세포의 다 클론(polyclonal) 항체 생성을 유도하거나 CLL세포에서 생산된 자가면역항체 또는 사이토카인(cytokine) 분비 등에 의한 것으로 추정된다[11]. 연구에 따라 차이는 있을 수 있으나 전체 CLL 환자의 4.5-10% 정도에서 자가면역에 의한 혈구 감소가 동반되는 것으로 알려져 있으며[11]. AIHA와 ITP 외에 다른 증상이 없는 CLL 환자라면 항암 치료가 아닌 스테로이드를 통해 치료를 하게 된다.
CLL은 대부분 진단 후 순조로운 경과를 보이나, 환자의 2-10% 정도(0.5-1%/년)는 매우 공격적인 성향의 림프종으로 변형(transformation)되는 리히터 신드롬(Richter syndrome)을 경험한다[12]. 특별한 증상이 없던 CLL 환자에서 갑작스럽게 B 증상이 발생하거나, 림프절이 갑자기 커지거나 또는 혈액 내 LDH 값이 상승되면 리히터 신드롬을 의심해야 한다. 일단 리히터 신드롬의 가능성이 있으면 PET/CT 등의 영상을 촬영하고 침범이 예상되는 부위에 대해 반드시 조직 검사를 시행해야 한다. 대부분은 미만성 거대 B세포 림프종(diffuse large B-cell lymphoma, DLBCL)으로 확인되나 일부는 호지킨 림프종(Hodgkin lymphoma)으로 확인되기도 한다. DLBCL로 변형은 대체적으로 매우 나쁜 예후를 보여 일부 환자들은 평균 수개월 정도 생존하는 것으로 보고되고 이들은 CLL이 아닌 림프종에 대한 치료를 받아야 한다[13].
진단
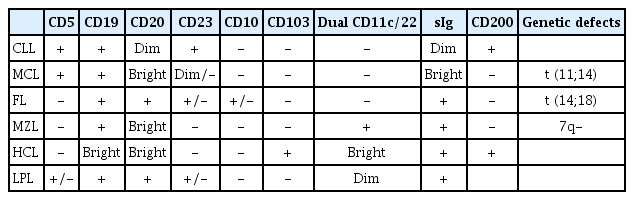
CLL은 말초혈액에서 B 림프구가 5 × 109/L 이상 3개월 이상 지속되고 유세포 분석(flow cytometry)을 통한 면역표현형 검사(immunophenotyping)에서 B 림프구의 단클론성(monoclonality)이 확인되면 진단이 된다[9]. CLL은 T세포의 항원인 CD5를 비롯하여 B세포의 항원인 CD19, CD20, CD23이 함께 발현되며, 이때 CD20은 정상 B세포에 비해 약하게 발현되고 카파(kappa) 또는 람다(lambda) 면역글로불린 경쇄(immunoglobulin light chain)로 제한된 표현형을 보인다. 혈액도말 검사에서 백혈병 세포들은 특징적인 작고 성숙한 B 림프구로 확인되는데, 세포가 도말 시 쉽게 부서져 보이는 검프레히스 핵 그림자(Gumprecht nuclear shadow) 또는 압좌 세포(smudge cell)는 널리 알려져 있는 CLL의 형태학적 특징들이다.
SLL은 말초혈액에서 림프구의 수가 5 × 109/L개가 되지 않고 악성림프구의 골수 침범에 의한 혈구 감소 없이 림프절 비대만 있는 경우 의심해 볼 수 있다. SLL은 종양의 침범이 의심되는 림프절 또는 장기의 조직 검사를 통해 확진할 수 있는데, 만약 다른 악성 종양이 의심되지 않고 말초혈액에서 CLL에 합당하는 면역표현형 검사 결과가 확인된다면 조직 검사 없이도 SLL을 진단할 수도 있다[9].
림프절 비대나 장기 침범이 없고 혈구 감소는 동반되지 않으나 혈액에서 단클론성의 B 림프구가 5×109/L개에는 미치지 못하는 경우를 단클론성 B 림프구 증식증(monoclonal B-cell lymphocytosis, MBL)이라 한다[14]. MBL은 정상 혈구 수치를 보이는 인구 집단에서는 5.1% 정도에서 확인되고 림프구 증가가 동반되어 있는 인구에서는 13%까지 확인된다고 한다[15]. 모든 CLL은 진단 전 MBL의 과정을 거쳐 진행하는 것으로 추정되는데[16], 림프구의 수치가 높은 MBL의 경우에는 매년 1-2%의 비율로 치료를 필요로 하는 CLL로 진행한다고 알려져 있다(Table 1) [15,17].
간혹 CLL은 다른 림프구성 종양과 감별이 어려운 경우가 있다. 털세포백혈병(hairy cell leukemia), 외투세포종(mantle cell lymphoma), 변연부림프종(marginal zone lymphoma) 또는 소포림프종(follicular lymphoma) 등인데[9], 이들의 감별 진단을 위해서는 세포 분석법에 의한 면역 염색 결과가 중요한 감별점이 되며 그 외 림프구들의 유전학적 정보도 진단에 도움이 될 수 있다(Table 2).
병기
대표적인 CLL의 병기 시스템은 각각 1975년과 1981년에 발표된 라이(Rai) 병기 시스템(Table 3)과 비넷(Binet) 병기 시스템(Table 4)이다[18,19]. 라이 병기 시스템은 처음에는 0-V까지 5개의 병기로 나누어져 있었으나, 병기 I, II 와 III, IV을 각각 중간 위험도(intermediate-risk), 높은 위험도(high-risk)로 합쳐 후에 수정된 라이(modified Rai) 병기 시스템으로 재분류되었다[20]. 이 두 병기 시스템은 모두 빈혈 및 혈소판 감소라는 혈액 검사 결과와 림프절 비대, 간 또는 비장 촉진 여부와 같은 신체 검진 결과만으로 환자의 예후를 분류하였다. 이들 시스템에 따르면 낮은 위험군(low-risk: Rai 0; Binet A)은 15년에 가까운 평균 생존을 보이고, 중간 위험군(intermediate-risk: Rai I or II; Binet B)은 5-7년 그리고 가장 높은 위험군(high-risk: Rai III or IV; Binet C)은 3-4년의 평균 생존을 보인다고 알려졌다[21]. 라이와 비넷 병기 시스템은 매우 간단하여 임상에서 쉽게 적용이 가능하다는 장점이 있으나 낮은 위험군으로 분류되는 환자들의 예후를 정확히 예측을 할 수 없다는 단점이 있다. 왜냐하면 무증상일 때 림프구 증가만으로 CLL이 진단되는 경우가 많아 환자의 80% 정도가 첫 진단 시 낮은 위험군으로 분류되는데[21], 이러한 경우 향후 공격적으로 진행할 가능성이 있는 CLL 환자들도 첫 진단 시에 뚜렷하게 구분할 수 없기 때문이다.
지난 30년간 CLL 환자의 예후와 관련된 여러 인자들에 대한 지식이 쌓임에 따라 라이 및 비넷 병기 시스템의 한계점을 극복할 수 있는 새로운 예후 예측 시스템이 제안되고 있다. 그중 대표적인 것이 2016년에 발표된 CLL 국제 예후인자(CLL international prognostic index, CLL-IPI)이다[22]. CLL-IPI는 환자의 5가지 독립적인 예후인자: del(17p) 또는 TP53 변이 여부, 면역글로불린 중쇄 변수(immunoglobulin heavy chain variable, IGHV) 변이, 베타-2 마이크로글로불린 (beta-2 microglobulin) 상승, 라이 병기 시스템, 나이에 대해 각기 다른 가중치를 두어 낮은 위험도(low risk)부터 매우 높은 위험도(very high risk)까지 총 4단계로 환자를 분류하였다. CLL-IPI 시스템에 따르면 낮은 위험도로 분류되는 환자의 5년 생존율은 93.2%였으며 높은 위험도로 분류되는 환자의 5년 생존율은 23.3%로 확인되었다[22].
예후
세포 유전학적 이상(cytogenetics abnormalities)
CLL 환자들의 80%는 적어도 한 가지 이상의 세포 유전학적 이상 소견을 보인다고 알려져 있다[23]. 가장 흔한 이상 소견은 13번 염색체 장완 결손(del[13q])으로 환자의 55% 정도에서 확인되며, 11번 염색체 장완 결손(del[11q]), 17번 염색체 단완 결손(del[17p]), 12번 삼염색체 이상(add[12])은 각각 18%, 16%, 7% 정도의 환자에서 보고되었다[23]. 단독으로 del(13q)만 가진 환자는 매우 좋은 예후를 보여 정상 염색체의 CLL 환자보다도 긴 133개월의 평균 생존율을 보이며 클론의 진화(clonal evolution) 가능성도 낮아 공격적인 형태의 CLL로 진행할 가능성이 낮다고 알려져 있다[23]. Del(11q)은 젊은 사람에게 좀 더 흔하고 B 증상이나 림프절 비대 등이 동반되는 경우가 많으며 나쁜 예후와 관련이 있다고 한다[24]. Del(17p)는 종양 억제 유전자(tumor suppressor gene)인 TP53과 관련이 있으며 CLL 환자에서 매우 나쁜 예후를 보여주는 것으로 알려졌는데, del(17p)를 가진 환자의 평균 생존율 32개월로 보고되기도 하였다[23]. 특히 del(17p)를 가진 CLL 환자는 알킬레이팅(alkylating) 약제 또는 퓨린 유사체(purine analogues) 약제를 사용하는 전통적인 항암화학요법(chemotherapy)이나 단클론 항체를 함께 사용하는 화학면역요법(chemoimmunotherpay)에 치료 반응이 나쁜 것으로 알려져 있어 CLL 치료의 큰 방해요소로 남아 있었다. 그러나 최근 개발된 소분자억제제(small-molecule inhibitors)들은 del(17p) 및 TP53을 가진 환자에서도 우수한 치료 효과를 보이고 있다.
염색체 검사에서 3개 이상의 각기 다른 핵형을 보이는 복잡한 핵형(complex karyotype, CK ≥ 3)은 CLL 환자의 나쁜 예후와 관련이 있는 것으로 알려졌다. 복잡한 핵형은 del(17p), del(11p), 돌연변이가 없는 IGHV 등 CLL에서 이미 잘 알려진 나쁜 예후인자들을 가진 환자들에서 더욱 높은 비율로 존재하며, 이러한 환자들의 예후를 더욱 악화시키는 요인으로 확인되었다[25]. 몇몇 연구에 의하면 이브루티닙(ibrutinib) 기반으로 치료를 받는 재발/불응(relapsed/refractory, R/R) CLL 환자들에서 복잡한 핵형은 del(17p)보다 더욱 강력한 나쁜 예후인자로써[26], 5개 이상의 복잡한 핵형은 그 자체가 독립적으로 환자의 열등한 생존율과 관련이 있다는 것이 확인되기도 하였다[27].
면역글로불린 중쇄 가변 부위의 돌연변이(immunoglobulin heavy chain variable [IGHV] mutation)
B 림프구의 분화 과정 중 일어나는 면역 글로불린의 중쇄 가변 부위의 돌연변이는 CLL 환자의 예후와 밀접하게 연관이 있어, IGHV 돌연변이(mutated IGHV)가 있는 CLL 환자들은 90% 이상이 비넷 병기 A로 분류되고 또한 60% 이상이 del(13q)를 함께 가지고 있어 좋은 예후와 관련이 있을 것으로 보고되었다[28]. 반면 돌연변이가 없는 IGHV (unmutated IGHV)는 여러 연구를 통해 환자의 나쁜 생존율과 매우 관련이 깊음이 확인되었다[28,29]. 특히 IGHV 변이 여부는 초기 병기의 CLL 환자의 예후와 깊은 관련이 있어 비넷 병기 A 환자에서 IGHV 돌연변이가 있는 경우는 24년의 평균 생존율을 보였으나 돌연변이가 없는 IGHV 환자는 7.9년의 짧은 평균 생존율을 보였다[29]. 최근의 연구에서도 치료를 받지 않은 초기 병기의 CLL 환자에서 del(17p)나 TP53가 동반된 경우는 첫 치료까지의 시간(time to first treatment, TTFT)에 차이가 없었으나 돌연변이가 없는 IGHV를 지닌 환자는 짧은 TTFT를 보여주어, IGHV 돌연변이 여부는 초기 병기의 CLL 환자의 예후 예측에 매우 중요한 역할을 할 것으로 생각된다[30].
혈청 마커(serum markers)
혈청 검사상 베타 2 마이크로글로불린(beta-2 microglobulin, B2MG)의 상승은 CLL 환자의 나쁜 생존율과 관련이 있다는 것이 밝혀졌는데[31], B2MG 값은 고식적인 항암화학요법부터 이브루티닙과 같은 최신 치료제까지 치료의 종류와 무관하게 환자의 예후와 관련이 있는 것을 확인되었다[32,33]. 한편 혈청 내 티아민 키나제(thymine kinase) 농도 및 용해 가능한 CD23 (soluble CD23) 값도 CLL 환자의 예후와 관련이 있다고 알려져 있다[24].
면역표현형 마커(immunophenotyping marker) 및 돌연변이(mutation)
CD38는 세포 신호 전달에 관여하는 세포막 수용체로서 CLL 세포에서 CD38의 높은 발현은 CLL 환자의 불량한 예후와 관련이 있다고 알려졌다[34]. ZAP-70은 T세포와 자연 살해 세포(natural killer cell)에 발현되는 수용체로 정상 B세포에서는 발현되지 않으나 악성 B세포에서 발현되는데, CLL 세포에서 ZAP-70의 발현은 환자의 나쁜 예후와 관련이 있다고 한다[35]. 이는 ZAP-70의 발현이 CLL 세포에서 B세포 수용체 콤플렉스(B-cell receptor [BCR] complex) 신호 전달을 강화하여 좀 더 공격적인 성향에 기여하기 때문으로 추정된다[36]. 한때 CD38과 ZAP-70 발현이 돌연변이가 없는 IGHV를 반영하는 대표 마커로의 가능성이 알려지기도 하였으나, 나쁜 세포 유전학적 이상 소견을 가지는 환자군에서 IGHV의 돌변 변이는 없으나 ZAP-70이 발현되지 않는 환자들이 오히려 더욱 많아 이 둘의 상관관계는 반드시 절대적이지는 않을 것으로 생각된다[37].
최근에는 차세대 염기 서열 검사법(next generation sequencing)이 활발히 연구에 이용되면서 유전자 변이가 환자와 예후와 관련이 있음이 밝혀지고 있는데, NOTCH1, SF3B1과 같은 변이들이 CLL 환자의 짧은 생존율과 관련이 있음이 알려졌다[38,39].
치료
CLL은 다른 백혈병에 비해 비교적 양호한 예후를 보이는 질환으로, 무증상의 초기 병기일 경우 치료를 하지 않고 경과 관찰하는 “watch-and-wait” 전략을 고수하다 증상이 발생하거나 병이 진행하는 소견이 보이면 치료를 시작한다. 클로람부실(chlorambucil)이나 플루다라빈(fludarabine)과 같은 세포 독성 항암제가 CLL의 주 치료제였으나 최근 B세포의 신호전달경로를 차단하는 브루톤 티로신 키나제(Bruton’s tyrosine kinase, BTK) 억제제, 포스파티딜이노시톨 3-키나제(phosphatidylinositol 3-kinase, PI3K) 억제제 및 B세포 림프종 2 (B cell lymphoma 2, Bcl-2) 억제제와 같은 표적 치료제가 개발되어 임상에서 매우 우수한 성적을 보임에 따라 CLL 치료는 세포 독성 항암 치료에서 세포 독성 항암 없는(chemo-free) 약제로 치료의 패러다임이 현재 급격히 변하고 있다.
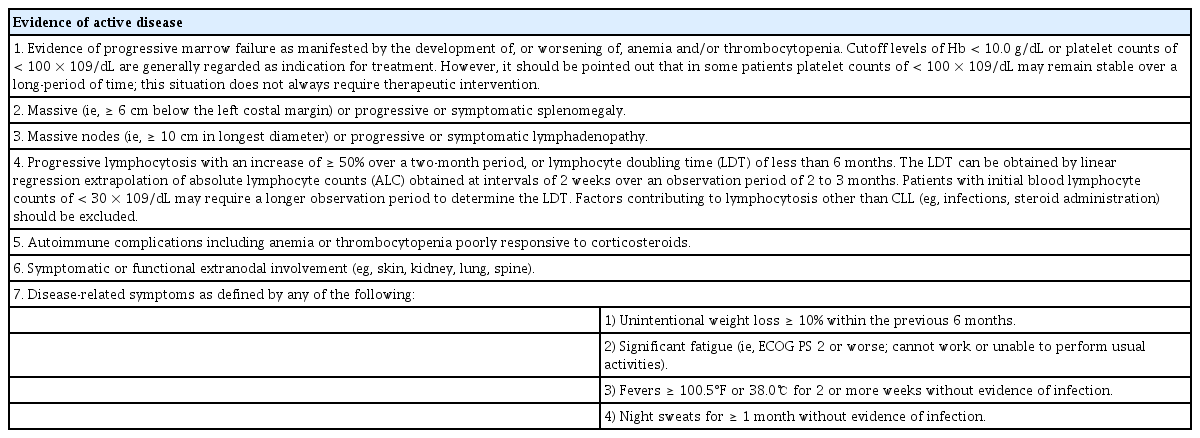
IwCLL의 치료 지침에 의하면 라이 병기 III, IV/비넷 병기 C와 같이 진행된 병기의 환자는 증상 조절 및 생존율 향상을 위해 진단 직후 치료를 시행한다[9]. 그러나 라이 병기 0/비넷 병기 A 와 같은 초기 병기의 환자나 라이 병기 I, II/비넷 병기 B 와 같은 중간 병기의 환자들은 질병이 진행하는 증거나 질병과 관련된 증상이 없다면 치료하지 않고 경과 관찰하다 다음과 같은 질병 활성화(active disease)의 증거가 확인되면 치료를 시작한다(Table 5) [9].
세포 독성 항암화학요법(cytotoxic chemotherapy)
알킬화 약제 중 한 가지인 클로람부실(chlorambucil)은 과거 수십 년간 CLL 환자에 있어 표준 치료로 자리하였다. 그러나 클로람부실은 CLL 환자에 있어 증상의 호전은 도왔으나 환자의 생존에 이득이 있는지는 명확하지 않았고 완전 관해의 획득이 어렵다는 단점이 있었다[40].
이후 플루다라빈(fludarabine)과 같은 퓨린 유사체(purine analogue)가 B세포 림프종에서 효과를 보이며 CLL 치료에 도입되어 우수한 치료 효과를 보여주었는데, 클로람부실과 비교 연구에서 플루다라빈은 63% vs. 37%로 더 나은 치료 반응률과 각각 20개월 vs. 14개월로 더 긴 질병 무진행 생존율(progression free survival, PFS)을 보여주었다[41]. 이후 플루다라빈은 클로람부실의 뒤를 잇는 CLL 치료의 표준이 되었으며, 클로람부실은 낮은 독성의 장점이 있어 고령이거나 동반질환을 가진 환자들에게 선택적으로 사용되게 되었다. 플루다라빈의 다른 약제를 병합하는 연구에서 사이클로포스파마이드(cyclophosphamide)와 병합 연구는 매우 성공적이었는데, 치료를 받지 않은 CLL 환자에서 플루다라빈 단독에 비해 94% vs. 83%로 높은 치료 반응과 24% vs. 7%의 높은 완전 관해율(complete remission) 그리고 48개월 vs. 20개월로 2배 이상의 긴 질병 PFS를 보여주었다[42].
벤다무스틴(bendamustine)은 과거 동독에서 개발되어 오랫동안 동독에서만 사용되다 외부에 알려진 약물로 알킬화 약제이나 퓨린 유사체의 대사저해 기능을 함께 가지는 약이다. CLL 환자에서 벤다무스틴은 클로람부실 또는 플루다라빈에 비해 모두 우수한 치료 반응률과 생존율을 보여주었으며, 한편 혈구 감소 등의 부작용은 더욱 심하게 관찰되었다[43,44].
단클론항체(monoclonal antibody)
대부분의 B세포 기원의 혈액암은 세포 표면에 CD20을 발현하며, CLL 역시 B세포가 단클론 증식하는 질환으로 CD20을 발현한다. 이를 표적으로 하는 단클론 항체 치료제가 림프종에 사용되었으며 CLL도 예외는 아니었다.
리툭시맙(rituximab)은 B세포 계열의 림프종을 비롯하여 CD20을 발현하는 혈액암에 사용하는 대표적인 치료제로, 기존 세포독성화학 약제와 병합하였을 때 시너지 효과를 보여주었다. 치료받지 않은 CLL 환자 817명의 무작위 배정 3상 연구에서, 플루다라빈-사이클로포스파마이드(fludarabine-cyclophsphamide, FC)에 리툭시맙을 병합하여 치료한 경우 FC에 비해 44% vs. 22%의 높은 완전 관해율과 65% vs. 45%로 우수한 3년 무병 진행률을 보여주었다[45]. 부작용 분석에서 혈구 감소와 같은 독성은 리툭시맙을 병합한 환자들에서 높게 확인되었으나 감염의 발생은 두 군에서 큰 차이 없음이 확인되어 FC와 리툭시맙(FC-rituximab, FCR) 병합 요법은 CLL 치료의 표준으로 떠올랐다[45]. 그러나 하위 그룹 분석에서 del(17p)을 가진 22명의 환자에서 오직 1명만이 FCR에 완전 관해를 획득하여, 리툭시맙을 병합하여도 del(17p)의 한계를 극복하지는 못하였다[45]. 한편 FCR은 IGHV 변이가 있는 경우에 좋은 효과를 보여주어[46], 현재 FCR 은 del(17p)를 동반하지 않는 65세 미만의 환자에서 IGHV 변이가 있는 경우 첫 치료제로 권장되기도 한다. 리툭시맙을 벤다무스틴(bendamustine-rituximab, BR)에 병합하는 연구도 시행되었는데, 이전에 치료받지 않은 CLL 환자에게 투여 시 88%의 반응률과 23.1%의 완전 관해율을 보여주어 효과적인 면역화학 치료요법으로 자리잡았다[47]. 그러나 BR도 del(17p)를 가진 환자군에서는 37.5%의 낮은 치료 반응률과 한 명의 환자도 완전 관해를 보이지 못하여 del(17p)의 높은 벽을 넘지는 못하였다[47]. FCR과 BR의 비교 연구가 시행된 적이 있는데, FCR 이 치료 반응률, 완전관해 획득률, 무병진행률 모두에서 우수하였으나 심각한 감염이나 혈구 감소 부작용이 FCR에서 높게 확인되어 고령이거나 동반 질환이 있다면 FCR보다는 BR이 더 권장된다[48].
또 다른 CD20에 대한 단클론 항체인 오비누투주맙(obinutuzumab)은 리툭시맙에 비해 CD20에 더욱 강하게 결합하여 세포 사살 효과가 뛰어나다고 알려져 있다. 재발/불응 CLL에서 오비누투주맙은 단독 사용만으로도 30%의 반응률을 보여주었으며[49], 첫 치료 CLL 환자에서도 67%까지 비교적 높은 반응률을 보여 단독 치료제로의 가능성이 확인되었다[50]. 특히 동반 질환으로 인해 강력한 항암 치료가 어려운 환자들에서 오비누투주맙과 클로람부실을 병합치료는 약제 독성은 견딜만하지만 거의 80% 정도의 치료 반응률과 26.7개월의 평균 무병 진행 기간을 보여 65세 이상이거나 또는 65세 미만에 동반 질환이 많은 환자들에게 권장되는 요법 중 하나이다[51]. 한편 오비누투주맙은 최근 개발되고 있는 BTK 억제제나 Bcl-2 억제제 등과 병합하였을 때 매우 뛰어난 효과를 보여주어 아칼라브루티닙(acalabrutinib)이나 베네토클락스(ventoclax) 등과 함께 병합 사용되고 있다.
CD52에 대한 단클론 항체인 알렘투주맙(alemtuzumab)은 del(17p)나 TP53 변이가 있는 환자군들에서 비교적 좋은 성적을 보여준 단클론 항체로, 플루다라빈에 반응이 없는 36명의 환자에게 알렘투주맙 투여시 TP53가 없는 환자들에서는 19% (4/21)의 치료 반응률만 보였으나 TP53을 가진 환자들에서는 40% (6/15)의 반응률을 보여주었다[52].
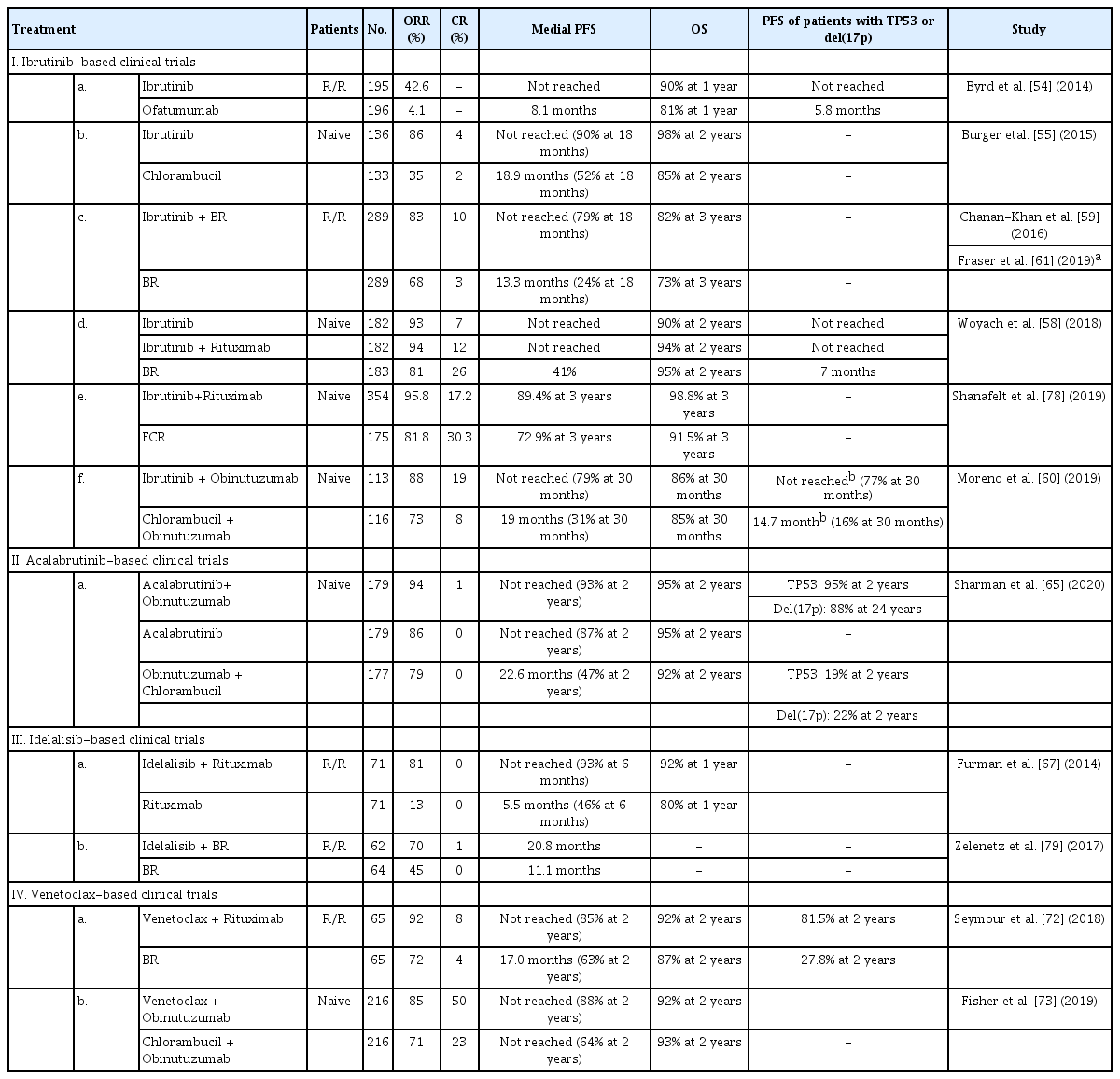
소분자억제제(small-molecule inhibitors) (Table 6)
암은 세포 내외에서 세포 신호 전달과 관련된 경로들이 부족절하게 조절되어 세포의 증식과 생존이 지속되는 현상이다. 이런 신호 전달 과정에 참여하는 물질을 억제하는 것은 암세포의 증식을 막을 수 있는 방법으로 생각되어 왔는데, 이러한 세포 신호 전달 경로를 억제할 수 있는 일련의 표적 치료제들을 소분자억제제라고 한다[53]. CLL은 이러한 소분자억제제들이 치료의 최전방에서 활약하고 있는 대표적인 질병으로, CLL의 BCR 신호 전달 경로에서 BTK와 PI3K를 표적으로 하는 이브루티닙(ibrutinib), 아칼라브루티닙(acalabrutinib) 그리고 이데라리십(idelalisib)이 현재 활약하고 있는 소분자억제제들이다.
브루톤 티로신 키나제 억제제(Bruton tyrosine kinase, BTK inhibitor)
이브루티닙은 BTK 억제제로서 B세포 기원의 림프종에서 그 효과를 입증 받았으며 CLL 환자에서도 매우 효과적인 치료제임이 밝혀졌다. 재발/불응 CLL 환자에서 오파투무맙(ofatumumab)과의 3상 비교 연구에서 이브루티닙은 전체 반응률 42.6%로 오파투무맙 4.1%에 비해 매우 우수한 치료 효과를 보여주어[54], 2014년 미국 FDA에 의해서 신속 승인(accelerated approval)을 받게 되었다. 이전에 치료받은 적 없는 CLL 환자에서도 클로람부실에 비해 이브루티닙은 치료 반응률 86% vs. 35%로 높은 치료 반응률과 평균 무병 진행률은 도달하지 않음 vs. 18.9개월로 긴 치료 지속성을 보여주었다[55]. 이브루티닙은 기존 고위험으로 분류되어 고식적인 항암 치료나 단클론 항체 치료에도 쉽게 반응하지 않던 del(17p) 및 TP53을 가진 환자들에게도 치료 효과가 우수하여[56] 환자의 병기, 나쁜 예후인자, 나이, 동반 질환 등에 무관하게 현재 우선 치료제로 권장되고 있다. 한 편에서는 이브루티닙과 다른 약제의 병합 연구들이 행해졌는데, 이브루티닙과 리툭시맙과 병합 치료는 이브루티닙 단독 사용에 대비하여 우월함이 확인되지 않아 이브루티닙 단독 치료는 여전히 유효하다[57,58]. 그러나 이브루티닙과 BR 병합 치료 또는 오비누투주맙 병합 치료 등이 연구는 나쁘지 않은 성과를 보여주고 있다[59-61].
실제 임상에서 이브루티닙을 사용하는 환자가 늘어나고, 재발 또는 치명적인 독성 발생 전까지 장기간 약제를 사용함에 따라 이브루티닙과 관련한 부작용이 중요해지고 있다. 특히 치명적인 출혈이나 심방세동, 감염의 증가 등이 이슈인데, 이브루티닙 임상 연구에 참가했던 136명의 5년 추적 결과에 의하면 전체 환자의 11%, 16% 및 9%가 각각 주요한 출혈, 심방세동, 및 폐렴을 경험하였으며, 14%의 환자가 부작용으로 인해 약제를 중단하였음이 확인되었다[62]. CLL의 환자 대부분이 고령이고 혈관 질환이나 심장 질환 등 한 가지 이상의 기저 질환을 가지고 있는 경우가 89%까지 보고되고 있어[63], 이브루티닙 시작 시에 환자의 기저 질환과 이에 대한 고려가 필요하다. 또한 이브루티닙 사용 시 호중구 감소나 스테로이드의 사용력이 없음에도 침습성 곰팡이 감염이 일어나는 경우들이 자주 보고되고 있어 이브루티닙 사용 중 곰팡이 감염에 대한 주의 역시 필요하겠다[64]. 아칼라브루티닙은 2세대 BTK 억제제로 단독 사용 또는 오비누투주맙과의 병용사용에서 매우 좋은 효과를 보여주어[65], 이브루티닙과 함께 CLL 에서 첫 치료제로 권장되고 있다.
포스파티딜이노시톨 3-키나제 억제제(phosphatidylinositol 3-kinase, PI3K, inhibitor)
이전 여러 종류의 약제로 치료 한 재발/불응 CLL 환자 54명에게 PI3K 억제제인 이데라리십(idelalisib)을 투여하였을 때 전체 환자의 72%가 치료에 반응을 보여주었고 평균 무병 진행 기간은 15.8개월이라는 놀라운 수치를 보여주었다[66]. 해당 연구에서 거대한 림프절 비대를 가지거나 돌연변이가 없는 IGHV, del(17p) 또는 TP53과 같이 나쁜 예후인자를 가진 환자들이 다수 포함되어 있었는데, 이러한 점까지 감안하면 이데라리십은 기존 치료제에 실패한 환자에게 선택할 수 있는 매우 효과적인 2차 약제이다[66]. 리툭시맙과 병용 연구에서도 이데라리십-리툭시맙은 81%의 반응률과 92%의 1년 전체 생존율로 좋은 결과를 보여 주었다[67].
B세포 림프종 2 억제제(B cell lymphoma 2 [Bcl-2] inhibitor)
B세포 림프종 2 (B cell lymphoma 2, Bcl-2)는 세포 자멸사를 조절하는 단백질로 CLL 세포가 사멸하는 것을 막고 계속 생존하게 함으로 종양 세포의 증식을 유도한다[68]. BH3-유사체는 Bcl-2를 억제하여 세포 자멸사를 유도하는 소분자억제제로 베네토클락스(venetoclax)가 대표적이다. 베네토클락스가 불응/재발 CLL 환자에서 효과가 있음이 처음 확인된 이후[69], del(17p)와 같이 고위험인자들을 가진 환자군의 연구에서도 그 치료 효과가 입증되었다[70]. 특히 이브루티닙이나 이데라리십과 같은 다른 계열의 소분자억제제를 사용하고 재발한 환자들에게 베네토클락스를 사용하여도 65%, 67%의 높은 치료 반응률을 보여주어[70,71], CLL은 세포 독성 항암제 없는(chemo-free) 약제로 치료를 이어갈 수 있는 질환이 되었다. 베네토클락스는 리툭시맙이나 오비누투주맙과 같은 단클론 항체와 병합 연구에서도 치료 효과가 매우 우수하였는데, 재발/불응 CLL에서 del(17p)의 유무에 상관없이 2년 무병 진행률은 84.9%로 해당 연구에서 BR을 사용한 환자들이 36.3%의 2년 무병 진행률을 보여주었던 것에 비해 2배 이상이나 높은 수치였다[72]. 여러 가지 기저 질환을 가졌으며 이전에 치료받은 적이 없는 CLL 환자군의 베네토클락스-오비누투주맙과 클로람부실-오비누투주맙의 비교 연구에서는 2년 무병 진행률이 각각 88.2% vs. 64.1%로 베네토 클락스-오비누투주맙을 사용한 환자군이 높았고, 중성구 감소나 감염과 같은 부작용이 다소 높게 관찰되었으나 모두 견딜 만한 정도여서[73], 베네토클락스-오비누투주맙 병용 치료는 환자의 병기, 나쁜 예후인자, 나이, 동반 질환 등에 상관 없이 치료 받지 않은 CLL 환자에서 첫 치료로 사용이 권장되고 있다. 다만 베네토클락스는 첫 투여 시 종양용해증후군이 발생할 가능성이 있어 베네토클락스 시작 시에는 환자의 종양의 부담이나 림프구 증가 정도를 고려하여 적절하게 예방조치를 시행하고 천천히 약제 용량을 올리는 전략이 동반되어야 한다[70].
동종 조혈모세포 이식
동종 조혈모세포 이식은 CLL 환자에서 완치를 기대할 수 있는 방법 중의 하나이나 이식 과정 중 발생할 수 있는 사망률이나 이식 이후의 이식편대숙주 반응 등의 위험을 고려해야 한다. Del(17p)나 TP53과 같은 기존 항암 화학 치료나 항암 면역 치료에 반응하지 않거나 재발하는 경우 이식이 하나의 선택이 될 수 있으나[74], del(17p)에서도 우수한 효과를 보이는 약제 들이 속속 개발되고 있어 CLL에서 조혈모세포의 이식의 역할은 줄어들 전망이다.
결 론
최근 소분자억제제들 중 어느 약제를 우선으로 사용하는 것이 환자들의 생존에 이득이 있을지, 소분자억제제들끼리 병합요법은 어떠한 효과가 있을지에 대한 연구도 진행되고 있어 CLL의 치료는 더욱 발전해 나아갈 전망이다[75]. 또한 분자 유전학적 정보를 바탕으로 CLL의 환자들의 위험도를 세분화 할 수 있는 토대가 마련되고, 복용하기 수월하고 비교적 부작용도 적은 소분자억제제들이 속속 개발됨에 따라 무증상이나 나쁜 예후인자를 가지고 있는 환자들에 대한 선제적 치료에 대한 연구도 이루어 지고 있다. 현재 무증상의 CLL 환자들에게 이브루티닙을 투여하는 연구가 진행되고 있는데[76], 증상이 발생하기 전까지의 시간(event free survival) 및 다음 치료까지 걸리는 시간(time to next treatment) 등에서 우수함을 보여주었으나[77], 전체 생존율에 대한 결과는 아직 발표되지 않아 그 결과가 기대된다.
CLL이 국내에서 흔한 백혈병은 아니나 임상 현장에서 림프구 증가가 지속적으로 확인되는 환자를 만난다면 CLL을 반드시 의심해야 한다. 더욱이 최근과 같이 환자 수가 증가하고 있는 추세라면 적극적으로 진단을 위한 추가 검사 등을 고려해야 한다. 아직 국내 환자들이 서구와 어떻게 다른 유전적 변이를 가지는지, 예후는 어떻게 다를지 그리고 소분자억제제 등에 대한 치료 반응은 어떨지 등 뚜렷하게 알려진 바는 없어 국내 CLL 환자들에 대한 체계적인 연구와 치료의 근거 마련을 위한 관심과 노력이 필요하겠다. 또한 미국이나 유럽에서는 이브루티닙이나 베네토클락스와 같은 소분자억제제가 첫 치료제로 인정되고 있으나, 국내에서는 아직 이전에 한 가지 이상의 약제로 치료를 받은 적이 있는 환자들에게서만 이들 약제들이 급여 인정되고 있어, 이전 치료받지 않은 국내 CLL 환자들에게 소분자억제제가 첫 번째 치료제로 선택된다면 장기적으로 어떤 예후 개선 효과가 있을지에 대한 연구도 시급한 과제이다.