71ņäĖ ļé©ņ×É ĒÖśņ×ÉĻ░Ć ļæÉ ļŗ¼ ņĀäļČĆĒä░ ļ░£ņāØļÉ£ ņŗØĒøä ņāüļ│ĄļČĆ ĒåĄņ”ØĻ│╝ ņŗØņÜĢ ļČĆņ¦äņØä ņŻ╝ņåīļĪ£ ļé┤ņøÉĒĢśņśĆļŗż. ņØ┤ļ¤░ ņ”ØņāüņØĆ ļé┤ņøÉ 1ļģä ņĀäļČĆĒä░ Ļ░Ćļüöņö® ļéśĒāĆļé¼ļŗż ĒĢśĻ│Ā, ņØĖĻĘ╝ ļ│æņøÉņØä ļ░®ļ¼ĖĒĢśņŚ¼ ņŗżņŗ£ĒĢ£ ņśüņāü Ļ▓Ćņé¼ņŚÉņä£ ņĘīņן ļæÉļČĆņŚÉ 4.5 cm Ēü¼ĻĖ░ņØś ņĘīņן ņóģĻ┤┤Ļ░Ć ļ░£Ļ▓¼ļÉśņ¢┤ ņČöĻ░Ć ĒÅēĻ░Ćļź╝ ņ£äĒĢ┤ ļ│ĖņøÉņ£╝ļĪ£ ņĀäņøÉļÉśņŚłļŗż. ĒÖśņ×ÉļŖö ļ░®ļ¼Ė 10ļģä ņĀä ņןĒīīņŚ┤ļĪ£ ņן ņĀłņĀ£ņłĀņØä ņŗ£Ē¢ēļ░øņĢśļŗż. ĻĖ░ņĀĆ ņ¦łĒÖśņ£╝ļĪ£ ļŗ╣ļć©ļ│æņØ┤ ņ׳ņ¢┤ņä£ ļ│ĄņĢĮ ņżæņØ┤ņŚłņ¦Ćļ¦ī ĻĘĖ ņÖĖ ņĀäņŗĀ ņāüĒā£ļŖö ņ¢æĒśĖĒĢśņśĆļŗż. 1ņŻ╝ņØ╝ņŚÉ ņåīņŻ╝ 1ļ│æ ņĀĢļÅä ļ¦łņŗ£ļŖö ņØīņŻ╝ļĀźņØä Ļ░Ćņ¦ĆĻ│Ā ņ׳ņŚłņ£╝ļéś, ĒØĪņŚ░ņØĆ ļČĆņØĖĒĢśņśĆļŗż. ĒŖ╣ņØ┤ ņĀäņŗĀ ņ”ØņāüņØĆ ņŚåņŚłņ£╝ļ®░, ņŗĀņ▓┤ ņ¦äņ░░ņŚÉņä£ļÅä ĒŖ╣ņØ┤ ņØ┤ņāü ņåīĻ▓¼ņØĆ ņŚåņŚłļŗż. ļ¦Éņ┤ł ĒśłņĢĪ Ļ▓Ćņé¼ņŚÉņä£ ļ░▒ĒśłĻĄ¼ 5,620 /mm3, Ēśłņāēņåī 13.4 g/dL, ņ┤Ø ļ╣īļ”¼ļŻ©ļ╣ł(total bilirubin) 1.5 mg/dL, ņĢäņŖżĒīīĒģīņØ┤ĒŖĖņĢäļ»ĖļģĖņĀäņØ┤ĒÜ©ņåī 75 IU/L, ņĢīļØ╝ļŗīņĢäļ»ĖļģĖņĀäņØ┤ĒÜ©ņåī 33 IU/L, ņĢīņ╣╝ļ”¼ņä▒ņØĖņé░ļČäĒĢ┤ĒÜ©ņåī 132 IU/LņśĆļŗż. Ēśłņ▓ŁņĢäļ░ĆļØ╝ņĢäņĀ£ 107 U/L, Ēśłņ▓Łļ”¼ĒīīņĢäņĀ£ 72 U/LņśĆĻ│Ā, ņóģņ¢æĒæ£ņ¦Ćņ×É Ļ▓Ćņé¼ņŚÉņä£ carcinoembryonic antigen (CEA)ņØĆ 3.3 ng/mL, carbohydrate antigen 19-9 (CA19-9)ļŖö 88 U/mLņśĆļŗż. ĒāĆ ļ│æņøÉņŚÉņä£ ļ│ĄļČĆ ņĀäņé░ĒÖöļŗ©ņĖĄņ┤¼ņśü (computed tomography, CT) (Fig. 1A), ļ│ĖņøÉņŚÉņä£ ņ×ÉĻĖ░Ļ│Ąļ¬ģļŗ┤ņĘīĻ┤ĆņĪ░ņśüņłĀ(magnetic resonance cholangiopancreatography, MRCP) (Fig. 1B), ņŗŁņØ┤ņ¦ĆņןĻ▓Į(Fig. 2A), ņ┤łņØīĒīīļé┤ņŗ£Ļ▓Į(Fig. 2B) Ļ▓Ćņé¼ļź╝ ļ░øņĢśĻ│Ā, ļ│æļ”¼ Ļ▓Ćņé¼ Ļ▓░Ļ│╝(Fig. 3)ļŖö ļŗżņØīĻ│╝ Ļ░ÖņĢśļŗż. ņĀüņĀłĒĢ£ ņ¦äļŗ©ņØĆ?
ņ×äņāüĻ▓ĮĻ│╝
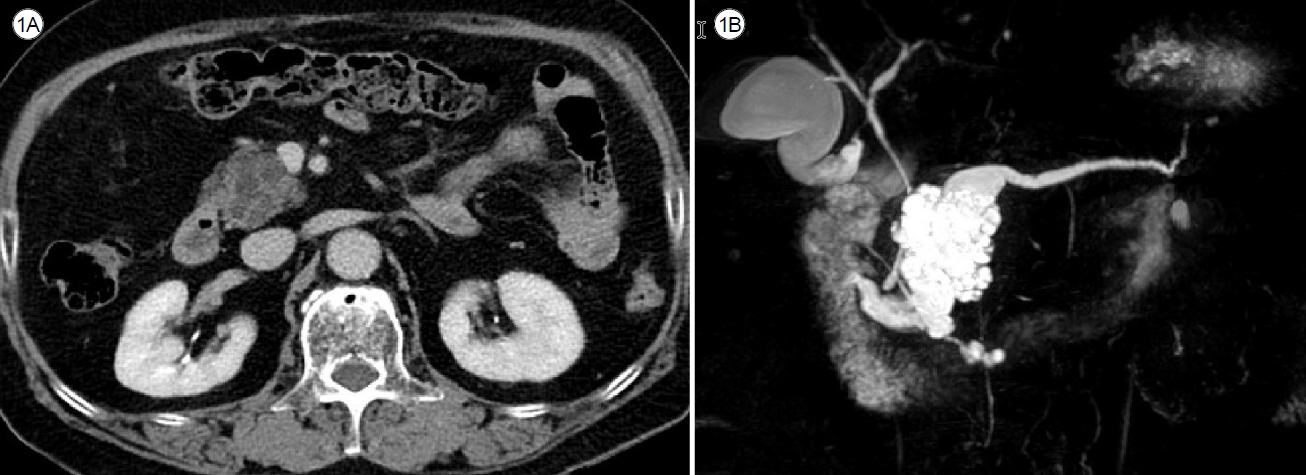
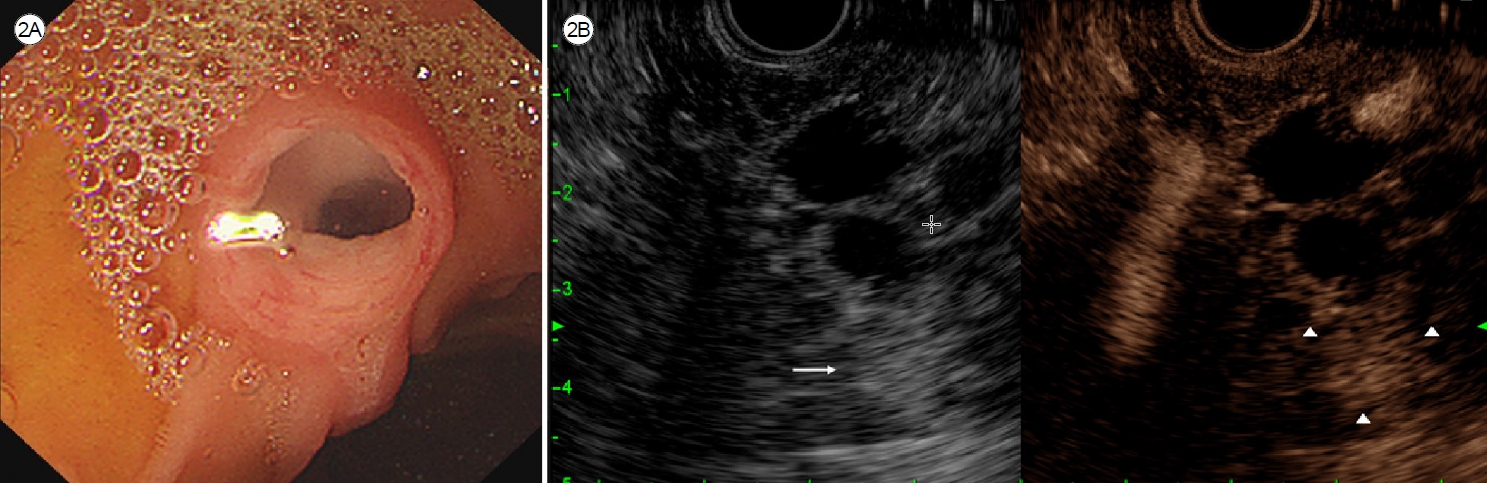
ĒāĆ ļ│æņøÉņŚÉņä£ ņŗ£Ē¢ēĒĢ£ ļ│ĄļČĆCTņŚÉņä£ ņĘīņן ļæÉļČĆņŚÉ 4.5 ├Ś 4.1 cm Ēü¼ĻĖ░ņØś ļŗżļ░®ņä▒(multilocular) ļéŁņä▒ņóģņ¢æņØ┤ ļ░£Ļ▓¼ļÉśņŚłļŗż(Fig. 1A). ļ│ĖņøÉ ļé┤ņøÉ ņØ┤Ēøä ņŗ£Ē¢ēĒĢ£ MRCPņŚÉņä£ T1-Ļ░ĢņĪ░ņāü ņĀĆĻ░ĢļÅä(low signal intensity), T2-Ļ░ĢņĪ░ņāü Ļ│ĀĻ░ĢļÅä(high signal intensity)ņØś ĻĘĀņ¦łĒĢ£ ņŗĀĒśĖĻ░Ć ļ│┤ņśĆņ£╝ļ®░, ļ│æļ│ĆņØĆ ņŻ╝ņĘīĻ┤ĆĻ│╝ ņŚ░Ļ▓░ļÉśņ¢┤ ņ׳ņŚłĻ│Ā, ņŻ╝ņĘīĻ┤Ć ņ¦üĻ▓ĮņØ┤ 8 mmļĪ£ ĒÖĢņןļÉ£ ņāüĒā£ņśĆļŗż(Fig. 1B). ņśüņāüĒĢÖņĀü ņåīĻ▓¼ņāüņ£╝ļĪ£ļŖö Ēś╝ĒĢ®ĒśĢ ņĘīĻ┤Ć ļé┤ ņ£ĀļæÉņāü ņĀÉņĢĪņóģņ¢æ(intraductal papillary mucinous neoplasm of the pancreas, IPMN)ņØ┤ņŚłļŗż. ļ│æļ│ĆņØś Ēü¼ĻĖ░Ļ░Ć 3 cm ņØ┤ņāüņ£╝ļĪ£ Ēü¼Ļ│Ā, ņŻ╝ņĘīĻ┤Ć ņ¦üĻ▓ĮņØ┤ 5 mm ņØ┤ņāü ĒÖĢņןļÉśņ¢┤ ņ┤łņØīĒīī ļé┤ņŗ£Ļ▓Į Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢśņśĆļŗż. ņŗŁņØ┤ņ¦ĆņןĻ▓Į Ļ▓Ćņé¼ ņåīĻ▓¼ņŚÉņä£ ĒīĮļīĆļÉ£ ņ£ĀļæÉ Ļ░£ĻĄ¼ļČĆņÖĆ ņØ┤ļź╝ ĒåĄĒĢ┤ ņĀÉņĢĪņØ┤ ĒØśļ¤¼ļéś ņśżļŖö Ļ▓āņØä ĒÖĢņØĖĒĢśņśĆļŗż(Fig. 2A). ņ┤łņØīĒīīļé┤ņŗ£Ļ▓ĮņŚÉņä£ ļŗżļ░®ņä▒ ļéŁņóģ ļé┤ņŚÉ 8 mm Ēü¼ĻĖ░ņØś ļ▓ĮĻ▓░ņĀł(mural nodule)ņØ┤ Ļ┤Ćņ░░ļÉśņŚłņ£╝ļ®░, ņØ┤ļŖö ņ▓┤ņ£ä ļ│ĆĒÖöņŚÉ ļö░ļØ╝ņä£ ņøĆņ¦üņØ┤ņ¦Ć ņĢŖņĢśļŗż(Fig. 2B). ņĪ░ņśüņ”ØĻ░Ģņ┤łņØīĒīīļé┤ņŗ£Ļ▓Įņśüņāü Ļ▓Ćņé¼ņŚÉņä£ Ļ▓░ņĀłņØĆ ņĪ░ņśüņ”ØĻ░Ģ ņåīĻ▓¼ņØä ļ│┤ņśĆĻ│Ā, ņ×ÉĻĖ░Ļ│Ąļ¬ģņśüņāü Ļ▓Ćņé¼ņŚÉņä£ļÅä ļÅÖņØ╝ ļ│æļ│ĆņØ┤ Ļ┤Ćņ░░ļÉśņŚłļŗż.
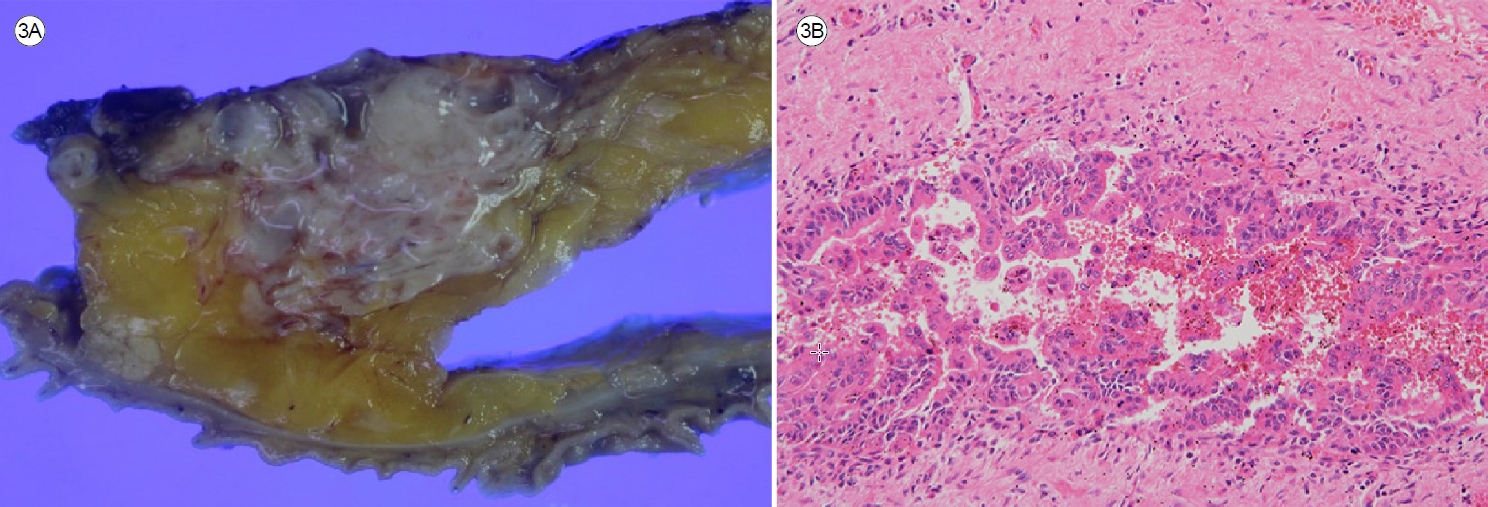
ĒÖśņ×ÉņØś ņĀäņŗĀ ņāüĒā£ļŖö ņłśņłĀņŚÉ ņĀüĒĢ®ĒĢśņśĆĻ│Ā, ļé┤ļČĆņŚÉ ļ▓ĮĻ▓░ņĀłņØä ļÅÖļ░śĒĢ£ Ēś╝ĒĢ®ĒśĢ-IPMNņ£╝ļĪ£ ĒÖĢņØĖļÉśņ¢┤ ņĢģņä▒ ļ│ĆĒÖö Ļ░ĆļŖźņä▒ņØ┤ ļåÆļŗżĻ│Ā ĒīÉļŗ©ĒĢ┤ ĒÖśņ×ÉņŚÉĻ▓ī ņłśņłĀņĀü ņĀłņĀ£ļź╝ ĻČīĒ¢łļŗż. ņØ┤Ēøä ņŻ╝ļ│Ć ļ”╝ĒöäņĀł ņĀ£Ļ▒░ņÖĆ ĒĢ©Ļ╗ś ņ£Āļ¼Ė ļ│┤ņĪ┤ ņĘīņŗŁņØ┤ņ¦Ćņן ņĀłņĀ£ņłĀ(pylorus preserving pancreaticoduodenectomy)ņØä ņŗ£Ē¢ēĒĢśņśĆļŗż. ņĀłņĀ£ļÉ£ ņĪ░ņ¦üņØś ņ£ĪņĢł ņåīĻ▓¼ņŚÉņä£ 4.7 ├Ś 4.3 cm Ēü¼ĻĖ░ņØś ļŗżļ░®ņä▒ ļéŁņä▒ ņóģĻ┤┤Ļ░Ć Ļ┤Ćņ░░ļÉśņŚłļŗż(Fig. 3A). ņłśņłĀ Ēøä ņĄ£ņóģ ļ│æļ”¼ Ļ▓Ćņé¼ņŚÉņä£ Ļ│ĀļÅä ņØ┤ĒśĢņä▒Ļ│╝ ņŻ╝ņĘīĻ┤Ć ņ╣©ņ£żņØä ļÅÖļ░śĒĢ£ Ēś╝ĒĢ®ĒśĢ-IPMNņ£╝ļĪ£ ņ¦äļŗ©ļÉśņŚłĻ│Ā, ņĀłņĀ£ļ®┤ņŚÉ ņóģņ¢æ ņ╣©ļ▓öņØĆ ņŚåņŚłņ£╝ļ®░, ļ”╝ĒöäņĀł ņĀäņØ┤ļŖö ņŚåņŚłļŗż(Fig. 3B). ņØ┤Ēøä ĒÖśņ×ÉļŖö ņØĖņŖÉļ”░ņ£╝ļĪ£ Ēśłļŗ╣ņØä ņĪ░ņĀłĒĢśĻ│Ā ņ׳ņ£╝ļ®░, ņłśņłĀ Ēøä 40Ļ░£ņøöņ¦Ė ņ×¼ļ░£ ņŚåņØ┤ ņÖĖļל ņČöņĀü Ļ┤Ćņ░░ ņżæņØ┤ļŗż.
ņ”ØļĪĆļź╝ ĒåĄĒĢ£ ņ×äņāüņĀü Ļ│Āņ░░
ļ│Ė ņ”ØļĪĆļŖö ņŗ¼ņÖĆļČĆ ļ│ĄĒåĄņØä ņŻ╝ņåīļĪ£ ļé┤ņøÉĒĢ£ ļé©ņä▒ņŚÉņä£ ņśüņāü Ļ▓Ćņé¼ ļ░Å ņ┤łņØīĒīīļé┤ņŗ£Ļ▓Į Ļ▓Ćņé¼ņŚÉņä£ ņĘīņן ļæÉļČĆņŚÉ ņĢģņä▒ ļ│ĆĒÖö ņ£äĒŚśņä▒ņØ┤ ļåÆņØĆ ļéŁņä▒ņóģņ¢æņØ┤ ļ░£Ļ▓¼ļÉśņ¢┤ ņłśņłĀ Ēøä Ļ│ĀļÅä ņØ┤ĒśĢņä▒ņØś IPMNņ£╝ļĪ£ ņ¦äļŗ©ļÉ£ ņ”ØļĪĆņØ┤ļŗż. IPMNņ£╝ļĪ£ ņ¦äļŗ©ļÉ£ ļīĆļČĆļČäņØś ĒÖśņ×ÉļŖö ņ”ØņāüņØ┤ ņŚåņØ┤ ņÜ░ņŚ░Ē׳ ļ░£Ļ▓¼ļÉśļéś ļ│ĄĒåĄ, ĒÖ®ļŗ¼, ņĘīņןņŚ╝, ļŗ╣ļć©, ņ▓┤ņżæ Ļ░Éņåī ļō▒ņØś ņ”ØņāüņØ┤ ļéśĒāĆļéĀ ņłś ņ׳ļŗż. ņ┤łņØīĒīīļé┤ņŗ£Ļ▓ĮņØĆ ļéŁņóģņØś ĒśĢĒā£ņÖĆ ļé┤ļČĆņŚÉ ļ▓ĮĻ▓░ņĀł ĒÅēĻ░Ćļź╝ ĒåĄĒĢ┤ ņĢģņä▒ĒÖö Ļ░ĆļŖźņä▒ņØä ņśłņāüĒĢĀ ņłś ņ׳ļŗż. ļ│Ė ņ”ØļĪĆņ▓śļ¤╝ Ēś╝ĒĢ®ĒśĢ-IPMNņØś Ļ▓ĮņÜ░ņŚÉļŖö ņłśņłĀņĀü ņĀłņĀ£ņłĀņØ┤ ĻČīĻ│ĀļÉ£ļŗż.
IPMNņØś Ļ░Éļ│äņ¦äļŗ©Ļ│╝ ņ╣śļŻī ņĀäļץ
IPMNņØĆ ļ░£ņāØ ņ£äņ╣śņŚÉ ļö░ļØ╝ņä£ ņŻ╝ņĘīĻ┤ĆĒśĢ(main duct type), ļČäņ¦ĆņĘīĻ┤ĆĒśĢ(branch duct type), Ēś╝ĒĢ®ĒśĢ(mixed type)ņ£╝ļĪ£ ļČäļźśļÉ£ļŗż. ņŻ╝ņĘīĻ┤ĆĒśĢņØĆ ņĀÉņĢĪņØ┤ ņŻ╝ņĘīĻ┤ĆņØä ņČ®ļ¦īĒĢśņŚ¼ 5 mm ņØ┤ņāü ĒÖĢņןļÉśņ¢┤ ņ׳Ļ│Ā, ļ¼╝Ļ│ĀĻĖ░ ņ×ģ ļ¬©ņ¢æņØś ņŻ╝ņ£ĀļæÉļĪ£ ņĀÉņĢĪņØ┤ ĒØśļ¤¼ļéśņśżļŖö Ļ▓āņØä ļ│╝ ņłś ņ׳ļŗż. ļČäņ¦ĆņĘīĻ┤ĆĒśĢņØĆ ļČäņ¦ĆņĘīĻ┤ĆņŚÉ ņŚ¼ļ¤¼ Ļ░£ņØś ĒżļÅäņåĪņØ┤ ļ¬©ņ¢æ ļéŁņä▒ ļ│æļ│ĆņØ┤ Ļ┤Ćņ░░ļÉśĻ│Ā, ņŻ╝ņĘīĻ┤ĆĻ│╝ņØś ņŚ░Ļ▓░ņä▒ņØä ņ░ŠņØä ņłś ņ׳ļŗż. Ēś╝ĒĢ®ĒśĢņØĆ ņŻ╝ņĘīĻ┤ĆĒśĢĻ│╝ ļČäņ¦ĆņĘīĻ┤ĆĒśĢņØś ĒŖ╣ņ¦ĢņØ┤ Ļ░ÖņØ┤ Ļ┤Ćņ░░ļÉ£ļŗż. ņŻ╝ņĘīĻ┤ĆĒśĢĻ│╝ Ēś╝ĒĢ®ĒśĢņØś Ļ▓ĮņÜ░ 38-68%ņØś ļåÆņØĆ ņĢģņä▒ĒÖö ļ╣łļÅäļź╝ ļ│┤ņØ┤Ļ│Ā, ļ│ĄĒåĄ, ņ▓┤ņżæ Ļ░Éņåī, ĒÖ®ļŗ¼Ļ│╝ Ļ░ÖņØĆ ņ”Øņāü ļ░£ĒśäņØ┤ ļ╣äĻĄÉņĀü ĒØöĒĢśļŗż[1,2]. ļČäņ¦ĆņĘīĻ┤ĆĒśĢņØś Ļ▓ĮņÜ░ ņ”Øņāü ļ░£ĒśäņØ┤ ļō£ļ¼╝Ļ│Ā, ņĢģņä▒ĒÖö ļ╣łļÅäĻ░Ć 12-47%ļĪ£ ņŻ╝ņĘīĻ┤ĆĒśĢņŚÉ ļ╣äĒĢ┤ ļé«ņØĆ Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż[1,2]. IPMNņØś ņ╣śļŻī ļ░Å ņČöņĀü Ļ┤Ćņ░░ ņĀäļץņŚÉ ļīĆĒĢ£ ļīĆĒæ£ņĀü Ļ░ĆņØ┤ļō£ļØ╝ņØĖņ£╝ļĪ£ ĻĄŁņĀ£ņĘīņןĒĢÖĒÜī(International Association of Pancreatology, IAP) ņŻ╝ļÅäņØś ņ¦Ćņ╣©ņØ┤ 2017ļģä ņłśņĀĢ ļ░£Ēæ£ļÉśņŚłļŗż[3]. ņŻ╝ņĘīĻ┤ĆĒśĢĻ│╝ Ēś╝ĒĢ®ĒśĢ-IPMNņØś Ļ▓ĮņÜ░ 2017ļģä IAP Ļ░ĆņØ┤ļō£ļØ╝ņØĖĻ│╝ 2018ļģä European Ļ░ĆņØ┤ļō£ļØ╝ņØĖ ļ¬©ļæÉņŚÉņä£ ļåÆņØĆ ņĢģņä▒ĒÖö ņ£äĒŚśļÅäļĪ£ ņØĖĒĢ┤ ņłśņłĀņĀü ņĀłņĀ£ļź╝ ĻČīĻ│ĀĒĢśĻ│Ā ņ׳ļŗż[3,4]. ļČäņ¦ĆņĘīĻ┤ĆĒśĢ-IPMNņØś Ļ▓ĮņÜ░ 2017 IAP Ļ░ĆņØ┤ļō£ļØ╝ņØĖņŚÉņä£ ĒÖśņ×ÉņØś ņ×äņāü ņ”ØņāüĻ│╝ ņśüņāü ņåīĻ▓¼ņØä ļ░öĒāĢņ£╝ļĪ£ Ļ▒▒ņĀĢņŖżļ¤¼ņÜ┤ ĒŖ╣ņ¦Ģ(worrisome feature)Ļ│╝ Ļ│Āņ£äĒŚśņØĖņ×É(high risk stigmata)ļĪ£ ĻĄ¼ļČäĒĢśņŚ¼ ņČöņĀü Ļ┤Ćņ░░Ļ│╝ ņ╣śļŻī ņĀäļץņØä ĻČīĻ│ĀĒĢśĻ│Ā ņ׳ļŗż. ņłśņłĀņĀü ņĀłņĀ£Ļ░Ć ĒĢäņÜöĒĢ£ Ļ│Āņ£äĒŚśņØĖņ×ÉņŚÉļŖö ļéŁņóģņ£╝ļĪ£ ņØĖĒĢ┤ ļ░£ņāØļÉ£ ĒÅÉņćäņä▒ ĒÖ®ļŗ¼, ļéŁņóģ ļé┤ļČĆņŚÉ ņĪ░ņśü ņ”ØĻ░ĢļÉ£ 5 mm ņØ┤ņāüņØś Ļ│ĀĒśĢņóģĻ┤┤, 10 mm ņØ┤ņāüņØś ņŻ╝ņĘīĻ┤Ć ĒÖĢņן ņåīĻ▓¼ņØ┤ ņ׳ļŗż. Ļ▒▒ņĀĢņŖżļ¤¼ņÜ┤ ĒŖ╣ņ¦ĢņŚÉļŖö 1) ĻĖēņä▒ņĘīņןņŚ╝ņØś ĻĖ░ņÖĢļĀź, 2) 3 cm ņØ┤ņāüņØś Ēü¼ĻĖ░, 3) ļ╣äĒøäļÉ£ ļéŁņóģļ▓Į, 4) 5-9 mm ņŻ╝ņĘīĻ┤Ć ĒÖĢņן, 5) ļéŁņóģ ļé┤ 5 mm ļ»Ėļ¦īņØś ņĪ░ņśüņ”ØĻ░ĢļÉśļŖö ļ▓ĮĻ▓░ņĀł, 6) ņøÉņ£äļČĆ ņĘīņן ņŗżņ¦ł ņ£äņČĢņØä ļÅÖļ░śĒĢ£ ņŻ╝ņĘīĻ┤Ć ņ¦üĻ▓ĮņØś Ļ░æņ×æņŖżļ¤¼ņÜ┤ ļ│ĆĒÖö, 7) CA19-9 ņāüņŖ╣, 8) ļ”╝ĒöäņĀł ļ╣äļīĆ, 9) 2ļģäņŚÉ 5 mm ņØ┤ņāü ļéŁņóģ Ēü¼ĻĖ░ ņ”ØĻ░Ć ļō▒ņØ┤ ĒżĒĢ©ļÉ£ļŗż. Ļ░ĆņØ┤ļō£ļØ╝ņØĖņŚÉņä£ļŖö Ļ▒▒ņĀĢņŖżļ¤¼ņÜ┤ ĒŖ╣ņ¦ĢņØ┤ ņśüņāü Ļ▓Ćņé¼ņŚÉņä£ ļ░£Ļ▓¼ļÉśļ®┤ ņ┤łņØīĒīīļé┤ņŗ£Ļ▓Į Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢśĻ│Ā ļ¬ģĒÖĢĒĢ£ ļ▓ĮĻ▓░ņĀł, ņŻ╝ņĘīĻ┤Ć ņ╣©ņ£ż ņåīĻ▓¼, ņĢģņä▒ņäĖĒżĻ░Ć ņØśņŗ¼ļÉśļŖö ļ│æļ”¼ Ļ▓Ćņé¼ Ļ▓░Ļ│╝ ļō▒ņØ┤ ņ׳ļŗżļ®┤ ņłśņłĀņØä ĻČīĻ│ĀĒĢśĻ│Ā ņ׳ļŗż[3].
ņĘīņןļéŁņóģņŚÉņä£ ņ┤łņØīĒīīļé┤ņŗ£Ļ▓ĮņØś ņŚŁĒĢĀ
ņ┤łņØīĒīīļé┤ņŗ£Ļ▓Į Ļ▓Ćņé¼ļŖö ņĘīņןņØś Ļ│ĀĒĢ┤ņāüļÅä ņśüņāüņØä ņ¢╗ņØä ņłś ņ׳ņ¢┤ ļé┤ļČĆ Ļ▓®ļ¦ē, ļéŁņóģ ļé┤ Ļ▓░ņĀłņØ┤ļéś ņóģĻ┤┤ņØś ņ£Āļ¼┤, ņĘīĻ┤ĆĻ│╝ņØś Ļ┤ĆĻ│ä ļō▒ņØä Ļ┤Ćņ░░ĒĢśļŖö ļŹ░ ņ£ĀņÜ®ĒĢśļŗż. ņĪ░ņśüņ”ØĻ░Ģņ┤łņØīĒīīļé┤ņŗ£Ļ▓Į Ļ▓Ćņé¼ļŖö ļéŁņóģ ļé┤ņØś ļ▓ĮĻ▓░ņĀłĻ│╝ mucin globuleņØś ĻĄ¼ļČäņŚÉ ņ£ĀņÜ®ĒĢśļŗż. ĒĢśņ¦Ćļ¦ī ļ░£Ļ▓¼ļÉ£ ņĘīņןļéŁņóģ ļ¬©ļæÉņŚÉņä£ ņ┤łņØīĒīīļé┤ņŗ£Ļ▓Į Ļ▓Ćņé¼Ļ░Ć ĒĢäņÜöĒĢ£ Ļ▓āņØĆ ņĢäļŗłļŗż. ņ┤łņØīĒīīļé┤ņŗ£Ļ▓ĮņØś ņĀüņØæņ”ØņØä Ļ│ĀļĀżĒĢ┤ ļ│┤ļ®┤, 1) ņśüņāü Ļ▓Ćņé¼ņŚÉņä£ ļ│æļ│ĆņØś Ļ░Éļ│äņ¦äļŗ©ņØ┤ ņ¢┤ļĀżņÜ┤ Ļ▓ĮņÜ░, 2) ņ┤łņØīĒīīļé┤ņŗ£Ļ▓Į Ļ▓Ćņé¼ Ļ▓░Ļ│╝Ļ░Ć ņ╣śļŻī ļ░®ņ╣©ņØś Ļ▓░ņĀĢņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣śļŖö Ļ▓ĮņÜ░, 3) ļČäņ¦ĆņĘīĻ┤ĆĒśĢ IPMNņŚÉņä£ ņĢģņä▒ ļśÉļŖö ņĢģņä▒ ņĀäĒÖś Ļ░ĆļŖźņä▒ņØś ņ¦ĢĒøäĻ░Ć ņØśņŗ¼ļÉśļŖö Ļ▓ĮņÜ░, 4) ņĢģņä▒ņØ┤ ņØśņŗ¼ļÉśļéś ņłśņłĀņØ┤ ļČłĻ░ĆļŖźĒĢśņŚ¼ ņĪ░ņ¦üĒĢÖņĀü ĒÖĢņ¦äņØ┤ ĒĢäņÜöĒĢ£ Ļ▓ĮņÜ░ņØ┤ļŗż[3,5,6]. ņ┤łņØīĒīīļé┤ņŗ£Ļ▓Į ņ£ĀļÅäĒĢś ņäĖņ╣©ĒØĪņØĖ Ļ▓Ćņé¼(endoscopic ultrasonography-guided fine needle aspiration, EUS-FNA)ļŖö ļ│æļ│ĆņŚÉņä£ ņĪ░ņ¦üņØ┤ļéś ļéŁņĢĪņØä ņēĮĻ▓ī ņ▒äņĘ©ĒĢĀ ņłś ņ׳ļŖö Ļ▓Ćņé¼ ļ░®ļ▓Ģņ£╝ļĪ£ ļéŁņĢĪ ļé┤ņØś CEA, ņĢäļ░ĆļØ╝ņĢäņĀ£, KRAS mutation ņ£Āļ¼┤, GNAS mutation ņ£Āļ¼┤, ņäĖĒżņ¦ä Ļ▓Ćņé¼ ļō▒ņØ┤ Ļ░Éļ│äņ¦äļŗ© ļ░Å ņóģņ¢æņØś ņĢģņä▒ĒÖöļź╝ ņśłņĖĪĒĢśļŖö ļŹ░ ļÅäņøĆņØ┤ ļÉ£ļŗż[7]. 2017 IAP ĻĄŁņĀ£ Ļ░ĆņØ┤ļō£ļØ╝ņØĖņŚÉ ļö░ļź┤ļ®┤ EUS-FNAļŖö ļéŁņĢĪņØś ļłäņČ£(leakage)ņŚÉ ļīĆĒĢ£ ņÜ░ļĀżļĪ£ ņØĖĒĢ┤ ņĀüĻĘ╣ ņČöņ▓£ļÉśņ¦ĆļŖö ņĢŖņ£╝ļéś, ļéŁņĢĪ ļé┤ CEA >192 ng/mLņØś ĻĖ░ņżĆņ╣śļŖö ņĀÉņĢĪņä▒ ļéŁņóģ(IPMN ļśÉļŖö ņĀÉņĢĪņä▒ ļéŁņä▒ņóģņ¢æ)ņØś ņ¦äļŗ©ņŚÉ ņ׳ņ¢┤ņä£ 79%ņØś ņĀĢļÅäņØś ņĀĢĒÖĢļÅäļź╝ Ļ░Ćņ¦äļŗż[8]. ņĘīņןļéŁņóģņØś ĒÅēĻ░ĆļŖö ņ×äņāü ņ”Øņāü, ņśüņāüņØśĒĢÖ Ļ▓Ćņé¼, ņ┤łņØīĒīīļé┤ņŗ£Ļ▓Į ļ░Å ņĘīņןļéŁņĢĪ ļČäņäØ ļō▒ņØä ĒżĒĢ©ĒĢśļŖö ļŗżņøÉņĀü ņĀæĻĘ╝ ļ░®ņŗØņØ┤ ĒĢäņÜöĒĢśļŗż[6].
ņłśņłĀ Ēøä ņČöņĀü Ļ┤Ćņ░░
ņØ╝ļ░śņĀüņ£╝ļĪ£ IPMNņØĆ ĻĘ╝ņ╣śņĀü ņĀłņĀ£ļź╝ ĒĢśļŖö Ļ▓ĮņÜ░ 5ļģä ļłäņĀü ņāØņĪ┤ņ£© 80% ņØ┤ņāüņ£╝ļĪ£ ņśłĒøäĻ░Ć ļ¦żņÜ░ ņ¢æĒśĖĒĢśļŗżĻ│Ā ņĢīļĀżņĀĖ ņ׳ļŗż. 2017ļģä IAP Ļ░ĆņØ┤ļō£ļØ╝ņØĖņŚÉņä£ IPMNņ£╝ļĪ£ ņĘīņן ļČĆļČä ņĀłņĀ£ņłĀņØä ņŗ£Ē¢ēĒĢ£ Ļ▓ĮņÜ░ņŚÉļÅä ļé©ņØĆ ņĘīņןņŚÉņä£ IPMNņØ┤ļéś ņäĀņĢöņØ┤ ņ×¼ļ░£ĒĢĀ ņłś ņ׳ņ¢┤ ņłśņłĀņØ┤ ņĀüĒĢ®ĒĢ£ ĒÖśņ×ÉņŚÉņä£ ĒÅēņāØ ņČöņĀü Ļ▓Ćņé¼ļź╝ ĻČīņןĒĢśĻ│Ā ņ׳ļŗż[3].
Ļ▓░ ļĪĀ
ņĘīņןļéŁņóģņØĆ Ļ│╝Ļ▒░ņŚÉ ļ╣äĒĢ┤ ļ░£Ļ▓¼ ļ╣łļÅäĻ░Ć ņ”ØĻ░ĆĒĢśĻ│Ā ņ׳ņ¢┤ ņĀÉņĀÉ ņ×äņāüņĀü ņżæņÜöņä▒ņØ┤ Ļ░ĢņĪ░ļÉśĻ│Ā ņ׳ļŗż. ļéŁņóģņØś Ļ░Éļ│äņ¦äļŗ©ņØä ņ£äĒĢ£ ņØ╝ņ░© Ļ▓Ćņé¼ļĪ£ ļ│ĄļČĆ CT ļśÉļŖö magnetic resonance imaging/MRCP Ļ▓Ćņé¼Ļ░Ć ņČöņ▓£ļÉ£ļŗż. ĻĖ░ņĪ┤ ņśüņāü Ļ▓Ćņé¼ņŚÉņä£ ĻĄ¼ļČäņØ┤ ņ¢┤ļĀżņÜ┤ indeterminate cystņØ┤Ļ▒░ļéś Ļ▒▒ņĀĢņŖżļ¤¼ņÜ┤ ĒŖ╣ņ¦ĢņØ┤ ļ░£Ļ▓¼ļÉśļ®┤ ņ┤łņØīĒīī ļé┤ņŗ£Ļ▓Į Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢ£ļŗż. ļ¦īņØ╝ ņ¦äļŗ©ņĀü Ļ▓Ćņé¼ņŚÉņä£ ņĢģņä▒ņØä ņŗ£ņé¼ĒĢśļŖö ņåīĻ▓¼ņØ┤ Ļ┤Ćņ░░ļÉśļ®┤ ņłśņłĀņĀü ņĀłņĀ£Ļ░Ć ņ╣śļŻī ņøÉņ╣ÖņØ┤ļŗż. ņĘīņן ņłśņłĀņØĆ ņ£äĒŚśņä▒ņØ┤ ņĪ┤ņ×¼ĒĢśļ»ĆļĪ£ Ļ│ĀļĀ╣ņØ┤ļéś ĻĖ░ņĀĆ ņ¦łĒÖśņØä ļÅÖļ░śĒĢ£ ĒÖśņ×ÉņŚÉņä£ ņ╣śļŻī ļ░®Ē¢źņØä Ļ▓░ņĀĢĒĢĀ ļĢīļŖö ņĘīņןņĢö ļ░£ņāØ ņ£äĒŚśļÅäņÖĆ ņłśņłĀņŚÉ ļö░ļźĖ ņ£äĒŚśņä▒ņØä ĻĘĀĒśĢ ņ׳Ļ▓ī ĒÅēĻ░ĆĒĢ┤ņĢ╝ ĒĢ£ļŗż.



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






