žĄú Ž°†
žó¨ŪėłžôÄžĚė ž¶ĚžĚł žč†žěźŽď§žĚÄ žĘÖÍĶźž†ĀžĚł žĚīžú†Ž°ú žąėŪėąžĚĄ ÍĪįŽ∂ÄŪēúŽč§. ŪēėžßÄŽßĆ Í∑łŽď§žĚÄ ž†ĀŪėąÍĶ¨žÉĚžĄĪžěźÍ∑Ļž†ú(erythropoietin stimulating agent), ž≤†Ž∂Ąž†ú ŽďĪžĚė žąėŪėą ŽĆÄž≤ī žöĒŽ≤ēžĚÄ Ūóąžö©ŪēúŽč§. žąúž≤úŪĖ•ŽĆÄŪēôÍĶź žĄúžöłŽ≥ĎžõźžĚÄ 2000ŽÖĄŽ∂ÄŪĄį Ž¨īžąėŪėąžĄľŪĄįŽ•ľ žöīžėĀŪēėÍ≥† žěąžĖīžĄú Ž¨īžąėŪėą žĻėŽ£ĆŽ•ľ žõźŪēėŽäĒ žó¨ŪėłžôÄžĚė ž¶ĚžĚł ŪôėžěźŽď§žĚė ŽćįžĚīŪĄįŽ≤†žĚīžä§ÍįÄ ÍĶ¨ž∂ēŽźėžĖī žěąŽč§. ŽėźŪēú Ž¨īžąėŪėą žąėžą† žčúŪĖČžóź žěąžĖīžĄú žěźž≤ī ÍįúŽįúŪēú ŪĒĄŽ°úŪ܆žĹúžĚĄ žĚīžö©Ūēėžó¨ žąėŪėą ŽĆÄž≤ī žöĒŽ≤ēžĚĄ žčúŪĖČŪēėÍ≥† žěąŽč§. žĚī ŪĒĄŽ°úŪ܆žĹúžĚÄ ž†ĀŪėąÍĶ¨žÉĚžĄĪžěźÍ∑Ļž†ú, ž£ľžā¨ ž≤†Ž∂Ąž†ú ŽďĪžúľŽ°ú ÍĶ¨žĄĪŽźėžĖī žěąžúľŽ©į, Ž¨īžąėŪėąžĄľŪĄįŽ•ľ žöīžėĀŪēėÍ≥† žěąŽäĒ žôłÍĶ≠ ÍłįÍīĎ吏Ěė ŪĒĄŽ°úŪ܆žĹúÍ≥ľ žú†žā¨ŪēėŽč§[
1,
2].
žĘÖÍĶźž†ĀžĚł žĚīžú†ÍįÄ žēĄŽčąŽćĒŽĚľŽŹĄ žĶúÍ∑ľ Ūėąžē° Í≥ĶͳȞĚė žĖīŽ†§žõÄ ŽďĪžĚė žĚīžú†Ž°ú žĚėŽ£ĆÍłįÍīĞ󟞥úŽäĒ žąėŪėąžĚĄ žĶúžÜĆŪôĒŪēėÍ≥†žěź ŪēėŽäĒ ŽÖłŽ†•žĚī ž¶ĚÍįÄŪēėÍ≥† žěąŽč§. ŽĻąŪėą, ŪėąžÜĆŪĆź ÍįźžÜĆ ŪôėžěźžóźžĄú žąėŪėąžĚė ž†ĀžĚĎž¶ĚžĚĄ žĘĀŪěąÍ≥† ŽćĒžöĪ ÍĶ¨ž≤īŪôĒŪēėŽ©į, žąėŪėąžĚĄ Í∂ĆÍ≥†ŪēėŽäĒ Í≤Äžā¨ žąėžĻėŽ•ľ ŽÜíÍ≤Ć ŪēėŽäĒ ŽďĪžĚė ŽÖłŽ†•žĚī žĚīžóź ŪēīŽčĻŽźúŽč§. žč§ž†úŽ°ú žĚīžôÄ ÍįôžĚÄ Žāīžö©žĚÄ ÍĶ≠Žāī žĚėŽ£ĆÍłįÍīÄ žąėŪėą ž†Āž†ąžĄĪ ŪŹČÍįÄ Ūē≠Ž™©žóź ŪŹ¨Ūē®ŽźėžĖī žěąŽč§[
3]. ŽĒįŽĚľžĄú Íłįž†Äžóź Ūėąžē° žßąŪôėžĚī žóÜŽäĒ ŪôėžěźžĚė žąėžą†žĚīŽāė žôłžÉĀžĚĄ Ž¨īžąėŪėąŽ°ú žĻėŽ£ĆŪēėŽ†§ŽäĒ ŽÖłŽ†•žĚÄ žąėŪėąŽüȞ̥ ž§ĄžĚīÍ≥†žěź ŪēėŽäĒ žĚėŪēôž†Ā, žā¨ŪöĆ Í≤Ĺž†úž†Ā Í∂ĆÍ≥† žā¨Ūē≠Í≥ľ žĚľžĻėŪēúŽč§[
3-
6].
ŪēėžßÄŽßĆ Ž¨īžąėŪėą žĻėŽ£ĆŽ•ľ žēĒ ŪôėžěźžĚė žĻėŽ£Ćžóź ž†Āžö©ŪēėÍ≥†žěź Ūē† Í≤Ĺžöį žĚėŪēôž†ĀžĚł Ž∂ÄŽ∂ĄÍ≥ľ žÉĀž∂©ŽźėŽäĒ žąúÍįĄŽď§žĚī ŽďúŽ¨ľžßÄ žēäÍ≤Ć ŽįúžÉĚŪēúŽč§. žēĒ ŪôėžěźŽäĒ Ūē≠žēĒ žĻėŽ£Ć, žąėžą† ŽďĪžĚė žĻėŽ£Ć ž§Ď žąėŪėąžĚī ŪēĄžöĒŪēú Í≤ĹžöįÍįÄ ŪĚĒŪēėŽč§. žĚīŽüį Ž¨łž†úŽäĒ Í≥†ŪėēžēĒžĚė Ž≥īž°īž†Ā Ūē≠žēĒ žĻėŽ£ĆŽ≥īŽč§ŽäĒ Ūėąžē°žēĒžĚė Ūē≠žēĒ žĻėŽ£ĆžóźžĄú ŽćĒ žč¨ÍįĀŪēėÍ≤Ć ŽāėŪÉÄŽāúŽč§. ÍłįŽ≥łž†ĀžúľŽ°ú Ūėąžē°Ūēôž†Ā žĚīžÉĀžĚĄ ŽŹôŽįėŪēú Í≤ĹžöįÍįÄ ŽßéÍ≥† Ūē≠žēĒ žĻėŽ£ĆžĚė ÍįēŽŹĄÍįÄ ŽÜížēĄ Ūėąžē°Ūēôž†Ā Ž∂ÄžěĎžö©žĚė ŽįúžÉĚ ŽĻąŽŹĄÍįÄ ŽćĒ ŽÜíÍłį ŽēĆŽ¨łžĚīŽč§. Ūėąžē°žēĒ ž§ĎžóźžĄúŽŹĄ Ž¨īžąėŪėą žĻėŽ£ĆžĚė žĖīŽ†§žõÄžĚÄ žßąŪôėŽßąŽč§ Žč§Ž•īŽč§. žėąŽ•ľ Žď§Ž©ī, ͳȞĄĪ ŽįĪŪėąŽ≥ĎžĚė Í≤ĹžöįŽäĒ žßĄŽč® žčú ŽĻąŪėą, ŪėąžÜĆŪĆźÍįźžÜĆž¶ĚžĚī žč¨Ūēú Í≤ĹžöįÍįÄ ŽßéÍ≥†, Ūē≠žēĒ žĻėŽ£ĆžĚė Ūėąžē° Ž∂ÄžěĎžö©žĚī žč¨ŪēėÍ≤Ć ŽāėŪÉÄŽāėŽĮÄŽ°ú žąėŪėąžĚī ŪēĄžöĒŪēú Í≤ĹžöįŽ•ľ ŽćĒžöĪ ŪĚĒŪěą Í≤™Í≤Ć ŽźúŽč§[
7]. Í∑łžóź ŽĻĄŪēī žßĄŽč® ŽįŹ žĻėŽ£Ć žčú ŪėąÍĶ¨ ÍįźžÜĆžĚė ž†ēŽŹĄÍįÄ ŽćúŪēú Ž¶ľŪĒĄžĘÖ, Žč§ŽįúÍ≥®žąėžĘÖžĚÄ Ž¨īžąėŪėąŽ°ú Ūē≠žēĒ žĻėŽ£ĆŽ•ľ žßĄŪĖČŪēėŽäĒ Í≤ÉžĚī žĘÄ ŽćĒ ŽāėžĚĄ Í≤ÉžúľŽ°ú žėąžÉĀŽźúŽč§[
8,
9]. ŪēėžßÄŽßĆ žĚīŽäĒ ŪäĻž†ē žĘÖÍĶźžóź ÍĶ≠ŪēúŽźú ŽĻĄžĚėŪēôž†ĀžĚł žÉĀŪô©žĚīŽĮÄŽ°ú Ž¨īžąėŪėąŽ°ú Ž¶ľŪĒĄžĘÖ, Žč§ŽįúÍ≥®žąėžĘÖžóź ŽĆÄŪēú Ūē≠žēĒ žĻėŽ£ĆŽ•ľ žčúŪĖČŽįõžĚÄ ŪôėžěźŽď§žóź ŽĆÄŪēú ÍĶ≠Žāī žóįÍĶ¨ŽäĒ ÍĪįžĚė žóÜÍ≥†, žąėžą† ŪôėžěźŽď§žóź ŽĆÄŪēú žĚľŽ∂Ä ž¶ĚŽ°Ä Ž≥īÍ≥†ŽßĆ žěąŽäĒ žč§ž†ēžĚīŽč§[
10,
11].
ŽĒįŽĚľžĄú ž†ÄžěźŽď§žĚÄ žąúž≤úŪĖ•ŽĆÄŪēôÍĶź žĄúžöłŽ≥Ďžõźžóź žěÖžõźŪēėžó¨ Ž¨īžąėŪėąŽ°ú žĻėŽ£ĆŽįõžēėŽćė Ūėąžē°žēĒ ŪôėžěźŽď§ ž§Ď Ž¶ľŪĒĄžĘÖ ŽįŹ Žč§ŽįúÍ≥®žąėžĘÖ ŪôėžěźžĚė žĻėŽ£Ć žĄĪž†ĀžĚĄ Ž∂ĄžĄĚŪēėÍ≥†žěź ŪēėžėÄŽč§.
ŽĆÄžÉĀ ŽįŹ Žį©Ž≤ē
Ž≥ł žóįÍĶ¨ŽäĒ 2006ŽÖĄŽ∂ÄŪĄį 2021ŽÖĄÍĻĆžßÄ žąúž≤úŪĖ•ŽĆÄŪēôÍĶź žĄúžöłŽ≥ĎžõźžóźžĄú Ž¶ľŪĒĄžĘÖ ŪėĻžĚÄ Žč§ŽįúÍ≥®žąėžĘ̥֞ žßĄŽč®ŽįõÍ≥† Ūē≠žēĒ žĻėŽ£ĆŽ•ľ žčúŪĖČŪēú ŪôėžěźŽď§žĚĄ ŽĆÄžÉĀžúľŽ°ú ŪēėžėÄŽč§. Ž¶ľŪĒĄžĘÖ ŪôėžěźŽď§ ž§Ď Žį©žā¨žĄ† žĻėŽ£ĆŽßĆ Žč®ŽŹÖžúľŽ°ú ŽįõžĚÄ Ūôėžěź, Ū󨎶¨žĹĒŽįēŪĄį ž†úÍ∑† žöĒŽ≤ēŽßĆ žčúŪĖČŽįõžĚÄ Ž≥ÄžóįŽ∂ÄŽ¶ľŪĒĄžĘÖ ŪôėžěźŽäĒ ž†úžôłŪēėžėÄŽč§. Ž¶ľŪĒĄžĘÖ, Žč§ŽįúÍ≥®žąėžĘÖ žßĄŽč® ŪõĄ žĻėŽ£ĆŽ•ľ ŽįõžßÄ žēäžĚÄ žā¨ŽěƎ硫ŹĄ ž†úžôłŪēėžėÄŽč§.
2006ŽÖĄŽ∂ÄŪĄį ž†ĄŪĖ•ž†ĀžúľŽ°ú ŽďĪŽ°ĚŽźėÍ≥† žěąŽäĒ žąúž≤úŪĖ•ŽĆÄŪēôÍĶź žĄúžöłŽ≥ĎžõźžĚė Ž¨īžąėŪėą Ūôėžěź Ž†ąžßÄžä§Ū䳎¶¨Ž•ľ žĚīžö©Ūēėžó¨ Ūėąžē°žēĒ ŪôėžěźŽ•ľ ž∂Ēž∂úŪēėžėÄŽč§. žĚī ž§Ď Ž¶ľŪĒĄžĘÖ ŪėĻžĚÄ Žč§ŽįúÍ≥®žąėžĘ̥֞ ŪôēžßĄŽįõÍ≥† Ž≥łžõźžóźžĄú žĻėŽ£ĆŽįõžĚÄ ŪôėžěźŽď§žĚĄ ŽĆÄžÉĀžúľŽ°ú Ž¨īžąėŪėą žĻėŽ£ĆÍįÄ ŽĮłžĻėŽäĒ žėĀŪĖ•žóź ŽĆÄŪēī ŪõĄŪĖ•ž†ĀžúľŽ°ú Ž∂ĄžĄĚŪēėžėÄŽč§. ŪôėžěźŽď§žĚė žĚėŽ¨īÍłįŽ°ĚžĚĄ ŽįĒŪÉēžúľŽ°ú žěĄžÉĀ žěźŽ£ĆŽ•ľ žąėžßĎŪēėžėÄÍ≥†, ž†ĄžěźžĚėŽ¨īÍłįŽ°Ě(electronic medical record, EMR)žĚė Ūėąžē° Í≤Äžā¨ žěźŽ£ĆŽ•ľ ŪĆĆžēÖŪēėžėÄŽč§. Ž≥ł žóįÍĶ¨ŽäĒ žąúž≤úŪĖ•ŽĆÄŪēôÍĶź žĄúžöłŽ≥Ďžõź žÉĚŽ™Öžú§Ž¶¨žúĄžõźŪöĆ žč¨žĚėŽ•ľ ŪÜĶÍ≥ľŪēėžėÄŽč§.
ŽĆÄžÉĀ ŪôėžěźžĚė ŪäĻžĄĪžĚÄ ŽįĪŽ∂Ąžú®Í≥ľ ŽĻąŽŹĄŽ°ú ž†úžčúŪēėžėÄÍ≥†, žÉĚž°ī Í≥°žĄ†žĚÄ žĻīŪĒĆŽěÄ-ŽßąžĚīžĖī Žį©Ž≤ēžúľŽ°ú ŽĻĄÍĶźŪēėžėÄŽč§. ŪÜĶÍ≥Ą Ž∂ĄžĄĚžĚÄ SPSS ver. 27.0 (IBM, Armonk, NY, USA)žĚĄ žā¨žö©Ūēėžó¨ ŪÜĶžÉĀž†Ā Žį©Ž≤ēžĚĄ ž†Āžö©ŪēėžėÄŽč§.
Í≥† žįį
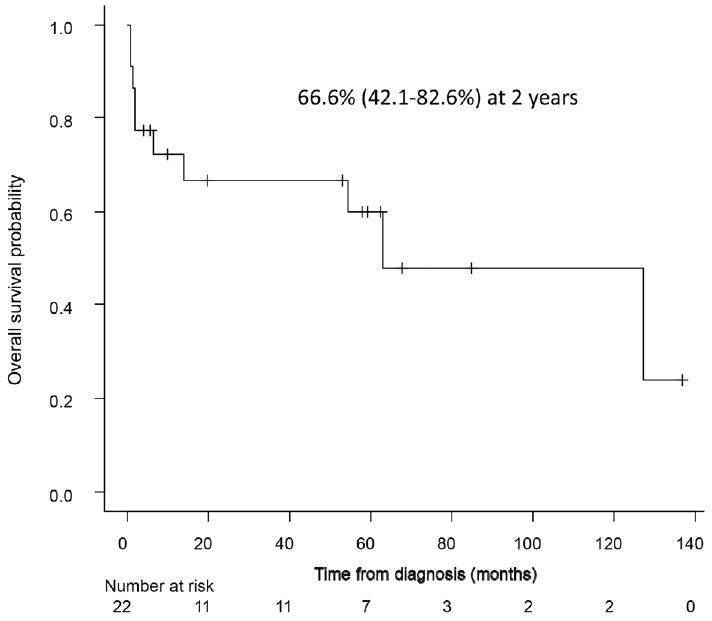
Ž≥ł žóįÍĶ¨žóźžĄúŽäĒ žąúž≤úŪĖ•ŽĆÄŪēôÍĶź žĄúžöłŽ≥ĎžõźžóźžĄú Ž¨īžąėŪėąŽ°ú žĻėŽ£ĆŽįõžĚÄ Ž¶ľŪĒĄžĘÖ ŪôėžěźžôÄ Žč§ŽįúÍ≥®žąėžĘÖ ŪôėžěźžĚė žĻėŽ£Ć žĄĪž†ĀžĚĄ Ž∂ĄžĄĚŪēėžėÄŽč§. ž≤ęžßł, Ž¶ľŪĒĄžĘÖ ŪôėžěźžĚė 2ŽÖĄ žÉĚž°īžú®žĚÄ 66.6%žėÄÍ≥†, žßĄŽč® ŪõĄ 6ÍįúžõĒ ŽĮłŽßĆžóź žā¨ŽßĚŪēú ŪôėžěźŽď§žĚÄ ž†Ąž≤ī Ž¶ľŪĒĄžĘÖ ŪôėžěźžĚė 22.7%žėÄŽč§. žĚīžôÄ ÍįôžĚī ž°įÍłį žā¨ŽßĚŪēú ŪôėžěźŽď§žĚė ŪėąžÉČžÜĆ žąėžĻė ŪŹČÍ∑†ÍįížĚÄ 5.5 g/L (Ž≤ĒžúĄ, 2.7-13.3), ŪėąžÜĆŪĆź žąėžĻė ŪŹČÍ∑†ÍįížĚÄ 50,142/¬ĶL(Ž≤ĒžúĄ, 23,000-147,000)žėÄžúľŽ©į, žěĄžĘÖÍłįžóź ŽĻąŪėą ŽįŹ ŪėąžÜĆŪĆźÍįźžÜĆž¶ĚžĚė žč¨ŪôĒŽ°ú žĚłŪēī ŪôėžěźŽď§žĚī ŪėłžÜĆŪĖąŽćė ž¶ĚžÉĀ ž§ĎžóźžĄúŽäĒ ŽĻąŪėąŽ°ú žĚłŪēú ŪėłŪĚ°Í≥§ŽěÄ(54.5%)žĚī ÍįÄžě• ŽĻąŽ≤ąŪēėžėÄŽč§. Í∑łŽ¶¨Í≥† Ž¶ľŪĒĄžĘÖžĚī žßĄŪĖČŪēėÍ≥† ŪėąžÜĆŪĆź ÍįźžÜĆÍįÄ žč¨ŪôĒŽźú žčúÍłįžóź ž∂úŪėąžĚī ŽįúžÉĚŪēėžó¨ ž†ÄŪėąŽüČžĄĪ žáľŪĀ¨Ž°ú žā¨ŽßĚŪēú žā¨Ž°ÄÍįÄ 1Ž™Ö žěąžóąŽč§. ŽĎėžßł, Žč§ŽįúÍ≥®žąėžĘÖžĚÄ Ūôėžěź žąęžěźÍįÄ ŽćĒ ž†ĀžĖīžĄú žÉĚž°ī žěźŽ£Ćžóź ŽĆÄŪēú Ž∂ĄžĄĚžóź ž†úŪēúž†źžĚī ŽćĒ ŽßéÍłįŽäĒ ŪĖąžßÄŽßĆ ž§Ďžēô žÉĚž°īÍįížĚÄ 60.3ÍįúžõĒ, 2ŽÖĄ žÉĚž°īžú®žĚÄ 57.1%žėÄŽč§. žīĚ 7Ž™ÖžĚė Ūôėžěź ž§Ď 3Ž™ÖžĚī žěźÍįÄž°įŪėąŽ™®žĄłŪŹ¨ žĚīžčĚ ÍįÄŽä•Ūēú žóįŽ†ĻžĚīžóąžĚƞ󟎏Ą Ž∂ąÍĶ¨ŪēėÍ≥† Ž¨īžąėŪėąžĚė ž†úŪēúž†ź ŽēĆŽ¨łžóź Ūē≠žēĒ žĻėŽ£Ć Žč®ŽŹÖžúľŽ°ú žĻėŽ£ĆŪēėžėÄŽč§.
Í≤įŽ°†ž†ĀžúľŽ°ú žĻėŽ£Ć žčúžěĎŽ∂ÄŪĄį Ž¨īžąėŪėąžĚĄ Í≥†Ž†§Ūēėžó¨ žĻėŽ£Ć ÍįēŽŹĄŽ•ľ Žāģž∂ė Í≤ÉžĚī žĻėŽ£Ć ŽįėžĚĎžóź žėĀŪĖ•žĚĄ ž£ľžóąžĚĄ Í≤ÉžúľŽ°ú žėąžÉĀŽźėŽäĒ žā¨Ž°ÄŽď§žĚī žěąÍłįŽäĒ ŪēėžėÄžßÄŽßĆ žÉĀŽčĻžąėžĚė Ž¶ľŪĒĄžĘÖ, Žč§ŽįúÍ≥®žąėžĘÖ ŪôėžěźžóźžĄúŽäĒ Ž¨īžąėŪėą žĻėŽ£ĆŽ°ú ŪĎúž§Ä Ūē≠žēĒ žĻėŽ£Ć žôĄŽ£ĆžôÄ žě•Íłį žÉĚž°īžĚī ÍįÄŽä•ŪēėžėÄŽč§.
Ž¶ľŪĒĄžĘÖžĚė Ūē≠žēĒ žĻėŽ£ĆŽäĒ Í≥†ŪėēžēĒžĚė Ūē≠žēĒ žĻėŽ£Ćžóź ŽĻĄŪēī Ūėąžē° Ž∂ÄžěĎžö©žĚī žč¨ŪēėÍ≤Ć ŽāėŪÉÄŽāėÍ≥† ŽĻąŽŹĄŽŹĄ ŽÜíŽč§. ŽĒįŽĚľžĄú ŪôėžěźÍįÄ Ž¨īžąėŪėą žĻėŽ£ĆŽ•ľ žöĒÍĶ¨ŪēėÍ≤Ć ŽźėŽ©ī žěĄžÉĀžĚėŽäĒ žĻėŽ£Ćžóź žĖīŽ†§žõĞ̥ Í≤™Í≤Ć ŽźúŽč§. Ž≥łžõźžĚė Ž¨īžąėŪėąžĄľŪĄįžóźžĄúŽäĒ ŽĻąŪėąžóź ŽĆÄŪēú žąėŪėą ŽĆÄž≤ī žöĒŽ≤ēžĚė ŪĒĄŽ°úŪ܆žĹúžĚī žěąžĖīžĄú ŽĆÄž≤īŽ°ú žĚī Íłįž§ÄžĚĄ ŽĒįŽĚľ žąėŪėą ŽĆÄž≤ī žöĒŽ≤ēžĚĄ žčúŪĖČŪēúŽč§. žąėŪėą ŽĆÄž≤ī žöĒŽ≤ēžĚÄ ž£ľŽ°ú ž†ĀŪėąÍĶ¨žÉĚžĄĪžěźÍ∑Ļž†ú, ž£ľžā¨ž≤†Ž∂Ąž†ú ŽďĪžúľŽ°ú žĚīŽ£®žĖīž†ł žěąŽč§. ŪēėžßÄŽßĆ žôĄžĻė Ž™©ž†Ā(curative intent)žĚė Ūē≠žēĒ žĻėŽ£ĆžóźžĄúŽäĒ ž†ĀŪėąÍĶ¨žÉĚžĄĪžěźÍ∑Ļž†úžĚė žā¨žö©žĚī žēĒžĚė žßĄŪĖČ ŽįŹ ž°įÍłį žā¨ŽßĚŽ•†žĚĄ ŽÜížĚłŽč§ŽäĒ Ž≥īÍ≥†Žď§ŽŹĄ žěąŽč§[
12-
14]. ŽĒįŽĚľžĄú National Comprehensive Cancer Network (NCCN) ŽďĪžóźžĄúŽäĒ Ž¶ľŪĒĄžĘÖžĚė Ūē≠žēĒ žĻėŽ£ĆžóźžĄúŽäĒ ž†ĀŪėąÍĶ¨žÉĚžĄĪžěźÍ∑Ļž†úžĚė žā¨žö©žĚĄ Í∂ĆÍ≥†ŪēėžßÄ žēäÍ≥† žěąŽč§[
15]. Ž≥ł žóįÍĶ¨žóźžĄúŽŹĄ Ž¨īžąėŪėąžĄľŪĄį ŪĒĄŽ°úŪ܆žĹú Íłįž§Äžóź ŽĻĄŪēī Ž¨īžąėŪėą Ž¶ľŪĒĄžĘÖ ŪôėžěźžóźÍ≤Ć žěąžĖīžĄúŽäĒ ž†ĀŪėąÍĶ¨žÉĚžĄĪžěźÍ∑Ļž†ú žā¨žö©žĚė Íłįž§Äž†źžĚĄ žĘÄ ŽćĒ ŽÜížó¨žĄú žÜĆÍ∑Ļž†ĀžúľŽ°ú žā¨žö©Ūēú Í≤ĹŪĖ•žĚī žěąžóąžúľŽ©į, 50%žĚė ŪôėžěźžóźžĄú Ūą¨žēĹŪēėžėÄŽč§. ŪēėžßÄŽßĆ ŪôėžěźžĚė žÉĀŪÉúÍįÄ žēÖŪôĒŽźėžóąžĚĄ ŽēĆ Ž¨īžąėŪėąŽ°ú žĚłŪēú ž§ĎŽĆÄŪēú Ž¨łž†úŽäĒ ŽĆÄŽ∂ÄŽ∂Ą ŽĻąŪėąŽ°ú žĚłŪēú Í≤ÉžĚīžóąžúľŽ©į, žĚīŽ°ú žĚłŪēú ŪėłŪĚ°Í≥§ŽěÄ, ŪĚČŪÜĶ, žĚėžčĚ Ž≥ÄŪôĒ ŽďĪžĚī žěąžóąŽč§. ŽĒįŽĚľžĄú Ž¨īžąėŪėą Ž¶ľŪĒĄžĘÖ žĻėŽ£Ćžóź žěąžĖī žĘÄ ŽćĒ ž†ĀÍ∑Ļž†ĀžĚł ž†ĀŪėąÍĶ¨žÉĚžĄĪžěźÍ∑Ļž†ú žā¨žö©žĚė žúĄŪóėžĄĪÍ≥ľ žĚīŽďĚžóź ŽĆÄŪēú žóįÍĶ¨Ž•ľ žßĄŪĖČŪē† ŪēĄžöĒÍįÄ žěąÍ≤†Žč§. žĚīžôÄ ÍīÄŽ†®Žźú žßĀž†Ďž†ĀžĚł ž†ĄŪĖ•ž†Ā ŽĻĄÍĶź žóįÍĶ¨ŽäĒ žóÜžßÄŽßĆ Beck ŽďĪ[
2]žĚī ŽįúŪĎúŪēú 66Ž™ÖžĚė žěźÍįÄž°įŪėąŽ™®žĄłŪŹ¨ žĚīžčĚ žā¨Ž°ÄžóźžĄúŽŹĄ ž†ĀŪėąÍĶ¨žÉĚžĄĪžěźÍ∑Ļž†úžĚė ž†ĀÍ∑Ļž†ĀžĚł žā¨žö©žĚė žēąž†ĄžĄĪžĚĄ ŪôēžĚłŪē† žąė žěąŽč§. ŽėźŪēú ÍĶ≠ŽāīžóźžĄúŽäĒ Oh ŽďĪ[
16]žĚī ž†Ąž≤ī Ūôėžěź ž§Ď 26Ž™ÖžĚī žąėžą† ŪõĄ Ž≥īž°į Ūē≠žēĒ žĻėŽ£ĆŽ•ľ ŽįõžēėÍ≥†, žĚīŽď§žóźÍ≤Ć ž†ĀŪėąÍĶ¨žÉĚžĄĪžěźÍ∑Ļž†úŽ•ľ žā¨žö©ŪĖąŽćė Í≤ÉžĚÄ ŽĻĄÍĶźž†Ā žēąž†ĄŪĖąžĚƞ̥ žčúžā¨ŪēėŽäĒ Ž≥īÍ≥†Ž•ľ ŪēėžėÄŽč§.
ŪėąžÜĆŪĆź ÍįźžÜĆŽ°ú žĚłŪēú ž∂úŪėą Ž∂ÄžěĎžö©žĚÄ Ž¶ľŪĒĄžĘÖ Ūôėžěź Ūēú Ž™ÖžóźžĄú ŽįúžÉĚŪēėžėÄžúľŽ©į, žĚī ŪôėžěźŽäĒ ŪėąžÜĆŪĆź 20,000/¬ĶLžóźžĄú ž∂úŪėąžĚī ŽįúžÉĚŪēėžó¨ ž†ÄŪėąŽüČžĄĪ žáľŪĀ¨Ž°ú žā¨ŽßĚŪēėžėÄŽč§. ŪēėžßÄŽßĆ žĚī Í≤ĹžöįŽäĒ Ž¶ľŪĒĄžĘÖžĚī žßĄŪĖČŪēėŽ©īžĄú žĘÖžĖϞ󟞥ú ž∂úŪėąžĚī ŽįúžÉĚŪĖąŽćė Í≤ĹžöįŽ°ú ŪėąžÜĆŪĆźÍįźžÜĆž¶ĚžĚė Žč®ŽŹÖ Ž¨łž†úŽ°ú Ž≥īÍłįŽäĒ žĖīŽ†§žõ†Žč§. ŽėźŪēú Žč§ŽįúÍ≥®žąėžĘÖ Ūôėžěź Ūēú Ž™ÖžóźžĄú ŪėąžÜĆŪĆź ž¶Ěžč̞̳žěź žąėžö©ž≤ī žěĎžö©ž†úŽ•ľ žā¨žö©ŪēėžėÄžßÄŽßĆ žĚīŽ°ú žĚłŪēī ŪėąžÜĆŪĆź žąėžĻėÍįÄ ž¶ĚÍįÄŪēėŽäĒ Ūö®Í≥ľŽ•ľ žĖĽžßÄŽäĒ Ž™ĽŪēėžėÄŽč§. žēĄžßĀÍĻĆžßÄ Ūē≠žēĒ žĻėŽ£ĆŽ°ú žĚłŪēú ŪėąžÜĆŪĆźÍįźžÜĆž¶Ěžóź ŪėąžÜĆŪĆź ž¶Ěžč̞̳žěź žąėžö©ž≤ī žěĎžö©ž†úžĚė žā¨žö©žĚÄ Í∑ľÍĪįŽ•ľ ž∂©Ž∂ĄŪěą žįĺÍłį žĖīŽ†§žöįŽ©į, žĶúÍ∑ľžóź ŽįúŪĎúŽźú 3žÉĀ žóįÍĶ¨žóźžĄúŽäĒ Ūē≠žēĒ žĻėŽ£Ć žú†Žįú ŪėąžÜĆŪĆźÍįźžÜĆž¶ĚžóźžĄú ŪėąžÜĆŪĆź ž¶Ěžč̞̳žěź žąėžö©ž≤ī žěĎžö©ž†úžĚė žā¨žö©žĚī ŽĆÄž°įÍĶįÍ≥ľ ŪėąžÜĆŪĆź ž¶ĚÍįÄ ŽįŹ ž∂úŪėą Ž∂ÄžěĎžö© ÍįźžÜĆžóź žěąžĖīžĄú žį®žĚīÍįÄ žóÜžĚƞ̥ Ž≥īÍ≥†ŪēėžėÄŽč§[
17]. ŽėźŪēú žßÄŪėąž†úŽ°ú ŽßéžĚī žďįžĚīŽäĒ Ūē≠žĄ¨žú†žÜĆžö©Ūēīž†ú(antifibrinolytic agent) ž§Ď ÍįÄžě• ŽĆÄŪĎúž†ĀžĚł Ū䳎†ąŽĄ•žāľžāį(tranexamic acid) žó≠žčú Ūėąžē°žēĒžĚė ŪėąžÜĆŪĆźÍįźžÜĆž¶ĚžĚė žėąŽį©ž†Ā Ūą¨žó¨žóźŽäĒ žú†Ūö®žĄĪžĚī žóÜžĚĆžĚī Ž≥īÍ≥†Žźú ŽįĒ žěąŽč§[
18]. Ž≥ł žóįÍĶ¨žóźžĄúŽŹĄ Ūē≠žēĒ žĻėŽ£ĆžĚė Ž∂ÄžěĎžö© ž§Ď ŪėąžÜĆŪĆźÍįźžÜĆž¶Ěžóź ŽĆÄŪēīžĄúŽäĒ ŽĆÄŽ∂ÄŽ∂Ą ŪäĻŽ≥ĄŪēú žąėŪėą ŽĆÄž≤ī žöĒŽ≤ēžĚĄ žčúŪĖČŪēėžßÄ žēäžēėŽč§.
Ž≥ł žóįÍĶ¨žĚė Žč§ŽįúÍ≥®žąėžĘÖ Ūôėžěź ž§Ď Í≥†žúĄŪóė žĄłŪŹ¨žú†ž†ĄŪēôž†Ā žĚīžÉĀ(high risk cytogentics)žĚĄ ÍįÄžßÄÍ≥† žěąÍ≥† žßĄŽč® žčúŽ∂ÄŪĄį žĹ©ŪĆ• žĻ®Ž≤ĒžĚī žěąžóąŽćė žėąŪõĄÍįÄ Ž∂ąŽüČŪēú Ūôėžěź Žč§žĄĮ Ž™Ö Ž™®ŽĎź Ž¨īžąėŪėąžĚĄ ÍįźžēąŪēīžĄú žĻėŽ£Ć ÍįēŽŹĄŽ•ľ Žāģž∑ĄŽč§. žĚī ž§Ď 3Ž™ÖžĚī žĻėŽ£Ć ŽįėžĚϞ̥ ŪöćŽďĚŪēėžßÄ Ž™ĽŪēú žÉĀŪÉúžóźžĄú 6ÍįúžõĒ žĚīŽāīžóź žā¨ŽßĚŪēėžėÄŽč§. ŽĒįŽĚľžĄú žßĄŽč® žčúŽ∂ÄŪĄį žě•Íłį žĻ®Ž≤ĒžúľŽ°ú žĚłŪēú ž¶ĚžÉĀžĚī žč¨Ūēú Žč§ŽįúÍ≥®žąėžĘÖ ŪôėžěźžóźžĄú Ž¨īžąėŪėąžĚĄ žĚīžú†Ž°ú žĻėŽ£Ć ÍįēŽŹĄŽ•ľ Žāģž∂ĒŽäĒ Í≤Éžóź ŽĆÄŪēīžĄúŽäĒ žĘÄ ŽćĒ žč†ž§ĎŪēīžēľ ŪēėÍ≤†žúľŽ©į, žĚīžóź ŽĆÄŪēú ŽćĒ ŽßéžĚÄ žóįÍĶ¨ÍįÄ ŪēĄžöĒŪē† Í≤ÉžúľŽ°ú Ž≥īžĚłŽč§.
Ž¨īžąėŪėą žĻėŽ£ĆŽäĒ ž°įŪėąŽ™®žĄłŪŹ¨ žĚīžčĚ ž†ĀžĚĎž¶Ěžóź ŪēīŽčĻŪēėŽäĒ ŪôėžěźžóźžĄú ŽćĒ ŪĀį žėĀŪĖ•žĚĄ ž§Ą Í≤ÉžúľŽ°ú žėąžÉĀŽźúŽč§. Ž≥ł žóįÍĶ¨žóźžĄúŽäĒ Žč§ŽįúÍ≥®žąėžĘÖ 7Ž™Ö ž§Ď 3Ž™ÖžĚÄ žĚīžčĚžĚī ÍįÄŽä•Ūēú žóįŽ†ĻžĚīžóąžßÄŽßĆ žěźÍįÄž°įŪėąŽ™®žĄłŪŹ¨ žĚīžč̞̥ žčúŪĖČŪēėžßÄ Ž™ĽŪēėžėÄŽč§. žôłÍĶ≠žĚė Žč®žĚľ ÍłįÍīÄ žóįÍĶ¨žóźžĄúŽäĒ 66Ž™ÖžĚė ŪôėžěźžóźžĄú žěźÍįÄž°įŪėąŽ™®žĄłŪŹ¨ žĚīžč̞̥ žčúŪĖČŪēėžėÄžúľŽ©į, Ž¨īžąėŪėą žĻėŽ£ĆŽ°ú žĚłŪēú žā¨ŽßĚŽ•†žĚī ŽÜížßÄ žēäžĚƞ̥ Ž≥īÍ≥†ŪēėžėÄŽč§[
2]. ŪēėžßÄŽßĆ Ž≥łžõźžóźžĄúŽäĒ Ž¨īžąėŪėą ž°įŪėąŽ™®žĄłŪŹ¨ žĚīžčĚžĚė Í≤ĹŪóėžĚī žóÜÍ≥† ŪėĄžě¨ÍĻĆžßÄ ÍĶ≠Žāī ŪÉÄ ÍłįÍīÄžĚė Ž≥īÍ≥†ŽŹĄ žóÜŽč§. Ž≥ł žóįÍĶ¨žóź ŪŹ¨Ūē®Žźú Ūôėžěź ž§Ď ŪĎúž§Ä žĻėŽ£ĆŽ°úŽäĒ žěźÍįÄž°įŪėąŽ™®žĄłŪŹ¨ žĚīžč̞̥ žčúŪĖČŪēėžėÄžĖīžēľ ŪēėžßÄŽßĆ ŽįõžßÄ Ž™ĽŪēú Žč§ŽįúÍ≥®žąėžĘÖ Ūôėžěź 3Ž™Ö ž§Ď 1Ž™ÖžĚÄ VMPŽ°ú Ūē≠žēĒ žĻėŽ£ĆŽ•ľ žčúŪĖČŪēėžėÄÍ≥†, ŪėĄžě¨ÍĻĆžßÄ 10ŽÖĄÍįĄ Ž∂ÄŽ∂Ą ŽįėžĚĎ žĚīžÉĀ žú†žßÄŪēėŽ©īžĄú žÉĚž°īŪēī žěąŽč§. žĶúÍ∑ľžóźŽäĒ Žč§ŽįúÍ≥®žąėžĘ֞󟞥ú žěźÍįÄ žĚīžčĚžĚī ŪēĄžöĒŪēúžßÄžóź ŽĆÄŪēú žĚėŽ¨łÍĻĆžßÄ ŽĆÄŽĎźŽźėÍ≥† žěąžĚĄ ž†ēŽŹĄŽ°ú žÉąŽ°úžöī žēĹž†ú(novel agents)žĚė žĻėŽ£Ć žĄĪž†ĀžĚī žĘčžēĄž°ĆŽč§[
19]. ŽĒįŽĚľžĄú ŽĻĄŽ°Ě ŪėĄžě¨ žßÄžĻ®Í≥ľŽäĒ ŽßěžßÄ žēäžßÄŽßĆ Ž¨īžąėŪėąžóź ŽĆÄŪēú ŪôėžěźžĚė žĘÖÍĶźž†ĀžĚł žč†ŽÖźžĚĄ ÍļĺÍłį žĖīŽ†§žöł Í≤Ĺžöį žÉąŽ°úžöī žēĹž†úŽ•ľ ŽćĒžöĪ ž†ĀÍ∑Ļž†ĀžúľŽ°ú ž†Āžö©Ūēú žĻėŽ£ĆŽ•ľ Í≥†Ž†§Ūēī Ž≥īŽäĒ Í≤ÉžĚī ŽŹĄžõÄžĚī Žź† žąė žěąžúľŽ©į, žĚīžóź ŽĆÄŪēú ŽćĒ ŽßéžĚÄ žóįÍĶ¨ÍįÄ ŪēĄžöĒŪēėÍ≤†Žč§.
ÍĶ≠ŽāīžóźžĄú ŽĻĄÍĶźž†Ā Žč§žąėžĚė Ž¨īžąėŪėą ŪôėžěźŽď§žĚė Ūē≠žēĒ žĻėŽ£ĆŽ•ľ Ž≥īÍ≥†Ūēú žā¨Ž°ÄŽäĒ Oh ŽďĪ[
16]žĚė ŽÖľŽ¨łžĚī žú†žĚľŪēėŽč§. žĚī ŽÖľŽ¨łžĚĄ Ž≥īŽ©ī Í≥†ŪėēžēĒžĚė Ūē≠žēĒ žĻėŽ£ĆŽäĒ Ž¨īžąėŪėąžĚī žēĄŽčĆ Í≤ĹžöįžôÄ ŽĻĄÍĶźŪēėžó¨ ŪĀ¨Í≤Ć žį®žĚīÍįÄ ŽāėžßÄ žēäžĚƞ̥ žēĆ žąė žěąŽč§. ŪēėžßÄŽßĆ Ūėąžē°žēĒžĚė Ūē≠žēĒ žĻėŽ£ĆžóźžĄúŽäĒ ŽĻąŪėą, ŪėąžÜĆŪĆźÍįźžÜĆž¶ĚŽŅźŽßĆ žēĄŽčąŽĚľ ŽįĪŪėąÍĶ¨ ÍįźžÜĆŽŹĄ ŽćĒ žč¨ŪēėÍ≤Ć ŽāėŪÉÄŽāėÍ≤Ć ŽźúŽč§. žĚīžôÄ ÍįôžĚÄ žÉĀŪô©žóźžĄú žč¨Ūēú ÍįźžóľžĚī ŽįúžÉĚŪēėžėĞ̥ Í≤Ĺžöį žĚľŽįėž†ĀžĚł Í≤ĹžöįŽ≥īŽč§ ŽĻąŪėą, ŪėąžÜĆŪĆź ÍįźžÜĆŽ°ú žĚłŪēú Ž¨łž†úÍįÄ ŽćĒ žč¨ŪôĒŽźėÍ≥†, žĚīŽ°ú žĚłŪēī Íįźžóľ žěźž≤īŽŹĄ ŽćĒžöĪ ž°įž†ąžĚī žēąŽźėŽäĒ žēÖžąúŪôėžĚī ŽįúžÉĚŪēėÍ≤Ć ŽźúŽč§. Ž≥ł žóįÍĶ¨žóźžĄú Ž¶ľŪĒĄžĘÖžúľŽ°ú žā¨ŽßĚŪēú 11Ž™Ö ž§Ď 4Ž™Ö(36.4%)žĚÄ ÍįźžóľžĚī ž£ľŽźú žõźžĚłžĚīžóąŽäĒŽćį, žĚī Í≤Ĺžöį Íįźžóľ ŽįúžÉĚ žčú ŪŹČÍ∑† ŪėąžÉČžÜĆ 4.5 g/dL (4.1-5.2), ŪŹČÍ∑† ŪėąžÜĆŪĆź žąėžĻė 53,000/¬ĶL (13,000-126,000), ŪŹČÍ∑† ŽįĪŪėąÍĶ¨ 1,100/¬ĶL (200-2,400)žėÄŽč§. ŽĒįŽĚľžĄú ž†ĀÍ∑Ļž†ĀžĚł Íįźžóľ žėąŽį©žĚī ŪēĄžöĒŪē† Í≤ÉžúľŽ°ú Ž≥īžĚīŽ©į, žąėŪėą ŽĆÄž≤ī žöĒŽ≤ēŽŅźŽßĆ žēĄŽčąŽĚľ žėąŽį©ž†Ā Í≥ľŽ¶ĹžĄłŪŹ¨ÍĶį žīȞߥžĚłžěź(granulocyte colony-stimulating factor, G-CSF) Ūą¨žó¨Ž•ľ ŽćĒžöĪ ž†ĀÍ∑Ļž†ĀžúľŽ°ú ŪēėŽäĒ Í≤ÉžĚī Ž¨īžąėŪėą žĻėŽ£ĆžóźŽŹĄ ŽŹĄžõÄžĚī Žź†žßÄžóź ŽĆÄŪēú žóįÍĶ¨ÍįÄ ŪēĄžöĒŪēėÍ≤†Žč§. žĚīžóź Ž≥łžõźžóźžĄúŽäĒ žĶúÍ∑ľ Ž¨īžąėŪėą Ūėąžē°žēĒ ŪôėžěźŽď§žĚė Íįźžóľ žėąŽį©žóź ŽĆÄŪēú ž†ĄŪĖ•ž†Ā ŪĒĄŽ°úŪ܆žĹúžĚĄ ž†Āžö©ŪēėÍ≥† žěąÍ≥†, žĚīžóź ŽĆÄŪēú žóįÍĶ¨Ž•ľ žßĄŪĖČ ž§ĎžĚīŽč§.
žěĄžĘÖÍłįžóź ž†ĎžĖīŽď§žóąžĚĄ ŽēĆžĚė ŪôėžěźžĚė Í≥†ŪÜĶžĚī ŽĻąŪėąŽ°ú žĚłŪēī žč¨ŪôĒŽźėŽäĒ ž†źžĚÄ Ž¨īžąėŪėą žĻėŽ£ĆžĚė Ž¨łž†úž†ź ž§Ďžóź ŪēėŽāėžĚīŽč§. žā¨ŽßĚ Ūôėžěź ž§Ď Ž¶ľŪĒĄžĘÖ ŪôėžěźžĚė 54.5%žóźžĄú ŪėłŪĚ°Í≥§ŽěÄ, 9.1%žóźžĄú ŪĚČŪÜĶžĚĄ ŪėłžÜĆŪēėžėÄÍ≥†(
Table 6), Žč§ŽįúÍ≥®žąėžĘÖžĚÄ 50%žóźžĄú ŪėłŪĚ°Í≥§ŽěĞ̥ ŪėłžÜĆŪēėžėÄŽč§. žĚīŽäĒ žĚľŽįėž†ĀžúľŽ°ú ŽßźÍłį žēĒ ŪôėžěźžóźžĄú ŪĚĒŪěą Ž≥ľ žąė žěąŽäĒ ž¶ĚžÉĀŽď§žĚīžóąžßÄŽßĆ ŽĻąŪėąŽ°ú žĚłŪēī žĘÄ ŽćĒ žč¨ŪôĒŽźėŽäĒ Í≤ĹŪĖ•žĚĄ Ž≥īžėÄŽč§. žĚīŽď§ Ž™®ŽĎź ŪėąžÉČžÜĆ 6 g/dL žĚīŪēėŽ∂ÄŪĄį ŽĻĄÍįēžúľŽ°ú žāįžÜĆŽ•ľ ž£ľžěÖŪēėŽäĒ ž°įÍłįžĚė žāįžÜĆ Í≥ĶÍłČ, žąėžē° ž†úŪēú ŽďĪ Ž≥īž°īž†Ā žĻėŽ£ĆŽ•ľ ž†Āžö©ŪēėžėÄžúľŽāė, žĘÄ ŽćĒ ž≤īÍ≥Ąž†ĀžĚīÍ≥† žč§žßąž†ĀžúľŽ°ú ŽŹĄžõÄžĚī ŽźėŽäĒ žôĄŪôĒ žĚėŽ£Ć žöĒŽ≤ēžĚī žöĒÍĶ¨ŽźėŽäĒ Ž∂ÄŽ∂ĄžúľŽ°ú Ž≥īžĚłŽč§.
Ž≥ł žóįÍĶ¨ŽäĒ žÜĆÍ∑úŽ™® ŪôėžěźŽ•ľ ŽĆÄžÉĀžúľŽ°ú Ūēú Žč®žĚľ ÍłįÍīÄ ŪõĄŪĖ•ž†Ā žóįÍĶ¨žĚīŽĮÄŽ°ú ŽßéžĚÄ ž†úŪēúž†źžĚī žěąŽč§. žöįžĄ† žóįÍĶ¨žóź ŪŹ¨Ūē®Žźú Ž¶ľŪĒĄžĘÖ ŪôėžěźžĚė ž°įžßĀ ŪÉÄžěÖžĚī Žß§žöį Žč§žĖĎŪēėžó¨ žĻėŽ£Ć žĄĪž†ĀžĚĄ ž†Ąž≤īž†ĀžúľŽ°ú žĚīžēľÍłįŪēėÍłįžóźŽäĒ Ž¨īŽ¶¨ÍįÄ žěąŽč§. Žč§ŽįúÍ≥®žąėžĘÖ žó≠žčú 7Ž™ÖžĚė ŪôėžěźÍįÄ Ūą¨žēĹŪēú žöĒŽ≤ēžĚī 5ÍįÄžßĞ̾ ž†ēŽŹĄŽ°ú žĄúŽ°ú Žč¨ŽĚľžĄú ŪēėŽāėžĚė Í≤įŽ°†žĚĄ ŽāīŽäĒ Žćį Ž¨īŽ¶¨ÍįÄ žěąŽč§. Í∑łŽ¶¨Í≥† Ūėąžē°žēĒžĚīŽĚľŽäĒ ž§Ďž¶Ě žßąŪôėžĚī žßĄŽč®Žźú ŪôėžěźŽď§žěĄžóźŽŹĄ Ž∂ąÍĶ¨ŪēėÍ≥† žĚīŽď§žóź ŽĆÄŪēú žĻėŽ£Ć Í≤įž†ē Í≥ľž†ēžĚī Í≥ľŪēôž†Ā, žĚėŪēôž†ĀžĚł Ž∂ÄŽ∂ĄžóźžĄú Ž≤óžĖīŽāė ÍįúžĚłžĚė žĘÖÍĶźž†Ā žč†ŽÖźžóź ŽćĒ žĘĆžöįŽźėžóąŽč§. žĚīž≤ėŽüľ ŽďúŽ¨ł žÉĀŪô©žóź ŽĆÄŪēú Ž∂ĄžĄĚžĚī Žėź ŪēėŽāėžĚė ž§ĎŽĆÄŪēú ž†úŪēúž†źžĚīŽĚľÍ≥† Ūē† žąė žěąÍ≤†Žč§. ŪēėžßÄŽßĆ žč§ž†úŽ°ú Ž¨īžąėŪėą žĻėŽ£ĆŽ•ľ Í≥†žßĎŪēėŽäĒ žč†ŽÖźžĚĄ ÍįĞߥ ŪôėžěźŽď§žĚī žó¨ž†ĄŪěą ž†ĀžßÄ žēäÍ≤Ć ž°īžě¨ŪēėÍ≥† žěąÍ≥† žĚīŽď§ ž§ĎžóźŽäĒ Ūėąžē°žēĒžĚī ŽįúŽ≥ĎŪēėžó¨ Ūėąžē°ŽāīÍ≥ľž†ĄŽ¨łžĚėŽ•ľ žįĺžēĄžė§ŽäĒ žā¨Ž°ÄŽŹĄ žěąÍłį ŽēĆŽ¨łžóź žĚīžôÄ ÍįôžĚÄ žóįÍĶ¨ŽäĒ žĚėŽĮłÍįÄ žěąžĚĄ Í≤ÉžúľŽ°ú žÉĚÍįĀŽźúŽč§.
Ž≥ł žóįÍĶ¨ŽäĒ ÍĶ≠Žāī žĶúžīąŽ°ú Ž¶ľŪĒĄžĘÖ, Žč§ŽįúÍ≥®žąėžĘÖ žĻėŽ£ĆŽ•ľ Ž¨īžąėŪėąŽ°ú žßĄŪĖČŪēú ŪôėžěźŽ•ľ ŽĆÄžÉĀžúľŽ°ú Ūēú žóįÍĶ¨žĚīŽč§. žÉĀŪô©žĚė ŪäĻžĄĪžÉĀ žēěžúľŽ°úŽŹĄ ž†ĄŪĖ•ž†Ā ŽĻĄÍĶź žóįÍĶ¨Ž•ľ žßĄŪĖČŪēėŽäĒ Žćį žĖīŽ†§žõÄžĚī žěąÍ≤†žßÄŽßĆ Ž¨īžąėŪėą ŪôėžěźŽď§žĚĄ ŽĆÄžÉĀžúľŽ°ú Ūēú žąėŪėą ŽĆÄž≤ī žöĒŽ≤ē, G-CSF žėąŽį© žöĒŽ≤ē, Ūē≠žÉĚž†ú žėąŽį© žöĒŽ≤ē ŽďĪžóź ŽĆÄŪēú ž∂ĒÍįÄž†ĀžĚł žóįÍĶ¨ÍįÄ žßÄžÜ枆ĀžúľŽ°ú žĚīŽ£®žĖīž†łžēľ Ūē† Í≤ÉžúľŽ°ú Ž≥īžĚłŽč§. ŽėźŪēú žěĄžĘÖÍłįžóź ž†ĎžĖīŽď§žóąžĚĄ ŽēĆ Ž¨īžąėŪėąŽ°ú žĚłŪēú ž¶ĚžÉĀ žôĄŪôĒŽ•ľ žúĄŪēú žôĄŪôĒ žöĒŽ≤ē ŪĒĄŽ°úŪ܆žĹú ŽßąŽ†®žóź ŽĆÄŪēú žóįÍĶ¨ŽŹĄ ŪēĄžöĒŪēėÍ≤†Žč§.






 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




