악성 간문부 담도 폐쇄에서 내시경 배액술의 최근 경향
Trends of Endoscopic Palliation for Advanced Malignant Hilar Biliary Obstruction
Article information
Trans Abstract
Malignant hilar biliary obstruction (MHO), an aggressive type of perihilar biliary obstruction caused by cholangiocarcinoma, gallbladder cancer, or other metastatic malignancies, has a poor prognosis. Surgical resection is the only curative treatment for biliary malignancies. However, most patients with MHO cannot undergo surgery upon presentation because of their advanced inoperable state or poor performance resulting from old age or comorbid diseases. Therefore, palliative biliary drainage is required to improve symptomatic jaundice and quality of life. Preoperative biliary drainage is controversial in resectable cases of MHO. Preoperative biliary drainage should be considered according to specific selection criteria. Palliative drainage is currently the mainstay of symptomatic treatment. Compared with percutaneous access, primary endoscopic palliation using plastic or metal stents has recently shown higher technical feasibility and clinical success without increasing the frequency of adverse events, even in high-degree MHO. However, the use of stents still has numerous limitations, including challenges in determining the optimal type of stent, number of stents, deployment method, and additional local therapies. Therefore, this report presents the current optimal endoscopic drainage status for MHO based on recent guidelines and published literature.
서 론
악성 간문부 담도 폐쇄(malignant hilar biliary obstruction, MHO)는 간문부를 침범하는 담도암(Klatskin tumor), 담낭암, 혹은 전이성 암이나 임파절 전이로 인한 폐쇄로 발생한다[1]. 2022년에 발표된 중앙암등록본부 자료에 의하면 2020년에 우리나라에서는 247,952건의 암이 새로이 발생했는데 담낭 및 기타 담도암이 전체 암의 3.0%로 9위에 해당하나 고령화와 더불어 점차 증가하는 추세에 있다. 그러나 대부분 진단 당시 외과적으로 근치적 절제가 어려운 경우가 많고 근치적 수술을 시행한 경우에도 완전 절제율이 떨어지며 재발률이 높아 5년 생존율이 10% 내외로 예후가 매우 불량하여 아직까지 난치성 질환으로 여겨진다. 따라서 수술적으로 완전 절제가 불가능하거나 고령 및 동반된 질환으로 수술이 어려운 환자에서 담도 배액술은 황달 해소와 증상 완화뿐 아니라 항암 치료나 방사선 치료 등을 시행하기 전 일차적인 치료로서 필수적이다[2]. 현재 MHO에서 담도 배액술은 내시경 배액술이 일차적인 방법으로 자리 잡고 있고 다양한 종류의 스텐트 및 시술 방법이 사용되고 있다. 또한 고식적인 항암 화학 요법이나 방사선 치료 외에도 국소적 내시경 치료를 이용한 광역학 치료(photodynamic therapy, PDT)나 고주파 절제술(radiofrequency ablation, RFA)과 같은 방법들도 함께 시도되고 있다.
그러나 여전히 MHO에서 내시경 담도 배액술은 기술적으로 어려운 경우가 많고, 시술 방법이나 스텐트에 따른 배액 방법이 다양하다. 따라서 최근 발표된 MHO에서의 배액술에 대한 가이드라인을 위주로 최근의 경향에 대해 알아보고자 한다.
본 론
MHO에서 적절한 배액을 위해서는 다음과 같은 시술 전 고려해야 할 요인들이 있다. 먼저 해부학적 이해와 배액 위치의 결정이 필요하다. MHO는 형태적으로 담도의 종양 침범 범위에 따라 잘 알려진 Bismuth 분류[3]로 나누는데 이는 수술적 절제 범위를 결정할 때뿐 아니라 담도 배액 위치를 결정하는 데에도 역시 중요하다. 고위부 협착(Bismuth-Corlette type III, IV)은 Bismuth type I, II 협착과 달리 양측 혹은 다발성으로 배액이 필요한 경우가 많다. 특히 조영제 주입 후 적절한 배액이 이루어지지 않는 경우 담도염, 간농양과 같은 합병증 발생 빈도가 높고 이는 사망률 증가에도 영향을 줄 수 있다. 따라서 고위부 협착에서는 배액 시술 전 배액할 위치 결정 및 적절한 방법 선택에 주의를 요한다. 배액 시술 전 multidetector computed tomography나 magnetic resonance image (MRI)/cholangiopancreatography (MRCP)는 진단 및 병기 설정에 가장 좋은 방법으로 수술적 절제 여부 결정뿐 아니라 담도 배액 위치 결정에도 중요한 역할을 한다. Computed tomography (CT)나 MRI를 이용한 3차원 영상을 이용해 사전에 배액 가능한 위치를 결정하고 종양에 의한 간실질 위축이나 간내담 도종양에 의한 viable lesion이 없는 경우는 가능한 불필요한 배액을 피하고 조영제 주입도 역시 최소화할 수 있다.
배액양은 Bismuth type II 이상의 MHO에서 적절한 배액을 위해서는 간 용적의 50% 이상 배액할 것을 권고하고 있다[4]. 간 용적의 50% 이상 배액하는 것이 그렇지 않은 군에 비해 생존율이 증가하였다(119 vs. 59 days, p= 0.005) [5].
따라서 고위부 MHO에서는 담도 배액 전 영상 결과를 통해 배액할 위치를 미리 결정해 불필요한 담도 삽관을 피하고 간 용적의 50% 이상을 배액하기 위한 내시경 배액술(endoscopic retrograde cholangiopancreatography, ERCP)과 경피 배액술(percutaneous transhepatic biliary drainage, PTBD)을 결정하고 스텐트 종류, 삽입 방법을 결정해야 한다. 또한 향후 치료 계획, 즉 수술적 가능성 여부와 기대 여명 및 항암 치료나 국소적 치료 계획 등을 고려한 배액 계획이 필요하다.
수술 전 담도 배액술(preoperative biliary drainage, PBD)
수술적 절제가 가능하다고 판단되거나 절제 여부를 명확히 판단하기 어려운 경우 모든 환자에서 PBD를 일률적으로 시행하는 것은 권고되지 않는다. 일차적인 PBD 적응증은 담도염, 고빌리루빈혈증과 연관된 영양장애, 간부전이나 신부 전이 있는 경우, 수술 전 항암 치료 등을 계획하는 경우나 수술이 지연되는 경우 등이다[6]. 또한 수술 후 남게 되는 간 용적이 30% 이하일 경우 수술 후 간부전 등의 합병증 위험이 높아 간문맥 색전술(portal vein embolization)을 통해 잔여 간 용적을 증가시키고자 하는데 이러한 시술 시 간부전의 위험성을 줄이기 위해 PBD가 선행되어야 한다[7].
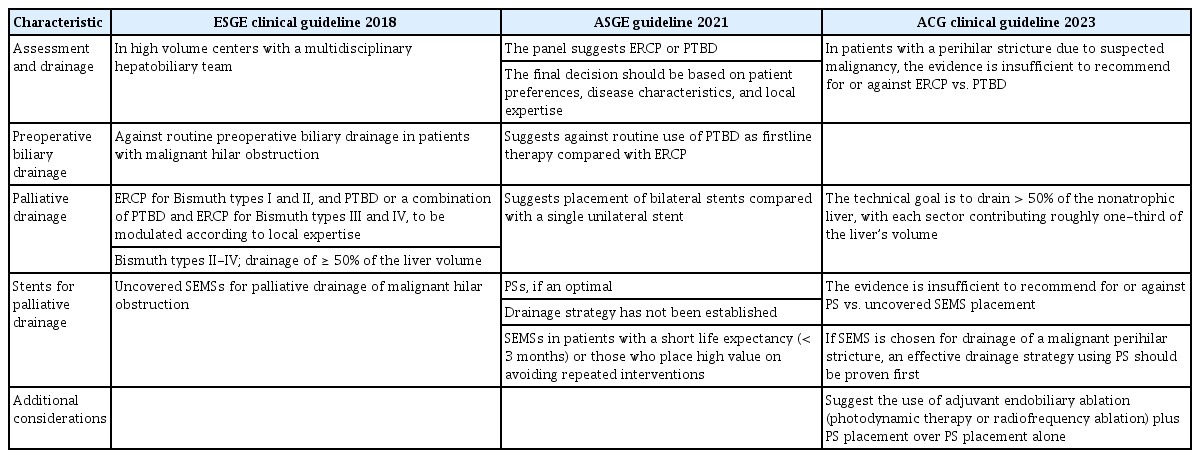
PBD 방법은 PTBD나 ERCP 모두 사용될 수 있는데 일반적으로 PTBD가 ERCP보다 기술적 성공률이 높고 담도염이나 췌장염 등 합병증이 낮다고 보고되고 있다. 그러나 다른 연구 결과에서는 PTBD를 시행한 군에서 morbidity가 높고 5년 생존율이 짧다는 보고가 있으며, 특히 복막 전이(peritoneal metastasis)의 빈도가 유의하게 높다고 하였다[8]. 2021년 American Society of Gastrointestinal Endoscopy (ASGE) 가이드라인에서도 이러한 이유로 일차적으로 PTBD를 권고하지는 않는다[9]. 현재 PBD는 ERCP를 기반으로 시행한다.
경피경간 담도 배액술과 내시경 담도 배액술
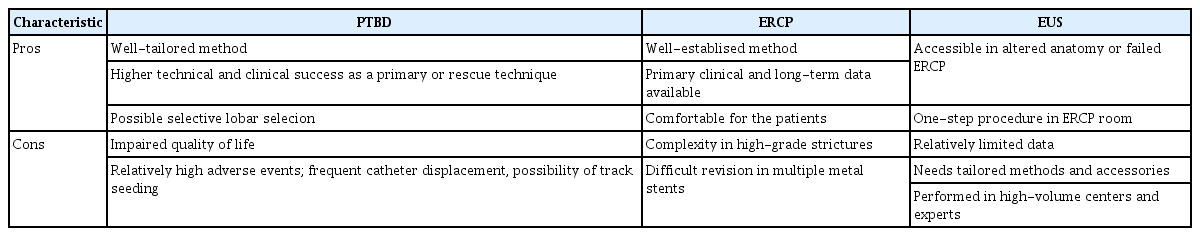
2013년 Asian-Pacific consensus [4]와 2018년 European Society of Gastrointestinal Endoscopy (ESGE) 가이드라인[10]에서는 고위부 협착에서 일차적으로 PTBD를 권고하고 있다. 메타 분석 연구에서도 PTBD가 기술적 성공률의 우위를 보이면서 기타 합병증이나 사망률 등에서도 차이가 없음을 보여주었다[11]. 그러나 숙련된 내시경 의사에서 ERCP의 기술적 성공률은 PTBD와 다르지 않고 합병증은 오히려 낮은 경향을 보인다[12]. 2021년 ASGE 가이드라인과 2023년 American College of Gastroenterology (ACG) 가이드라인에서는 숙련된 내시경 의사에 의한 ERCP를 권고하고, PTBD나 ERCP를 권고함에 있어 환자의 선호도, 질환의 특징, 숙련된 내시경 전문가의 상황에 따라 결정할 것을 권고하고 있다(Table 1) [9,10,13]. 따라서 숙련된 내시경 의사나 영상의학과 전문의에 따라 혹은 의료기관의 여건에 따라 일차적인 선호도가 다를 수 있고 두 시술 중 한 가지만 우선적으로 선택해야 하는 경쟁적인 관계보다는 보완적인 관계로 질환의 치료 난이도, 시술자 경험도, 환자 상태에 따라 상호 보완적으로 시행되는 것이 바람직하다. 또한 최근에는 초음파 내시경(endoscopic ultrasonography, EUS)의 술기 발전에 따라 ERCP가 실패한 경우 PTBD를 대체하는 방법으로 사용되고 있어 EUS를 이용한 배액술도 점차 증가하고 있다. 2022 ESGE 및 2023 ACG 가이드라인에서도 MHO에서 ERCP가 어렵거나 실패한 경우 EUS-guided biliary drainage (EUS-BD)를 권고한다. 단 EUS-BD는 다학제적 접근과 함께 숙련된 내시경 의사가 필요하다. 각 시술을 결정할 때는 결국 시술의 장단점과 시술 여건, 경험도에 따라 최선의 방법을 선택하는 것이 필요하다(Tables 1, 2).
배액관의 선택과 방법
플라스틱 스텐트(plastic stent)와 자가팽창형 금속 스텐트(self-expandable metal stent, SEMS)는 각각의 장단점이 분명하다. 플라스틱 스텐트는 비용이 저렴하고 삽입하기가 쉬울 뿐 아니라 스텐트 폐쇄 시 쉽게 교체할 수 있고 추가 삽입도 용이하다. 또한 MHO처럼 대부분 간외담도가 늘어나 있지 않은 상태에서 정상 담관의 내경을 인위적으로 확장시키기 때문에 발생 가능한 합병증이 적다는 장점이 있다. 그러나 플라스틱 스텐트는 구경이 상대적으로 작아 장기간 개존율을 유지하기 어렵다. 또한 상대적으로 매우 긴 길이(최소 10-12 cm 이상)의 스텐트를 간내담도에서 십이지장 유두부에 걸쳐 삽입하므로 십이지장 내용물의 역류 등에 의한 바이오필름(biofilm) 형성으로 스텐트 폐쇄나 스텐트 원위부가 막히기 쉽고 자연적 이탈 가능성도 증가할 수 있다[4,14]. SEMS는 담도 삽입 시 delivery catheter를 통해 삽입하게 되므로 심한 협착 통과 시 플라스틱 스텐트를 단순히 밀어서 삽입하는 것보다 기술적으로 오히려 더 쉽다. 또한 이론적으로 간내 분지하는 담도 세관들을 막지 않아 배액에 유리하고 플라스틱 스텐트보다 큰 구경으로 인한 스텐트 개존율을 증가시켜 재시술의 빈도를 줄일 수 있어 비용 대비 효과적이다[15].
2013년 Asia-Pacific consensus와 2018년 ESGE 가이드라인에서도 기대 여명이 3개월 이상 예상되는 Bismuth II-IV 간문부암에서 SEMS의 사용을 권고하고 있다[4,10]. 2021년 ASGE 가이드라인에서는 수술적 절제가 불가능한 간문부암에서 기대 여명이 3개월 이내로 반복적인 시술을 최소화하기 위한 경우 SEMS를 권고하고 있다[9]. 그러나 향후 치료 계획이나 수술적 절제 가능 여부가 불명확한 경우에는 먼저 플라스틱 스텐트를 권고한다. 어떠한 스텐트를 삽입하던 Bismuth type II 이상의 형태에서는 가능한 양측 혹은 다발성 배액을 권고하는데 이는 단순히 개수의 문제보다는 50% 이상의 간 용적 배액이 목적이다.
양측으로 스텐트 삽입하는 경우 플라스틱 스텐트와 달리 SEMS의 경우 stent-in-stent (SIS)와 stent-by-stent (side-by-side, SBS)로 시행하게 된다. 각 시술의 장단점이 있으나 최근의 메타 분석 연구에서는 SIS나 SBS 방법으로 스텐트 삽입 후 합병증이나 스텐트 개존율, 생존율 등은 차이가 없었으나 기술적 성공률이 SIS가 더 높았다[16]. 실제 기술적 성공률이 SIS에서 좀 더 높은 것은 일반적인 예상과는 다르지만, 이는 메타 분석에 포함된 연구가 매우 제한적이고 숙련된 내시경 의사에 의해 시행된 결과로 판단된다.
스텐트의 삽입 위치는 유두부를 통과해 십이지장 내까지 위치하는 방법과 담도 내 거치하는 방법이 있다. 십이지장 내로 위치하는 경우 스텐트 폐쇄 시 재시술이 용이하다는 장점이 있으나 십이지장 내용물의 역류로 인한 바이오필름, 슬러지 및 담석 형성, 담도염 등의 가능성이 높아질 수 있다. 담도 내에 거치하는 경우 이러한 가능성은 이론적으로 줄어들지만 실제 임상적으로 이러한 차이가 있는지 여부는 명확하지 않다. MHO에서 양측성(SBS) SEMS 삽입 시 유두부 위에 거치하는 방법과 유두부를 통과하여 십이지장 내로 거치하는 방법을 비교한 연구에서는 기술적 성공률이나 스텐트 개존 기간에는 차이가 없으나 췌장염 등 합병증 발생이 유두부를 통과하여 위치한 경우가 좀 더 높았다[17]. 이론적으로나 생리학적으로 스텐트가 담도 내에 위치하는 것이 유리할 것으로 생각되나 장기 생존 및 스텐트 폐쇄로 인한 이차 시술을 고려할 때 유두부를 통과하여 위치하는 것이 시술면에서는 좀 더 유리하다.
요약하면 수술적 절제가 불가능하거나 기대 여명이 길지 않아 반복적인 재시술을 최소화하기 위한 경우 혹은 기대 여명이 3개월 이상으로 장기간 스텐트 개존을 목적으로 하는 경우 SEMS가 권고되고, 수술적 절제 여부가 불분명하거나 항암 치료 후 재평가가 필요한 경우 혹은 반복적인 국소적 치료를 계획하는 경우 플라스틱 스텐트 삽입 후 정기적으로 교체하거나 이후 SEMS로의 교체가 적절하다.
EUS-BD
MHO에서는 EUS-BD는 일차적 배액 시술보다는 해부학적 변이로 ERCP를 이용한 접근이 어렵거나 일차적인 ERCP가 실패한 경우 또는 경유두적 시술로 재시술이 실패한 경우 전통적으로 시행해 오던 PTBD의 대안으로 권고되고 있다[18,19]. 금기는 일반적으로 조절되지 않은 혈액 응고 질환이 있거나 다량의 복수, 환자가 내시경 시술을 받을 수 없는 상태인 경우가 해당한다[20]. 기본적인 시술 방법은 좌측 간 내담관을 위를 통해 배액하는 EUS-guided hepaticogastrostomy (EUS-HGS) 외에도 십이지장에서 우측 간내담관으로 배액하는 EUS-guided hepaticoduodenostomy (EUS-HDS)와 bridging methods로 좌우 간내담관을 연결 후 HGS를 시행하는 방법이 있다. 또한 ERCP와 병행해서 경유두 배액과 EUS-HGS를 병용해 시행할 수 있는데 이는 한 가지 방법으로 충분한 배액이 어려운 경우 및 반대편 배액이 ERCP로 불가능하거나 실패한 경우 활용할 수 있다.
2022년 ESGE, 2023 ACG 가이드라인에서는 숙련된 내시경 의사에 의한 EUS-BD를 권고한다[13,21]. 현재까지 보고된 연구 결과들의 높은 시술 성공률과 낮은 합병증은 특정 상급병원 및 숙련된 내시경 의사에 의해서 시행된 결과로, 시술의 난이도와 합병증을 고려할 때 MHO에서 EUS-BD를 ERCP 정도로 일반화하기 위해서는 향후 보다 많은 경험과 연구 결과가 필요하다.
국소적 치료(local ablation therapy)의 역할
항암 치료나 방사선 치료는 수술적 절제가 어렵거나 불가능한 MHO 환자에서 담도 배액술 이후 시행할 수 있는 최선이다. 또한 전신적인 항암 치료와 더불어 국소적 치료이지만 스텐트 개존율의 증가와 나아가 생존율 향상을 위한 방법으로 국소적 종양 치료에 대한 관심이 지속되어 왔다. 항암 치료와 더불어 PDT와 RFA는 일부 연구에서 스텐트 개존율의 증가뿐 아니라 생존 기간의 연장에도 고무적인 연구 결과들을 보여주었다[22-24]. 2023 ACG 가이드라인에서도 수술적 절제가 불가능한 MHO에서 스텐트 단독 삽입보다는 추가적인 PDT나 RFA를 권고하고 있다[13]. 따라서 수술적 절제가 불가능한 MHO라고 하더라도 항암 치료와 국소적 치료로 인한 스텐트 개존 기간 및 생존율 증가에 따라 일차적 스텐트 삽입술 후 스텐트 폐쇄에 의한 재시술은 피할 수 없다. 따라서 교체 가능한 플라스틱 스텐트 삽입 후 정기적으로 교체하면서 추가적 치료를 지속하거나 치료 지속 여부, 기대 여명, 환자의 상태에 따라 SEMS로의 교체 등을 순차적으로 고려하여야 한다.
결 론
수술적 절제가 어렵거나 불가능한 고위부 MHO에서 일차적인 담도 배액술은 간기능 개선뿐 아니라 삶의 질 향상을 위해 필수적인 방법으로, 질환의 진행 정도, 시술자의 경험, 시술자 환경에 따라 PTBD나 ERCP가 사용된다. 최근 내시경 기술의 발전과 다양한 배액관 및 액세서리의 개발로 인해 플라스틱이나 SEMS를 이용한 ERCP가 일차적인 배액 방법으로 자리 잡았다. 효과적인 배액을 위해서는 가능한 많은 간 용적 배액을 위해 다발성 배액을 권고하나 다발성으로 SEMS 삽입 시에는 일차적인 기술적 난이도뿐만 아니라 이후 스텐트 폐쇄 시 재시술에 대한 기술적 고려가 필요하다. EUS-BD는 현재 일차적인 배액술로 고려되지는 않지만 ERCP를 이용한 배액이 어려운 경우 기존의 PTBD를 대신해 선택적으로 시행할 수 있다. 또한 고식적인 항암 치료나 방사선 치료 외에도 최근에는 PDT나 RFA 같은 국소적 치료 방법들이 시행됨으로써 스텐트의 개존 기간이 늘어나고 더불어 생존 기간의 연장에도 고무적인 결과를 보여주고 있다. 따라서 MHO에서 배액 시술 시에는 일차적인 스텐트 삽입뿐 아니라 이후 보조적 치료와 재시술에 대한 고려의 필요성이 점차 증가하고 있다. 즉 단순히 일차적 배액의 성공만을 고려할 것이 아니라 환자의 기대 여명과 향후 치료 계획에 따라 배액 전략이 달라져야 한다.
기존에는 MHO의 효과적인 배액술을 위해 과거 어떤 재질의 스텐트나 시술 방법이 보다 효과적인지에 초점이 맞추어졌다면, 최근의 가이드라인에서는 질환 정도, 환자의 상태나 치료 방향에 따른 효과적인 배액 알고리즘을 제시하고 있다.
Notes
CONFLICTS OF INTEREST
No potential conflict of interest relevant to this article was reported.
FUNDING
None.
AUTHOR CONTRIBUTIONS
All contributions are to Tae Hoon Lee.
Acknowledgements
None.