조기 수축의 진단과 치료
Diagnosis and Treatment of Premature Atrial or Ventricular Complexes
Article information
Trans Abstract
Premature atrial complex (PAC) and premature ventricular complex (PVC) are the most common arrhythmias. Most of them are benign, whereas some could be an initial sign of any underlying significant heart disease. Evaluation of daily burden and the presence of any association with underlying medical conditions are essential for proper assessment. Recently, newly developed electrocardiogram smart devices are widely available to document arrhythmias and identify correlations with symptoms. Management is required if the daily burden is high, patients are highly symptomatic, or significant structural heart disease is present. Antiarrhythmic drugs (AADs) are the first-line treatment, but if arrhythmias are drug-refractory or the patients are intolerable to AADs, catheter ablation is considered a good alternative in selected cases. In this paper, the proper diagnosis and management for PAC and PVC will be comprehensively reviewed.
서 론
심방 조기 수축 및 심실 조기 수축은 각각 심방 및 심실에서 기인하는 심장 근육의 수축을 말한다[1]. 심장의 리듬은 정상적으로 동방결절에서 생성된 맥박이 심전도계를 따라 심방, 방실결절, 좌각 및 우각, 퍼킨지 섬유를 거쳐 심실로 이동하여 심장이 수축함으로써 이루어진다[2]. 조기 수축은 병명에서 나타나듯 이러한 정상적인 맥박이 생성되기 전 조기에 심근이 수축하여 맥을 생성하므로 QRS 간격이 일시적으로 불규칙해지며 대개의 경우 다음 정상 박동이 나타나기 전 짧은 휴지기(pause)가 관찰되는 것이 심전도의 일반적인 특징이다[3].
이러한 조기 박동은 심방 및 심실근의 전기적인 과민성 때문에 발생하는 것으로 알려져 있으며 음주나 흡연, 과도한 카페인 섭취, 복용 약물, 전해질 불균형, 다른 전신 질환의 동반 또는 심근경색, 심근증이나 판막 문제 같은 심장의 구조적 문제 등이 복합적인 원인으로 작용한다[4,5]. 조기 수축의 증상은 다양한데, 빈도가 많아도 전혀 증상이 없이 우연히 심전도에서 발견되는 경우도 있는 반면 발생 정도에 비해 증상을 과도하게 느껴 내원하게 되는 경우도 많다.
일반적으로 빈도가 적고 뚜렷이 동반되는 다른 기저 병력이 없는 한 조기 수축은 양성 경과를 보이며 특별한 치료를 요하지 않는 경우가 많다[3,6,7]. 그러나 이러한 부정맥이 심각한 심장 질환의 첫 번째 증상 및 징후일 수 있어 주의가 필요하며 기본적인 병력 청취 및 검사는 필수적이다[8]. 평가 결과에 따라 치료가 필요하다 판단되는 경우, 항부정맥제를 통한 약물 치료를 우선적으로 권고하며 약물 치료에 반응이 없거나 약물 복용이 어려운 경우는 전극 도자 절제술을 통해 좋은 결과를 얻을 수 있다[4,5].
본고에서는 임상 현장에서 흔히 접할 수 있는 심방 및 심실 조기 수축의 적합한 진단 및 치료 방법에 대해 고찰하고자 하며, 이들 부정맥의 심전도 양상 및 예후에 대해서도 간략히 덧붙여 살펴보고자 한다.
본 론
심방 조기 수축 및 심실 조기 수축은 심근에서 발생한 조기 박동이라는 점에서 기전이나 원인, 일반적인 약물 치료 방법 등은 상당 부분 유사성을 보이고 있으나 발생 위치가 다르므로 심전도 양상은 확연히 다를 뿐만 아니라 임상적 예후나 전극 도자 절제술 같은 일부 치료 방법에 있어서는 뚜렷한 차이를 보인다.
조기 수축의 심전도 양상
심방 조기 수축은 동방결절이 아닌 일부 심방근육에서 맥을 생성하게 되므로, 정상 동율동과는 다른 형태의 P파를 보인다(Fig. 1A). P파 사이의 간격은 심방 조기 수축이 발생하면서 일시적으로 짧아지게 되고, 동방결절을 reset하므로 이어서 짧은 휴지기(pause) 이후 정상적인 P-QRS파가 관찰된다[9]. 일반적으로 방실결절 이하의 전도는 정상적으로 이루어지므로 심방 조기 수축의 QRS파형에는 변화가 생기지 않으나, 전도되는 시간차에 의한 aberrancy가 발생하는 경우 생리적으로 일시적인 각차단의 형태를 보여 정상 동율동과는 다른 형태의 QRS파를 보일 수 있는데(Fig. 1B) 선행하는 P파 여부로부터 심실 조기 수축과 감별할 수 있다[10]. 또는 심실의 불응기가 끝나기 전 심방 조기 수축이 발생하게 되면 심실로의 전도가 정상적으로 이루어지지 않아 QRS파가 관찰되지 않는 경우도 있다(non-conducted premature atrial complex, Fig. 1C) [11]. 심실 조기 수축은 심실에서 생성된 맥이 심실을 수축시킴으로써 QRS를 생성하므로 선행하는 QRS파와의 간격이 짧아지면서 정상 동율동과는 완전히 다른 형태의 QRS파형을 보이는 것이 특징이다(Fig. 1D). 만일 방실결 절을 통해 역행 전도를 하게 되면 QRS파 직후에 역행 전도된 P파형이 관찰되기도 한다[3].
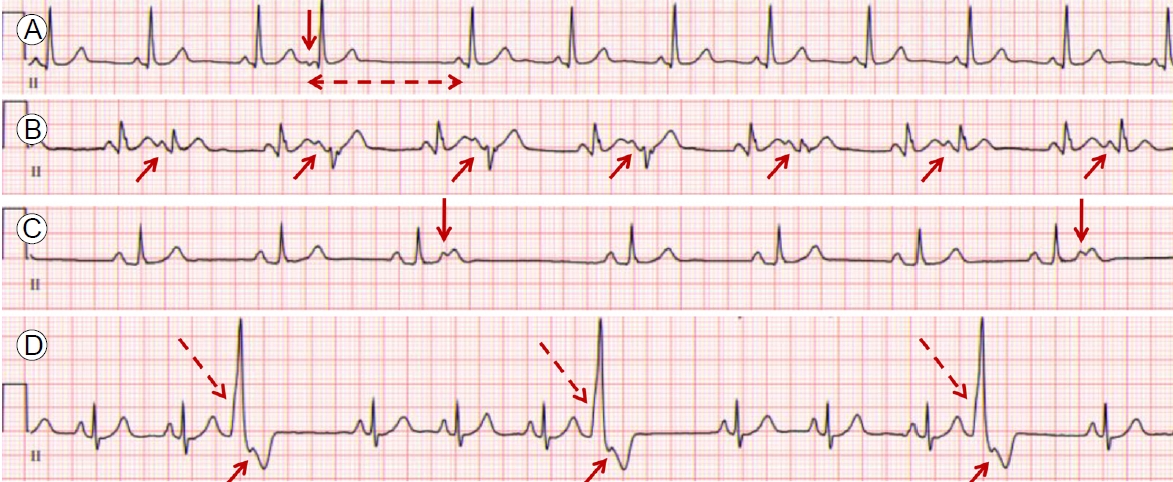
(A-C) Electrocardiogram of premature atrial complexes (PAC) and (D) premature ventricular complexes (PVC). (A) PAC (vertical arrow) occurs with a shorter coupling interval than normal P-P interval and is followed by sinus pause (broken arrow) and then normal sinus beat. Note that the morphology of P wave of PAC is different from that of sinus beat. A negative P wave in lead II suggests a low atrial focus. (B) PAC occurs with aberrant conduction (arrows). Because the level of functional block on conduction system is different according to coupling interval, QRS waves of aberrant PACs seem subtly different. (C) Non-conducted PAC (arrows). If coupling interval is too short, the atrioventricular node or ventricle is still refractory and the PAC is not followed by a QRS complex. (D) Premature wide QRS complex (long broken arrows) with retrograde P wave (short arrows) suggests PVC. No preceding P wave is noticed.
진단 및 평가
조기 수축의 진단과 평가에 있어 병력 청취, 신체진찰 및 심전도 확인은 필수적이다. 다른 질환의 이환 및 심장 구조적 이상 여부를 확인하기 위해서 혈액 검사 및 심장 초음파 검사는 시행하는 것이 권고되며, 일차적인 평가 이후 필요에 따라 추가적인 검사가 필요할 수 있다.
병력 청취 및 신체진찰
환자가 표현하는 증상으로부터 조기 수축 발생 여부를 의심할 수 있다. 흔히 표현하는 증상으로는 맥이 건너뛰는 듯한 두근거림, 짧은 순간 심장이 멈추거나 내려앉는 것 같은 느낌, 어지러움, 두통, 흉부 불편감, 숨참, 전신 무력감 등 다양하다[12,13]. 심장이 강하게 뛰는 느낌은 조기 박동 자체보다는 조기 박동 직후 휴지기 동안 심실 충만 시간이 길어지게 되므로 이어서 나오는 정상 박동의 심장 수축이 더 강해지면서 발생하는 증상인 경우가 많다. 반면 전혀 증상이 없이 우연히 발견되어 내원하는 경우도 있는데 조기 박동이 나오는 시간차나 발생 위치, 환자의 민감성에 따라 차이가 있는 것으로 추측되나 이러한 증상 유무를 예측하는 뚜렷한 인자나 기전은 모호하다[5].
조기 수축은 심장 외적인 문제로 인해 발생하는 경우가 흔하므로 폐 및 갑상선 질환을 포함한 기저 병력, 복용 중인 약제, 음주나 흡연력에 대한 확인은 필수적이다[14]. 조기 수축 자체는 일반적으로 유전성 질환으로 보고 있지 않으나 심실 조기 수축은 드물게 심실 빈맥이나 심실 세동 발생의 전조일 가능성이 있어 젊은 나이에 급사한 가족력이 있는지 확인이 필요하고, 이러한 경우 부정맥 유발성 우심실 심근증과 같은 유전성 심근병증이나 유전성 부정맥을 염두에 두어야 한다[4,15].
신체진찰을 했을 때 요골동맥 촉진이나 청진음으로부터 불규칙한 맥을 쉽게 느끼거나 들을 수 있다. 경정맥으로 중심 정맥압을 측정해보면 정상적으로 삼첨판이 닫힌 상태에서 심방이 수축할 때 그 압력이 중심 정맥으로 역행적으로 전달되어 캐논 a파가 생성되고 육안으로는 경정맥이 불룩해지는 것을 관찰할 수 있는데 심방 조기 수축이 심실 수축기 시 발생하면 이러한 현상이 더 도드라지게 되고 심실 조기 수축에서도 역시 관찰될 수 있다[3].
원인 감별을 위한 평가
전해질 및 갑상선 기능 이상, 빈혈 또는 심부전 등을 감별할 목적으로 일반적인 혈액 검사의 시행이 필요하며, 심장의 구조적 문제를 확인하기 위한 심장 초음파 검사 역시 적극적으로 권고된다[4,5]. 좌심실 구혈률, 국소벽 움직임 이상 여부, 심근증 또는 판막 질환 여부를 확인하는 것이 중요하다. 일차적인 평가에서 이상이 발견되는 경우, 필요에 따라 전기 생리학 검사, 관상동맥조영술, 심장 자기공명영상 진단 또는 전신 양전자단층영상 등을 추가로 시행해 볼 수 있다.
심전도 평가
다른 부정맥과 마찬가지로 조기 수축 역시 심전도로 확인이 되어야 확진이 가능하다. 조기 박동 빈도가 아주 높다고 하더라도 증상이 없을 수 있으며 이러한 경우는 검진 등의 다른 목적으로 확인한 심전도에서 발견되어 진단되는 경우가 많다. 반면 전형적인 조기 수축 증상을 보이나 빈도가 극히 낮은 경우는 일반적으로 10초 동안 기록하는 표준 12유도 심전도만으로는 감지가 어려우므로 심장 리듬 모니터링 시간을 충분히 확보하여 검사하는 것이 중요하다[16].
표준 12유도 심전도는 병의원에서 손쉽게 기록할 수 있는 방법이며 심전도에 기록된 조기 수축 파형으로부터 발생 위치를 대략적으로 추정할 수 있다[17,18]. 가령 심방 조기 수축의 경우 하부 유도인 유도 II에서 음성 파형을 보인다면(Fig. 1A) 심방의 아래쪽에서 기인했을 가능성이 높고, 전벽 심중격 유도인 V1에서 음성이면 우심방, 양성이면 좌심방에 병소가 있을 것으로 추정할 수 있다. 특발성 심실 조기 수축의 가장 흔한 발생 위치는 우심실 유출로인데, 심전도에서는 유도 V1에서 좌각 차단의 형태, 흉부 유도 이행대(precordial transition)가 유도 V4 또는 그 이하, 하부 유도에서 양성 파형, 유도 aVL에서 음성 QRS파가 관찰되는 것이 전형적이다(Fig. 2A).

Successful catheter ablation for premature ventricular complexes (PVC). (A) Electrocardiogram of a 28-year-old young lady showed frequent PVCs. Negative vector on lead V1 and aVL, initial positive vector on lead I, inferior axis, and precordial transition on lead V4 suggest PVC focus at RVOT. (B) After precise 3D mapping at RVOT, PVC was eliminated during radiofrequency energy delivery at posterior free wall. PA, pulmonary artery; RVOT, right ventricular outflow tract; RA, right atrium; RV, right ventricle; RAO, right anterior oblique; LAO, left anterior oblique.
조기 수축은 발생 빈도를 측정하는 것이 필수적인데 이러한 목적으로 24시간 활동 심전도 검사(Holter monitoring)가 표준 검사로 간주되어 왔다[19,20]. 하루 중 발생 빈도뿐만 아니라 연속해서 3개 이상의 조기 박동이 분당 100회 이상의 속도로 나타나는 심방 및 심실 빈맥의 동반 여부도 파악할 수 있으며, 환자가 증상 발생을 기록하는 경우 증상과의 관련성도 평가할 수 있어 한 번의 검사로부터 얻을 수 있는 정보가 많다. 그러나 발생 빈도가 날마다 일정한 것은 아니며 최다 빈도를 파악하려면 평균 6일까지의 관찰 기간이 필요하다는 연구 결과도 있어[21] 최근에는 간편한 패치 형태로 최장 2주까지 심전도를 기록하는 웨어러블 디바이스가 널리 이용되고 있다[1,22]. 대부분 간단히 버튼을 눌러 증상 발생 시각을 남기는 기능이 내재되어 있어 24시간 활동 심전도 검사에 비해 사용이 편리하다는 장점은 있으나 현재 통용되는 대부분의 디바이스는 단극 유도(single lead)이므로 간혹 파형의 해석이 어려운 경우가 종종 있어 판독에 주의를 요할 수 있다[23].
연속 심전도 검사는 아니지만 사용자가 증상 발생 시 즉각 심전도를 기록할 수 있는 웨어러블 디바이스나 스마트 워치의 사용도 활발하다[24,25]. 주로 스마트폰에 연동되어 심전도 기록을 남기는 형태인데 증상의 지속 시간이 아주 짧은 경우 기록을 놓칠 수 있고 검사 환경에 따라서 잡음이 과도하게 발생하는 단점이 있으나, 사용자 입장에서 즉각적으로 심전도를 확보할 수 있다는 큰 장점이 있어 연속 심전도로도 잘 발견되지 않는 경우 검사를 추천해 볼 수 있겠다.
치료
모든 경우의 조기 수축이 치료가 필요한 것은 아니다. 빈도가 지극히 낮고 일차적인 평가에서 이상이 전혀 없는 경우는 대개 양성 경과를 보이므로 질환에 대한 설명 및 환자 안심(reassurance)만으로도 충분할 수 있다. 만일 부정맥 발생 빈도가 높거나, 조기 수축의 증상이 반복적으로 나타나거나, 조기 수축이 원인이 되어 심기능이 저하된 경우는 치료를 고려해야 한다[4,5]. 유의미한 기저 심질환으로 인해 발생한 경우는 해당 질환에 대한 치료가 이루어져야 하며 각 질환에 대한 구체적인 치료는 본고에서는 논외로 한다. 조기 수축의 치료는 크게 생활 습관 교정, 항부정맥제 치료 및 전극 도자 절제술의 세 가지로 나누어 볼 수 있다.
생활 습관 교정(lifestyle modification)
생활 습관 교정만으로 조기 박동 치료가 가능한가에 대한 자료는 충분하지 않다. 그러나 신체 활동의 부족이나 흡연, 불안감 등의 스트레스는 조기 박동 빈도의 증가와 관련된다는 보고가 있으므로[26-28] 이에 대한 생활 습관 교정을 권고하는 근거로 활용될 수 있다. 음주와 관련해서는 연구 간 다소 상반된 결과를 보이고 있는데, 1,700명을 대상으로 한 스위스 코호트 연구에서는 알코올 섭취량과 심방 조기 수축 빈도와는 무관하다고 발표하였으며 Cardiovascular Health Study 및 Atherosclerosis Risk in Communities (ARIC) 데이터를 활용한 코호트 연구에서도 알코올 섭취와 조기 수축 발생 간 관련성을 입증하지 못한 반면[14,27,29,30] 하루 섭취하는 알코올의 양이 많을수록 상대적으로 심방 조기 수축이 증가한다거나[31,32] 단기간 알코올 섭취가 심실 조기 수축의 증가와 관련된다는 연구[33] 결과도 있다. 이는 연구마다 참여한 환자군의 특성이 다양하고 섭취한 알코올의 종류, 양, 빈도 등 인자들을 일관되게 통제하기 어려운 문제가 있어 다소 상반된 결과를 보이는 것으로 보인다[34]. 일반적인 기대와는 다르게 카페인은 조기 박동과의 관계가 다소 모호한데 약 1,400명을 대상으로 한 코호트 연구에서는 카페인 섭취가 심방, 심실 조기 수축 모두와 관련이 없다고 보고한 바 있다[35]. 최근 스마트 기기를 활용하고 전향적 무작위 대조 시험으로 진행되어 이목을 끈 CRAVE 연구[36]는 카페인을 섭취한 군이 그렇지 않은 군보다 심실 조기 수축은 51% 증가시키나 심방 조기 수축의 빈도에는 연관이 없는 것으로 보고하였다. 그러나 100명이 등록한 소규모 연구였고 대상자가 비교적 젊고 건강했으며 짧은 연구 기간 동안 관찰한 점 등의 한계가 있어 이 연구 결과만으로 단정 짓기에는 무리가 있어 보인다. 따라서 더 많은 연구 결과가 축적되기 전까지는 일부 생활 습관 교정에 대한 조언에 있어서는 환자 개별화가 필요하다 볼 수 있겠다.
항부정맥제(antiarrhythmic drugs)
심방 조기 수축은 베타 차단제(beta blocker)가 일차적 약물 치료제이다[37]. 비디히드로피리딘 계열의 칼슘 채널 차단제(non-dihydropyridine calcium channel blocker)의 역할은 뚜렷하지 않으나 심방 조기 수축으로부터 시작된 다양한 심방성 빈맥의 조절에는 효과적으로 사용할 수 있다[38]. 심실 조기 수축에서는 두 약제 모두 각 약제 사용의 금기증이나 심장의 구조적 이상이 없는 경우 일반적으로 저용량부터 안전하고 효과적으로 사용할 수 있다[4]. 베타 차단제는 교감신경 항진을 매개로 발생한 경우에 칼슘 채널 차단제보다 더 효과적으로 조기 수축의 발생을 억제시킬 수 있어 심실 유출로에서 기인한 심실 조기 수축에서 효과적이며, 칼슘 채널 차단제는 섬유속(fascicle)에서 기인한 경우 치료 성적이 특히 우수하다[4,9,39]
두 약제에 반응이 좋지 못한 경우 class IA, IC, III 계열의 항부정맥제를 사용할 수 있다[40-42]. 국내에서 IA 계열 약제는 의료 현장에서 쉽게 수급이 되지 않으므로 주로 IC 또는 III 계열 약제를 쓰고 있는데 플레카이나이드(flecainide), 프로파페논(propafenone), 필시카이나이드(pilsicainide) 또는 소탈롤(sotalol), 드로네다론(dronedarone), 아미오다론(amiodarone)이 그 예이다. 아미오다론 외에는 심부전에서 사용이 금기되어 있으며 이들 계열의 항부정맥제 사용은 또 다른 부정맥을 야기할 수 있고 심장 외적인 부작용도 드물지 않으므로 처방 시 추적 관찰에 주의를 요한다.
전극 도자 절제술(catheter ablation)
약물 치료에도 반응이 없거나, 약물 복용에 순응도가 떨어지는 경우 전극 도자 절제술을 고려해 볼 수 있다(Fig. 2B). 전극 도자 절제술은 심장 내에 여러 전극 도자를 넣고 부정맥 발생 장소를 정확히 찾아내서 고주파 전류를 주어 열에너지로 병소를 제거하는 원리이다. 전극 도자 절제술과 관련해서는 심방 및 심실 조기 수축에서 시술을 추천하는 정도나 효용성 면에서 다소 차이를 보이고 있다.
심방 조기 수축의 경우 전극 도자 절제술로 효과적으로 제거한 연구가 있으나[43,44] 장기적으로 볼 때 심방 조기 수축의 빈도를 시술적인 방법으로 적극적으로 줄이는 것이 좋은 예후로 이어지는가에 대한 뚜렷한 근거는 부족하다[5]. 따라서 국내 급여 규정에서도 심방 조기 수축 자체만으로는 시술 적응증이 되지 못하며 30초 이상 지속적인 심방 빈맥, 심방 조동 및 심방 세동으로 이환되는 경우 이들 지속성 부정맥에 대한 시술을 허용하고 있다. 반면, 심실 조기 수축은 미국 및 유럽 진료 지침에서도 특히 증상이 있거나 하루 발생 빈도가 10-15% 이상으로 높고 심기능 저하를 동반하는 경우 적극적인 시술을 권유하고 있다[4,45] 국내 급여 기준도 이에 상승하는 수준으로 시술을 허용하고 있고, 구체적인 조건은 두 달의 약물 치료에도 불구하고 15% 이상의 발생 빈도를 보이면서 좌심실 구혈률이 50% 이하이거나 증상을 빈번히 일으키는 경우, 심장 재동기화 치료 중인 환자가 약물 치료에도 10% 이상의 빈도를 보이는 경우, 또는 심실 조기 수축이 다형성 심실 빈맥이나 심실 세동을 유발하는 경우 시술을 시행할 수 있도록 규정하고 있다. 심실 조기 수축의 전극 도자 절제술 성공률은 발생 위치에 따라 차이를 보이는 데 유출로에서 기인한 경우에 가장 예후가 좋으며, 전체적인 성공률은 66-90%로 다양하게 보고되고 있다[46]. 심실 조기 수축으로 인한 심부전은 성공적인 절제술 후 유의하게 심기능 회복을 보이는 것으로 보고된다[20,47,48]
예후
조기 수축은 대개의 경우 양성 경과를 보이지만 빈도가 많으면 예후가 좋지 못하다. 임상적으로 유의미한 빈도의 기준치는 명확하지 않고 연구에 따라 다양한 결과를 보인다. 심방 조기 수축은 발생 빈도가 증가하면 심방 세동 발생, 인공 심박동기 삽입률, 뇌졸중 및 사망률의 증가와 연관되는 것으로 보고되었으며[19,49,50], 최근의 진료 지침에 따르면 논란의 여지는 있지만 24시간에 500개 이상의 빈도를 보일 경우 나쁜 예후로 이어질 수 있어 주의를 요하고 있다[5]. 심실 조기 수축은 기저 심장 질환이 동반된 경우 심실 빈맥이나 세동으로 이환되어 급사를 야기할 수 있어 위험성 평가가 중요하다. 구조적 심질환이 없다 하더라도 심실 조기 수축의 빈도가 많거나 심실 유출로 이외에서 발생한 경우, QRS 너비가 153 ms 이상인 경우, 선행하는 정상 QRS와의 간격이 300 ms 이하로 짧거나 일정하지 않은 경우, 선행하는 정상 T파에서 심실 조기 수축의 R파가 형성되는 경우(R on T 현상)는 심실 조기 수축으로 인해 심근 기능이 저하되는 위험 인자 및 예측 인자가 될 수 있다[51-54]. 심실 조기 수축의 유의미한 빈도 역시 연구마다 차이가 있으나 대부분의 심근 기능 저하는 하루 10% 이상의 빈도를 보이는 경우가 많다[20,51].
결 론
심방 및 심실 조기 수축은 임상에서 흔하게 접할 수 있는 부정맥이다. 본고에서는 이들 부정맥의 심전도 양상, 임상 증상, 적절한 진단 및 치료 방법, 예후에 대해 살펴보았다. 조기 수축은 대부분 양성 경과를 보이게 되나, 간혹 심각한 기저 심질환의 전조일 수 있으므로 연속 심전도 및 심장 초음파 검사는 필수적이고 평가 결과에 따라 환자 안심만으로 충분한 경우부터 적극적인 치료가 필요한 경우까지 경과도 매우 다양하다. 치료가 필요한 경우 일차적으로는 베타 차단제, 비디히드로피리딘 칼슘 채널 차단제, class IA, IC 또는 III의 항부정맥제가 우선적으로 고려되며, 약물 복용이 어렵거나 반응이 없는 경우 전극 도자 절제술을 시행할 수 있다.
Notes
CONFLICTS OF INTEREST
No potential conflict of interest relevant to this article was reported.
FUNDING
This work was supported by the Clinical Research Grant from Pusan National University Hospital in 2023.
AUTHOR CONTRIBUTIONS
Jinhee Ahn designed, wrote, and reviewed the manuscript.
Acknowledgements
None.