쇼그렌증후군의 새로운 분류 기준과 초음파 검사법
New Classification Criteria for Primary Sjögren's Syndrome and Salivary Gland Ultrasonography
Article information
Trans Abstract
Primary Sjögren’s syndrome (pSS) is a chronic autoimmune inflammatory disorder characterized by lymphocytic infiltration of exocrine organs. Since 1965, several sets of classification criteria for pSS have been proposed by single experts or groups of multidisciplinary specialists. In 2002, the American-European Consensus Group proposed new classification criteria, which have been widely used in both clinical trials and routine clinical practice. In 2012, updated classification criteria were approved by the American College of Rheumatology (ACR). The existence of two different sets of criteria emphasized the need for an international consensus. Using methods consistent with those employed to develop recent ACR/European League Against Rheumatism (EULAR)-approved criteria, new ACR/EULAR classification criteria for pSS were developed and endorsed in 2016. Salivary gland ultrasonography (SGUS) is a new imaging tool used to detect salivary gland abnormalities in pSS patients. Several reports on the utility of SGUS for pSS diagnosis have appeared. This review focuses on the new 2016 ACR/EULAR classification criteria for pSS and the clinical application of SGUS in patients with pSS.
서 론
쇼그렌증후군(Sjögren’s syndrome)은 침샘과 눈물샘 등 외분비샘이 염증세포 침윤에 의해 파괴되면서 구강 건조와 안구 건조를 특징으로 하는 만성 자가면역 질환이다. 건조 증세뿐만 아니라 약 30% 이상의 환자에서 관절염이나 간질성 폐질환 등의 다양한 샘외 증상(extra-glandular manifestations)이 동반된다. T 림프구와 B 림프구의 조절 장애가 쇼그렌증후군의 핵심 기전으로 알려져 있으며, 항-SSA/Ro 항체, 항-SSB/La 항체가 쇼그렌증후군의 주요한 자가 항체이다[1].
최근 유럽류마티스학회(European League against Rheumatism, EULAR)와 미국류마티스학회(American College of Rheumatology, ACR) 산하의 미국-유럽 합의 그룹(American-European Consensus Group, AECG)과 쇼그렌 국제공동임상연합(Sjögren’s International Collaborative Clinical Alliance, SICCA)의 연구자들이 협력하여 2016년에 ACR/EULAR 쇼그렌증후군분류 기준을 발표하였다[2]. 또한 최근 침샘 조직검사를 대체할 수 있는 비침습적 영상학적 검사로 초음파 검사가 대두되고 있으며, 2012년부터 쇼그렌증후군에서 침샘 초음파(salivary gland ultrasonography) 검사법을 정립하기 위한 다국적 연구가 진행 중이다[3]. 본고에서는 최근 발표된 2016년 ACR/EULAR 쇼그렌증후군의 분류 기준과 쇼그렌증후군에서 비침습적 진단 방법으로 최근 주목받고 있는 침샘 초음파에 대해 고찰해보고자 한다.
본 론
새로운 쇼그렌증후군 분류 기준의 필요성
1965년부터 여러 개의 쇼그렌증후군 분류 기준이 제안되었지만 지난 15년 동안에는 2개의 분류 기준만이 발표되었고 현재까지 널리 사용되어 있다. 첫 번째는 2002년 개정된 AECG 분류 기준이고(Table 1) [4], 두 번째는 2012년 ACR에서 발표한 분류 기준이다(Table 2) [5]. AECG 분류 기준의 경우 셔머 검사(Schirmer test)나 비자극 타액 속도 검사(unstimulated whole saliva flow rate)는 특별한 장비나 전문가가 없이도 검사가 가능하지만, 주관적인 건조 증상에 많이 의존하고 셔머 검사, Rose Bengal 검사와 같이 민감도와 특이도가 다른 검사를 포함시키는 문제점이 있다. ACR 분류 기준에서는 환자의 주관적인 증상을 배제하고 림프구성 침샘염(lymphocytic sialoadenitis)과 안구 염색 점수(ocular staining score, OSS)가 포함되어 좀 더 객관적인 면이 강화되었다. 그러나 OSS와 조직검사는 검사를 시행할 전문가가 필요하며 검사 자체가 번거롭고 시간이 많이 소모되어 일반적 진료에는 시행하기가 어렵다. 특히 침샘 조직검사는 침습적 검사로 부작용을 고려하면 일상적으로 임상에서 활용하기는 어려운 점이 있다. 또한 질병 초기에 OSS나 조직검사에서 분류 기준을 만족하지 못할 경우 조기 진단을 할 수 없다는 문제점이 있다.
미국의 오클라호마주와 미네소타주의 쇼그렌증후군 코호트를 대상으로 AECG와 ACR 분류 기준을 비교한 연구 결과 두 분류 기준의 일치율은 0.81로 높았다[6]. 그러나 이 연구에서는 두 분류 기준에 포함되어 있는 각막 염색 점수 간의차이점을 보여주었다. ACR 분류 기준에 포함되어 있는 OSS3점 이상은 민감도가 높고 특이도는 낮은 반면, AECG 분류기준의 항목인 van Bijsterveld score (vBS) 4점 이상은 민감도보다 특이도가 높은 검사법이다. 이 연구에서는 예상대로 OSS 양성률이 vBS 양성률보다 높았고, 약 25%의 환자에서는 OSS 검사는 양성이지만 vBS 검사는 음성이었다. 따라서 안침범에 대한 검사 항목에 관한 개정 및 두 분류 기준에 대한 국제적 합의의 필요성이 언급되었다.
현재까지 쇼그렌증후군의 치료는 증상을 개선하는 보존적 보충 치료 정도에 그치고 있었고 자연 경과를 호전시키는 근본적 치료는 없다. 그러나 다른 자가면역 질환에서 다양한 생물학적 제제들이 새로운 치료법으로 개발되고 사용됨으로써, 쇼그렌증후군에서도 이러한 치료법의 도입이 주목받게 되었다. 이에 따라, 새로운 치료 방법의 효과 검증을 위한 임상 시험에서 명확한 분류 기준의 필요성이 대두되었다. 2012년에 SICCA와 EULAR task force의 연구자들이 협력하여 International Sjögren’s Syndrome Criteria Working Group을 만들었다. 이 group은 2002년 AECG와 2012년 ACR 쇼그렌증후군 분류 기준에 포함되었던 항목들을 모아 국제적인 합의를 이룬 새로운 분류 기준을 개발하여 2016년에 새로운 ACR/EULAR 쇼그렌증후군 분류 기준을 발표하게 되었다[2].
2016년 미국류마티스학회/유럽류마티스학회의 쇼그렌증후군 분류 기준
2016년 ACR/EULAR에서 제안한 새로운 분류 기준은 객관적이고 비교적 쉽게 시행할 수 있는 검사법만을 포함시켜 총 5개의 항목으로 구성되어 있다(Table 3). 또한 분류 기준에 포함된 항목은 중요도에 따라 가중치 점수를 정하였고, 각각의 점수를 합산하여 총 4점 이상이면 쇼그렌증후군으로 분류할 수 있다. 이는 실제적인 임상 현장에서 쉽게 적용할 수 있다. 새로운 2016년 ACR/EULAR 분류 기준에서는 AECG 분류 기준과 마찬가지로 염증성 자가면역 질환의 특징을 강조하기 위하여 항-SSA/Ro 항체가 양성이거나, 작은 침샘 조직검사(minor salivary gland biopsy, MSGB)에서 focus score가 1점 이상인 림프구성 침샘염(focal lymphocytic sialadenitis)이 확인되어야 쇼그렌증후군으로 분류가 가능하다. 이 두 가지 검사에 가장 높은 점수인 3점이 부가된다. 그리고 적어도 한쪽에서 안구 염색 점수(OSS)가 5점 이상이거나 vBS가 4점 이상, 셔머 검사 결과 적어도 한쪽에서 5 mm/5min 이하 그리고 비자극 타액 속도 검사가 0.1 mL/min 이하이면 각각 1점이 부가된다[2].

American College of Rheumatology/European League Against Rheumatism classification criteria for primary Sjögren’s syndrome (SS): The classification of primary SS applies to any individual who meets the inclusion criteria,a does not have any of the conditions listed as exclusion criteria,b and has a score of ≥ 4 when the weights from the five criteria items below are summed [2]
2002년 AECG 분류 기준에 포함되었던 주관적인 건조 증상은 새로운 분류 기준에서 제외되었다. 그러나 AECG 분류 기준의 항목에 있는 건조 증상에 관한 질문을 이용하여 안구건조나 구강 건조 중 하나만 동반되어 있는 환자에도 2016년 ACR/EULAR 분류 기준을 적용할 수 있게 되었다. 또한 2016년 ACR/EULAR 분류 기준에서는 쇼그렌증후군이 전신 질환임을 고려하여, 건조 증상이 없는 환자에서도 EULAR Sjögren’s Syndrome Disease Activity Index의 도메인 중에서 한 개 이상이라도 양성이 확인되면 쇼그렌증후군의 분류 기준을 적용할 수 있다. 특히 전신 증상이나 B세포 활성화 지표들(B cell activation markers)은 특히 건조 증상은 거의 없는 젊은 환자들에서 흔하게 발생한다. 2016년 ACR/EULAR 분류 기준이 임상 연구에 포함될 환자를 모집하기 위한 연구 목적으로 만들어진 점을 고려하였을 때, 건조 증상은 뚜렷하지 않지만 전신 증상을 가진 쇼그렌증후군 환자들도 임상 연구에 참여할 수 있게 되었다. AECG 분류 기준에 포함되어 있는 항-SSB/La 항체 단독 양성 항목도 새 기준에서는 제외가 되었다. 항-SSA/Ro 항체는 주로 단독 혹은 항-SSB/La 항체와 함께 발견이 되지만, 항-SSB/La 항체만 단독으로 양성 소견을 보이는 경우는 많지 않다. 또한 항-SSB/La 항체 단독 양성인 쇼그렌증후군 환자와 항-SSB/La 항체 음성 쇼그렌증후군 환자를 비교하였을 때도 쇼그렌증후군의 임상적 표현형에는 차이가 없으며[7], 랜덤 포레스트(random forest)를 이용한 중요 변수 순위에서도 쇼그렌증후군 분류에 영향을 주지 못하였다[2]. 이를 근거로 항-SSB/La 항체는 2016년 ACR/EULAR 분류 기준 항목에서 빠지게 되었다.
2012년 ACR 분류 기준과의 차이점을 살펴보면 2016년 ACR/EULAR 분류 기준에는 셔머 검사와 비자극 타액 속도검사가 포함되었다. 그리고 OSS의 양성 기준이 3점에서 5점으로 상승되었으며 안과 의사가 안구 염색 지수를 시행하지 못하는 경우에는 vBS를 대안으로 이용하도록 하였다. 2012년 ACR 기준에서는 류마티스 인자와 항핵항체도 포함되어 이차성 쇼그렌증후군을 따로 구분하지 않았으나, 새로운 2016 ACR/EULAR 분류 기준에서는 류마티스 인자와 항핵항체는 제외되었다.
배제 기준에도 몇 가지 변경된 항목이 있다. 우선 IgG4 연관 질환(IgG4 related disease)이 추가되었고, C형 간염 확진을 위한 polymerase chain reaction 검사가 필수 항목으로 변경되었다. 그리고 림프종 발생 이후에 쇼그렌증후군이 진단되는 경우가 있기 때문에, 배제 기준에서 림프종은 제외되어 림프종 환자에서도 새로운 분류 기준을 적용할 수 있게 되었다.
쇼그렌증후군에서 침샘 초음파의 이용
2016년 ACR/EULAR 분류 기준에는 구강 침범을 평가하는 도구로 작은 침샘 조직검사와 비자극 타액 속도 검사만 포함하였고, 2002년 AECG 분류 기준에 포함되었던 타액선 조영술(sialography)과 타액샘 신티그래피(salivary scintigraphy)는 제외하였다. 림프구성 침샘염을 확인하기 위하여 시행하는 MSGB는 침습적인 검사 방법으로, 출혈과 통증 등 시술 후 합병증의 발생 가능성이 있고, 기관마다 검사의 정확도와 조직검사 결과의 해석이 다양하여 표준화가 필요하다. 반면에 침샘 초음파와 자기공명영상(magnetic resonance imaging, MRI) 검사 방법은 안전하고 직접적으로 주침샘(major salivary glands)의 이상 소견을 시각화할 수 있는 장점이 있다. MRI보다는 침샘 초음파가 경제적이고, 검사 시간이 적게 걸리며, 임상 의사가 쉽게 접근할 수 있는 검사법으로 쇼그렌증후군에서도 주목을 받게 되었다(Fig. 1) [8].
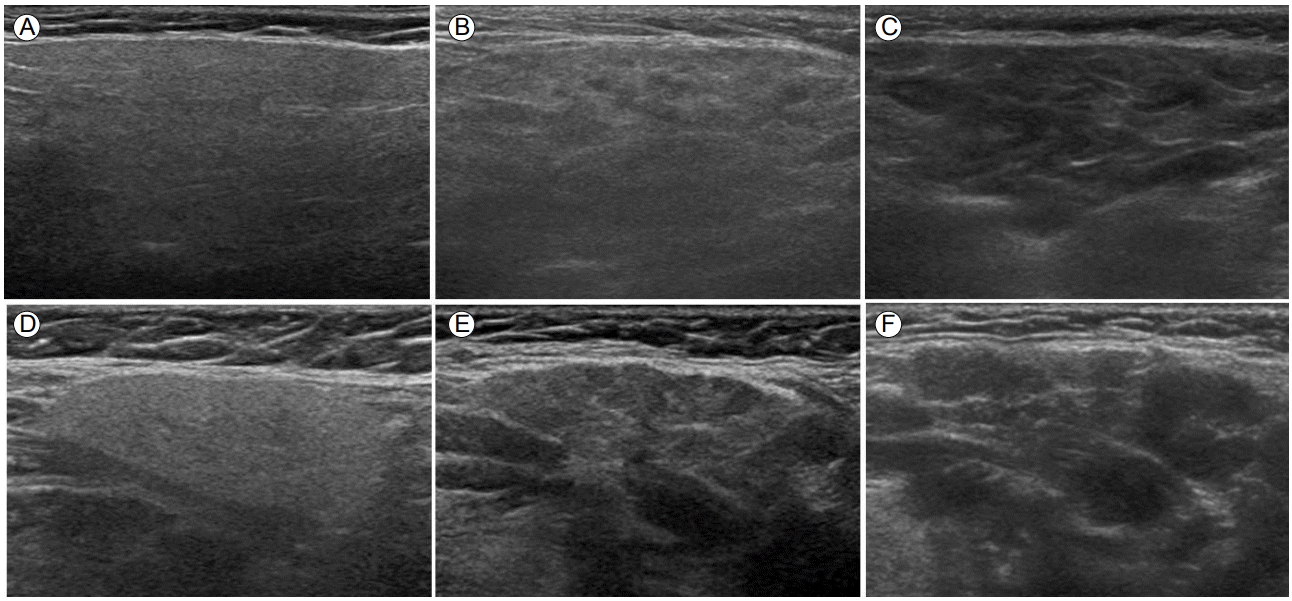
Ultrasonography of the parotid and submandibular glands. (A) A normal parotid gland. (B) A parotid gland with evident inhomogeneity and multiple hypoechoic areas. (C) A parotid gland with gross inhomogeneity, multiple hypoechoic areas, and decreased echogenicity. (D) A normal submandibular gland. (E) A submandibular gland with evident inhomogeneity and multiple hypoechoic areas. (F) A submandibular gland with gross inhomogeneity, multiple hypoechoic areas, and decreased echogenicity.
현재까지 B-mode를 이용하여 주침샘의 실질 이상(parenchymal abnormality)을 평가하는 다양한 초음파 점수 체계(score system)가 발표되었다. 침샘 초음파 점수 체계에는 에코발생도(echogenicity), 균질성(homogeneity), 저에코성 영역(hypoechoic areas), 고에코성 반향(hyperechoic reflect), 경계의 분명함(clearness of the borders of the glands) 등이 포함되어 있다[8]. 침샘 초음파와 다른 영상 검사들(sialography, salivary scintigraphy, MRI)을 비교한 연구들을 살펴보면 침샘 초음파가 더 높은 진단의 정확도를 보여주었다. 침샘 초음파의 민감도와 특이도는 각각 75-90%, 73-100%로 다양하게 보고되고 있다[9-12]. 이전에 발표된 두 연구에서는 2002년 AECG와 2012년 ACR 분류 기준에 salivary gland ultrasonography(SGUS)를 포함시키는 경우, 진단의 정확도가 향상되는 것을 확인하였다. 2002년 AECG 분류 기준에 SGUS 점수체계를 포함시키는 경우 특이도의 변화는 없이 민감도가 77.9%에서 87%로 증가하였다[13]. 2012년 ACR 분류 기준의 경우 민감도가 64.4%에서 84.4%로 향상되었고 특이도는 91.1%에서 89.3%로 약간 감소하였다[14].
현재까지 쇼그렌증후군에서 침샘 초음파 이상 소견과 주침샘(major salivary glands)의 조직 병리 검사를 직접적으로 비교한 연구는 없다. 그러나 MSGB와 침샘 초음파 점수 간의 연관성을 평가한 연구에서는 두 검사법의 양성률이 91%(kappa = 0.826)로 높은 일치율을 보여주었다[15]. 또 다른 연구에서는 침샘 초음파와 focus 점수 간의 연관성 검정에서 유의한 상관관계(r = 0.39)를 보여주었다[16]. 그렇지만 아직까지 침샘 초음파가 조직검사를 대체할 수 있다는 근거는 부족하며, 쇼그렌증후군의 진단에 침샘 초음파를 보편적으로 이용하기 위해서는 해결해야 할 과제가 많다.
쇼그렌증후군에서 침샘 초음파 사용의 향후 연구 과제
우선 대규모 환자를 대상으로 쇼그렌증후군을 구별해낼 수 있는 공통된 점수 체계를 수립하는 것이 중요할 것이다. 그 동안의 연구에서 공통된 쇼그렌증후군 환자의 침샘 초음파 이상 소견은 침샘 실질의 비균질성(parenchymal inhomogeneity)이다. 그러나 이전 연구들은 침샘의 크기, 고에코성반향, 샘내 석회화(intraglandular calcification), 경계의 분명함, Doppler로 평가하는 실질의 염증(parenchymal inflammation)등 각기 다른 평가 항목을 제시하고 있다. 따라서 합의된 초음파 점수 체계의 개발이 필요하다[8]. 둘째, 초음파의 단점중 하나는 다른 영상 검사에 비해 검사자의 주관적인 해석에 의존적이라는 것이다. 그러나 침샘 초음파의 검사자 간(interobserver) 또는 검사자 내 신뢰도(intraobserver reliability)를 평가한 연구가 많지 않다[17,18]. 향후 대규모의 다국적 연구를 통하여 침샘 초음파 검사의 신뢰성 검증이 필요하다. 셋째, SGUS를 쇼그렌증후군 초기에도 적용 가능한지에 관한 평가가 필요하다. Baldini 등[16]은 침샘 초음파를 5년 이하의 건조 증상을 가진 환자에서 쇼그렌증후군 진단에 이용하였고, 66%의 민감도, 98%의 특이도 그리고 97%와 73%의 양성예측률과 음성예측률을 보여주었다. 그러나 더 짧은 유병 기간을 가진 환자에서도 침샘 초음파가 진단에 유용할 것인지 등에 관한 연구가 향후 이루어져야 할 것이다. 마지막으로 침샘 초음파가 쇼그렌증후군 외의 염증성 질환을 감별할 수 있는지에 대한 조사가 필요하다. 기존의 연구의 대조군으로는 주로 특발성 건조 증후군(idiopathic sicca syndrome)이나 이차성 쇼그렌증후군이 포함되었다. 그러나 침샘 초음파가 IgG4 related disease, 사르코이드증, 이식편대숙주병과 같은 만성 침샘 염증성 질환과의 감별 진단에도 높은 특이도를 보여줄 수 있을지에 대한 추후 연구가 필요하다. 2012년부터 쇼그렌증후군의 침샘 초음파 검사 소견을 정립하기 위한 다국적 연구가 시작되었다[3]. 초음파 검사 항목이 추가된 추가된 새로운 분류 기준이 정립된다면 쇼그렌증후군 진단의 정확도를 더욱 향상시킬 수 있을 것으로 기대된다.
결 론
새로운 2016 ACR/EULAR 쇼그렌증후군 분류 기준의 장점은 다국적 전문가 위원들의 합의 과정을 이루었고 쇼그렌증후군을 질병의 초기에 발견이 가능하다는 점이다. 그러나 실제 임상에서 쇼그렌증후군의 진단에 새로운 분류 기준을 이용하기 위해서는 향후 다기관에서 유효성 검증이 필요하다. 또한 침샘 초음파는 쇼그렌증후군 환자에서 침샘의 구조적 이상을 확인할 수 있는 유용한 영상 검사이다. 그러나 다국적 연구를 통한 신뢰성 검증 및 표준화된 공통된 점수 체계 수립이 필요하다.

