카바페넴 내성 그람음성균 감염의 항생제 치료
Antimicrobial Therapy for Infections Caused by Carbapenem-Resistant Gram-Negative Bacteria
Article information
Trans Abstract
Carbapenem-resistance emerging in Gram-negative pathogens, such as Klebsiella pneumoniae, Pseudomonas aeruginosa, and Acinetobacter baumannii, has become a major human health problem globally. The therapeutic options available for carbapenem-resistant pathogens are very limited. Antibiotics such as colistin, tigecycline, fosfomycin, and aminoglycosides are often the only ones that can be used to treat carbapenem-resistant pathogens. Carbapenem may still be an option in certain circumstances. The administration of combination therapy for carbapenem-resistant pathogens is controversial. This review presents the current knowledge of available antimicrobial therapeutic options for infections due to carbapenem-resistant pathogens in Korea.
서 론
의학의 발전과 항생제내성을 극복하기 위한 인류의 끊임없는 노력에도 현재 우리는 다양한 내성균들의 위협을 받고 있다[1]. 내성균은 효과적인 항생제의 치료를 어렵게 하고 중증 감염 환자의 치료 경과에 심각한 악영향을 미치게 되는데 대표적인 주요 내성균은 ESCAPE으로 축약되는 Enterococci spp., Staphylococcus aureus, Clostridium difficile, Acinetobacter baumannii, Pseudomonas aeruginosa, Enterobacteriaceae이다[2]. 이 중에서도 새로운 항생제 개발이 거의 이루어지지 않고 있는 그람음성균의 항생제내성 증가 추세는 전세계 공중보건에 심각한 위협이 되고 있다[3].
카바페넴은 1980년대 처음 imipenem이 임상에 도입된 이후 meropenem, ertapenem, doripenem이 연이어 개발되었으며 세균 세포 투과성이 우수하고 여러 가지 β-lactamase에 안정하여 그람음성균에 의한 감염증 치료에 있어서 마지막 보류로 여겨져 왔다[4]. 그러나 카바페넴 사용이 많아짐에 따라 약제내성을 보이는 그람음성균이 전 세계적으로 증가하여 급기야 세계보건기구에서는 2017년 새로운 항생제 개발이 가장 시급한 우선 세균 목록에 카바페넴 내성 장내세균(carbapenem-resistant Enterobacteriaceae, CRE), 카바페넴 내성 A. baumannii (carbapenem-resistant A. baumannii, CRAB), 카바페넴 내성 P. aeruginosa (carbapenem-resistant P. aeruginosa, CRPA) 세 균주를 거론하게 된다. 따라서 본 연제에서는 전세계적으로 심각한 문제가 되고 있는 carbapenem 내성 그람음성균 감염에 대해서 CRE와 CRAB, CRPA 중심으로 적절한 항생제 치료에 대해서 논의하고자 한다.
내성 기전
그람음성균의 카바페넴에 대한 내성 기전은 크게 non-carbapenemase producing과 carbapenemase producing으로 나눌 수 있다. 전자는 세포외막단백(outer membrane protein)의 변화, penicillin 결합단백(penicillin-binding protein)의 친화도 혹은 발현량 변이, 유출펌프(efflux pump)의 과량 발현 등을 야기하여 단독 혹은 Extended-spectrum β-lactamase (ESBL) 또는 AmpC β-lactamase와 동반하여 카바페넴 내성을 획득하게 된다. 후자는 카바페넴을 직접 분해할 수 있는 효소인 carbapenemase를 생성함으로써 카바페넴 내성을 나타내는데 우리나라 CRE는 Klebsiella pneumoniae carbapenemase (KPC), Guiana extended spectrum β-lactamase (GES), New Delhi metallo-β-lactamase (NDM-1), Verona integron-encoded metallo-β-lactamase (VIM), imipenemase (IMP), oxacillinase (OXA)-48 등을, CRAB는 OXA-23, OXA-51 등을, CRPA는 IMP와 VIM type 등의 carbapenemase를 생성함으로써 카바페넴 내성을 나타낸다. Carbapenemase producing 내성 균주는 plasmid를 통하여 다른 균주로 내성을 전달할 수가 있어 의료 관련 감염에서 심각한 문제가 되고 있다[5,6].
역학
우리나라 31개의 병원의 데이터를 수집하는 국가 항생제 내성 정보(Korean Antimicrobial Resistance Monitoring System)에 따르면 2015년 P. aeruginosa에 대한 카바페넴 내성은 35%이며 A. baumannii에 대한 카바페넴 내성은 85%에 이른다[7]. 이러한 카바페넴 내성은 지역사회 감염을 일으키는 장내세균(Enterobacteriaceae family)에 속하는 Escherichia coli, Klebsiella pneumoniae, Entercobacter cloacae 등과 같은 균들에서도 보고가 되고 있는데, 국내에서는 2010년 처음 CRE가 보고된 이후[8], 대형 의료기관에서 산발적으로 보고되다가, 2015년부터 전국적으로 급속히 확산되는 추세이다[6].
치료
카바페넴에 내성을 보이는 그람음성균 치료시 카바페넴 내성이라고 하더라도 다른 계열 항생제 중 감수성이 있는 것이 있으면 투여가 가능하기 때문에 sulbactam에 감수성을 보이는 CRAB와 aztreonam에 감수성을 보이는 CRPA 감염증은 각각의 항생제를 우선적으로 고려할 수 있다. 하지만 대부분 colistin, tigecycline, aminoglycosides, fosfomycin 등 한정된 항생제에만 감수성을 보이고 있어 항생제 선택에 한계가 있다[9-11]. 카바페넴 그람음성균 감염증의 치료 원칙은 가급적 시험관 내에서 효과가 입증된 항생제를 선택하되 효과 스펙트럼, 영향 부위, 적응 및 금기사항을 고려하여 단일요법 혹은 병합요법을 선택한다.
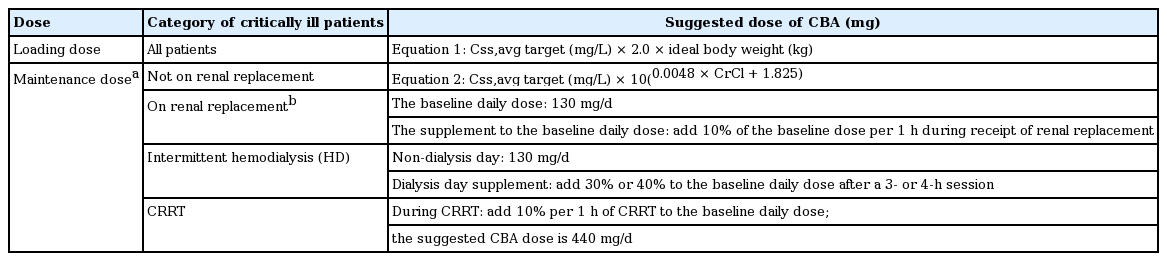
Colistin은 polymyxin E로 lipopeptide계 항생제이다. 대부분의 그람음성균에 효과가 있으나 Proteus spp., Providencia spp., Serratia marcescens, Morganella morganii, Burkholderia spp.에 항균력이 없으며 그람양성균과 혐기균에도 항균력이 없다[12,13]. 카바페넴 내성 그람음성균에 대해서 실험실적으로 가장 높은 감수성을 보이고 있어 카바페넴 내성 그람음성균 치료의 근간을 이루고 있다[14]. Colistin은 비활성 전구 형태인 colistimethate sodium (CMS)으로 전신 투여되어 colistin으로 체내에서 변환되어 그 효과를 나타낸다[12]. Colistin의 전구 형태인 CMS의 대부분은 체내에서 colistin으로 변환되기 전에 배설되고 colistin으로의 변환도 느려 치료 시작시 초기 부하용량을 사용하는 것이 중요하다[15]. 국내에 유통되는 CMS는 용량이 colistin base activity (CBA) 기준으로 되어있어 혼선 없이 colistin 용량으로 판단하여 투여가 가능하다. Colistin의 적절한 투여 용량에 대해서는 여전히 연구가 진행되고 있으며 여러 그룹에서 다소 다른 투여 용량을 권하고 있다[16,17]. PK study group은 2017년 colistin의 항균 효과에 필요한 체내 농도와 신독성을 증가시키는 체내 농도가 상당부분 중첩된다는 기존 데이터[17]를 근거로 colistin의 체내 평균 농도 목표(an average plasma steady state concentration of colistin)를 2 mg/L로 하여 새로운 투여 용량을 제안하였다(Table 1) [16]. Colistin은 colistin 최소 억제 농도(minimal inhibitory concentration, MIC)의 64배에 해당하는 약물 농도에서 균주가 재성장하거나 감수성 균주의 일부에서 heteroresistance 균주가 존재할 수 있어 단독 치료시 치료 실패 가능성이 염려된다[12,13]. 따라서 치료 실패 및 내성 발현을 막기 위하여 다양한 항생제와 병용해서 투여하려는 실험 연구와 시도가 이루어져 왔으며 carbapenems, sulbactam, tigecycline, rifampicin, fosfomycin, glycopeptides와 실험실적으로 상승 효과가 있는 것으로 나타났다[9,13,18,19]. 하지만 실제 임상에서 이러한 병용요법의 효과가 명확하게 증명된 바는 없다. 카바페넴 내성 그람음성균을 대상으로 한 22개의 임상연구를 대상으로 한 분석에서 colistin 단일요법이 colistin/carbapenem, colistin/tigecycline, colistin/aminoglycoside, or colistin/fosfomycin 병합요법보다 사망률이 높다고 나왔으나 저자들은 대부분의 연구가 후향적 관찰 연구였다는 근거로 병합요법을 표준 치료로 받아들이기에는 부족하다는 의견을 제시하였다[20]. 단 CRAB 감염증에서 colistin/rifampin과 colistin/fosfomycin 병합요법은 colistin 단일요법과 차이가 없다는 것이 저자들이 내릴 수 있는 결론이었다[20]. 다제내성 그람음성균을 대상으로 한 29개의 임상연구를 분석한 또 다른 연구에서도 병합요법이 단일요법에 비하여 우수하다는 결론을 도출하지 못하였다[21]. 단 하위집단 분석에서 고용량의 colistin 투여가 균혈증과 CRAB 감염증에서 사망률을 낮추는 것으로 나타났다. CRAB를 대상으로 최근 진행된 두 개의 무작위 임상연구에서도 colistin 단독요법과 colistin/rifampin 병합요법 혹은 colistin/carbapenem 병합요법을 각각 비교하였으나 사망률에서 두 군 간의 유의한 차이는 없었다[22,23]. 결론적으로 CRAB 감염증에서 colistin 병합요법은 단독요법에 비하여 우수성이 입증되지 않았으며 colistin 용량이 사망률과 관련이 있기에 부하용량을 포함한 colistin 투여 용량이 중요할 것으로 생각된다. 단 기존 권장되는 용법으로는 적절한 혈중 colistin 농도에 도달하기 어려운 환자군 즉, 신기능(creatinine clearance, CrCl) ≥ 80 mL/min인 환자 혹은 colistin MIC가 높은 환자군에서는 병합요법을 고려할 수 있겠다[17]. 한편 CRE 감염증을 대상으로 2013년 미국 8개 병원에서 시행된 연구에서도 단일요법과 병합요법 간의 사망률 차이가 없었다[24]. CRE 감염증을 대상으로 한 20개의 연구 692명을 대상으로 한 또 다른 분석에서는 병합요법이 중증 환자에서는 사망률을 낮추는 것으로 나타났다[25]. 4개국 22개의 센터를 대상으로 한 연구에서는 실험실적으로 감수성이 있는 항생제를 2개 이상 투여하였을 때 더 나은 임상 경과를 보이는 경향을 보였다[26]. 따라서 CRE 감염증에서는 추가 연구가 확인되기 전까지 여전히 병합요법을 고려해야 할 것으로 사료되며 CRAB 감염증과 마찬가지로 colistin 부하용량을 포함한 colistin 투여 용량이 중요할 것으로 생각된다. CRPA에 대한 colistin 단독요법과 병합요법에 대한 비교 연구는 충분한 데이터가 부족한 상황으로 추가 연구가 필요한 상황이다. Colistin이 전신 투여되었을 때 폐포세척액(bronchoalveolar lavage)에서 colistin이 검출되지 않는다는 연구 결과 이후[27] 카바페넴 내성 그람음성균에 의한 폐렴 환자에서 colistin 전신 투여와 함께 colistin 흡입 치료를 병행하는 시도가 있으나[28] 13개의 임상연구를 분석한 결과 흡입 치료의 병행이 사망률을 낮춘다는 결론을 내리기에는 부족하였다[29]. 부작용으로 신독성, 신경 독성 등이 문제가 되는데 329명의 환자를 대상으로 한 우리나라 연구에서는 colistin 투여 평균 6일 만에 43.5%에서 신독성이 발생하는 것으로 나타났다[30].
Tigecycline은 minocycline 유도체인 glycylcycline 계열로 그람양성균, 그람음성균, 혐기성균 등 다양한 균에 항균력이 있지만 P. aeruginosa, Proteus spp., Providencia spp., M. morganii에는 항균력이 없어 CRPA를 제외한 CRE, CRAB 감염증에서 고려해볼 수 있다. Tigecycline은 조직 투과도가 좋고 담즙에 고용량으로 배출되어[31] CRE 및 CRAB에 의한 피부 연조직 감염, 복강내 감염에서 효과적으로 투여할 수 있으나 혈중 농도가 낮아서 단독 사용시 타 항생제에 비하여 사망률이 높다는 미국식약청의 경고가 있었기에 균혈증이 동반된 중증 감염 시에 단독 사용은 주의를 요한다. CRAB 감염증을 대상으로 한 3개의 연구를 분석한 결과 tigecycline을 포함한 치료가 colistin을 포함한 치료군보다 사망률이 높은 것으로 나타났으나[32] tigecycline MIC 2 mg/L 이하에서는 두 병합요법 간의 사망률 차이가 없는 것으로 나타났다[33]. CRAB 균혈증을 대상으로 colistin/tigecycline 병합요법과 colistin/carbapenem 병합요법 비교 연구에서도 colistin/tigecycline군이 사망률이 더 높은 것으로 나타났으나 MIC 2 mg/L 이하인 균주만을 대상으로 하였을 때는 두 군 간에 차이가 없었다[34]. 표준용량은 100 mg을 loading dose로 투여 후 유지용량으로 50 mg 매 12시간 투여를 권하나 중증 감염 환자를 대상으로 한 연구에서 고용량의 tigecycline 투여 그룹이 임상 및 미생물학적 치료 성공률이 높았기에 중증 환자에서는 고용량 tigecycline 투여를 고려해 볼 수 있겠다[35]. CRE를 대상으로 하는 연구에서는 tigecycline과 gentamicin 혹은 colistin과 병합하여 치료하였을 때 92%의 성공률을 보였는데 이 연구에서도 고용량 tigecycline을 사용하였다[36]. 결론적으로 tigecycline은 연조직 감염, 복강내 감염에 사용하되 균혈증을 동반한 중증 감염인 경우에 단독 사용시 치료 실패 가능성이 있어 병합요법 및 고용량 사용을 고려해야 한다. 주된 부작용은 구역 등의 위장 증상인데 5명 중 1명 정도의 빈도로 비교적 흔하게 발생한다.
Aminoglycosides는 그람음성균 감염증 치료에 중요한 역할을 하는 항생제로 신장조직과 소변 중에 고농도로 존재하기 때문에 요로감염증 치료에 선택적으로 사용되며 단독 투여도 가능하다. CRE 요로감염증을 대상으로 polymyxin B 및 tigecycline과 비교하였을 때 미생물학적 호전이 가장 우수한 것으로 나타났다[37]. 요로감염 외에는 대부분 병합요법으로 사용되는데 50 case의 colistin 내성 CRE를 대상으로 한 연구에서는 gentamicin을 포함한 항생제 병합요법이 gentamicin을 포함하지 않은 병합요법에 비하여 현저히 낮은 사망률을 보였는데(20.7% vs. 61.9%), gentamicin MIC ≤ 2 mg/L에서 그 효과가 컸다[38]. 결론적으로 aminoglycosides는 요로감염증 치료에서 단독 투여를 고려할 수 있으며, 요로감염 외에는 병합요법으로 투여하되 카바페넴을 포함한 β-lactam 계열 항생제와 aminoglycoside 계열 항생제를 병합해서 투여하는 경우 상승 효과가 있으므로 항균제 감수성 검사에서 ‘intermediate’ 감수성을 보인 β-lactam 계열 항생제가 있다면 β-lactam계 고용량 지속 투여요법과 병합해서 투여를 고려해볼 수 있겠다. 주된 부작용은 신독성과 신경 독성이다.
Fosfomycin은 그람양성균과 그람음성균에 광범위하게 항균력을 가지고 있으나 P. aeruginosa와 Stenotrophomonas maltophilia에 높은 MIC를 보이고 A. baumannii와 M. morganii는 자연 내성을 가진다[39]. 국내에서는 경구용 제제만 사용이 가능한데 경구용 fosfomycin은 3 g 단회요법으로 4,000 mg/L을 초과하는 요중 최고 농도에 도달하여 72시간 동안 MIC 이상의 농도를 유지하는 것으로 알려져 있다[39]. CRE, CRPA를 포함한 다제내성균에 의한 요로감염을 대상으로 한 연구에서 경구용 fosfomycin을 하루 3 g씩 평균 3회 투여 시 미생물학적 호전이 59%에서 나타났다[40]. Fosfomycin은 단독 치료시 내성 발현이 쉬워 중증 환자에서는 주로 병합요법이 권장되고 있으며, 11명의 colistin 내성 CRE 중증 환자를 대상으로 한 연구에서는 정주용 fosfomycin을 colistin, gentamicin, piperacillin-tazobactam 등의 타 약제와 병합해서 사용하였을 때 사망률이 18.2%로 기존의 50%의 사망률보다 현저하게 낮은 것으로 나타났다[41]. 따라서 경구용 fosfomycin만 사용이 가능한 국내에서는 단독요법으로 CRE에 의한 방광염과 같은 단순 요로감염에서 사용을 고려해볼 수 있겠다. 주된 부작용은 설사와 소양감이 있다.
Carbapenem은 여전히 이견이 있으나 카바페넴 내성 그람음성균 치료에 있어서 병합요법의 일부로서 연구가 진행되고 있다. CRE 감염증 414명을 대상으로 시행된 분석에서는 병합요법이 단일요법에 비하여 사망률이 통계적으로 유의하게 낮았는데(27.4% vs 38.7%; p< 0.001), 카바페넴을 포함하는 병합요법 그룹에서 사망률이 가장 낮은 것으로 나타났다(18.8%) [42]. 이러한 사망률의 차이는 meropenem MIC ≤ 8 mg/L 이하인 CRE 균주에서 병합요법을 하였을 때 가장 크게 나타났다[43]. 카바페넴은 time above MIC가 살균 효과에 중요한 약제이므로 감수성이 저하된 균주에서 meropenem을 병합할 때는 3-4시간에 걸쳐 투여하는 지속 투여요법(extended infusion)을 권하며[44] 고용량 지속 투여요법이 감수성 극복에 효과가 클 것으로 예상된다[45]. 또 하나의 가능한 치료 방법으로는 ertapenem을 포함하는 double-carbapenem (DC) 용법이다. CRE를 대상으로 DC를 포함하는 병합요법이 카파페넴을 포함하지 않은 병합요법보다 사망률이 낮아 DC가 구제요법으로 고려할 수 있겠다[46]. 결론적으로 카바페넴은 carbapenem MIC에 따라 병합요법의 일부로 사용될 수 있으며 임상에서는 고용량 지속 투여요법을 고려해야겠다(Table 2).
새로 승인된 혹은 개발 중인 항생제
그람음성균의 항생제내성 기전 중 가장 중요한 것이 β-lactamase이므로 β-lactam 계열 항생제와 β-lactamase inhibitor를 결합시켜서 신항생제를 개발하려는 노력을 많이 하고 있다. 근래 미국식약청에서 승인된 항생제는 ceftolozane/tazobactam과 ceftazidime/avibactam, meropenem/vaborbactam이 있으며, 임상연구 중인 약제로는 imipenem/relebactam, aztreonam/avibactam 등이 있다. β-lactamase inhibitors를 포함하지 않은 새로운 약제로 fluorocycline 계열인 eravacycline과 aminoglycoside 계열인 plazomicin이 최근 새롭게 승인되었으며 siderophore cephalosporin 계열인 cefiderocol을 포함한 여러 약제들이 임상연구 중이다[47].
국내에 저박사(ZERBAXA®, MSD Korea Ltd., Seoul, Korea)라는 상품명으로 허가받아 곧 사용될 약제인 ceftolozane/tazobactam은 ceftazidime의 개량형인 ceftolozane과 β-lactamase 억제제인 tazobactam과 병합하여 개발된 약제다. Ceftolozane 은 P. aeruginosa에 의하여 생성되는 AmpC와 porin 혹은 efflux 펌프의 변이에 대해서 개선된 안정성을 가지고 있지만 metallo-β-lactamase이나 KPC와 같은 carbapenemase에는 내성을 보인다[48]. 국내에서 분리된 카바페넴 내성, non-carbapenemase-producing인 P. aeruginosa에 대한 ceftolozane/tazobactam의 효과는 95.2%에 감수성이 있는 것으로 나타나 carbapenemase를 분비하지 않는 CRPA에 의한 감염증에서 치료의 선택으로 고려해 볼 수 있겠다[49]. 복잡성 요로감염과 복잡성 복강내 감염에서 metronidazole과 병합 치료로 승인을 받았으며 0.5-1.0 g을 매 8시간마다 투여하되 투여시 1시간 이상 투여해야 한다. 폐렴에 대한 고용량(2 g 매 8시간 투여) 치료효과에 대하여 3상 임상연구가 진행 중이다.
결 론
최근 카바페넴 항생제 사용의 증가에 따라 카바페넴 내성 그람음성균 감염의 발생 빈도가 증가하고 있다. 카바페넴 내성 그람음성균 감염증의 치료에 있어서 colistin은 부하용량을 포함한 투여 용량이 중요할 것으로 생각되며 기존 권장되는 용법으로는 적절한 혈중 colistin 농도에 도달하기 어려운 환자군 즉, CrCl ≥ 80 mL/min인 환자 혹은 colistin MIC가 높은 환자군에서는 병합요법을 고려해야겠다. Tigecycline은 연조직 감염, 복강내 감염에 사용하되 중증 감염인 경우에는 단독 사용시 치료 실패 가능성이 있어 병합요법 및 고용량 사용을 고려해야 한다. Aminoglycosides와 fosfomycin은 요로감염증 치료에서 단독 투여를 고려할 수 있으며, 요로감염 외에는 병합요법으로 투여를 고려해 볼 수 있겠다. 병합요법에 대해서는 CRAB 감염증에서는 colistin 단독요법에 비하여 병합요법의 우수성이 입증되지 않았으며, CRE 감염증에서는 추가 연구가 확인되기 전까지는 여전히 병합요법을 고려해야 할 것으로 사료된다. 결론적으로 중증 카바페넴 내성 그람음성균 감염증에서는 가급적 시험관 내에서 효과가 입증된 두 가지 이상의 항생제를 선택하되 효과 스펙트럼, 영향 부위, 적응 및 금기 사항을 고려하여야 하며, 카바페넴은 MIC ≤ 8 mg/L인 경우에 병합요법의 일부로 사용될 수 있으며 고용량 지속 투여요법을 고려해야겠다.
카바페넴 내성 그람음성균 감염증 치료는 주로 실험실 연구와 후향적 임상시험 결과에 기반을 둔 권장 사항이기에 모든 권장 사항에는 제한적인 강도가 있음을 유념해야 한다. 따라서 카바페넴 내성균의 발생을 억제하기 위해서 카바페넴의 엄격한 항생제 사용과 내성균 관리가 중요하겠다.