 |
 |
| Korean J Med > Volume 95(5); 2020 > Article |
|
ņÜöņĢĮ
Ļ│ĀĒśĢņĢöņŚÉņä£ ļ░£ņāØĒĢśļŖö ņŗĀņ”ØĒøäĻĄ░ņØś ņøÉņØĖņØĆ ļ¦ēņä▒ ņé¼ĻĄ¼ņ▓┤ņŗĀņŚ╝ņØĖ Ļ▓ĮņÜ░Ļ░Ć ļ¦Äņ£╝ļéś ļ│Ė ņ”ØļĪĆņÖĆ Ļ░ÖņØ┤ ļ»ĖņäĖļ│ĆĒÖöņŗĀņ”ØņØ┤ ļÅÖļ░śļÉĀ ņłś ņ׳ņ£╝ļ»ĆļĪ£ ņ╣śļŻī ļ░®Ē¢ź Ļ▓░ņĀĢņØä ņ£äĒĢ┤ņä£ļŖö ņĪ░ņ¦ü Ļ▓Ćņé¼ļź╝ ĒåĄĒĢ£ ņĄ£ņóģ ĒÖĢņØĖņØ┤ ĒĢäņÜöĒĢśĻ▓Āļŗż. ļŗżļ░£ļé┤ļČäļ╣äņāśņóģņ¢æ1ĒśĢņŚÉņä£ ļ»ĖņäĖļ│ĆĒÖöņŗĀņ”ØņØ┤ ļÅÖļ░śļÉ£ Ļ▓ĮņÜ░ļŖö ĻĄŁļé┤ņŚÉņä£ ņ▓śņØīņ£╝ļĪ£ Ļ▓ĮĒŚśĒĢśņŚ¼ ļ│┤Ļ│ĀĒĢśļŖö ļ░öņØ┤ļŗż.
Abstract
Multiple endocrine neoplasia type 1 (MEN 1) is an autosomal dominant disorder characterized by two or more tumors of the parathyroid gland, duodenum-pancreas, and anterior pituitary. Membranous nephropathy is the most common manifestation of paraneoplastic glomerulopathy. However, minimal change disease in patients with MEN 1 has yet to be reported. Here, we report a case of minimal change disease in a 59-year-old man with MEN 1, along with a review of the relevant literature.
ļŗżļ░£ļé┤ļČäļ╣äņāśņóģņ¢æ1ĒśĢ(multiple endocrine neoplasia type 1, MEN 1)ņØĆ ļČĆĻ░æņāüņāś, ņŗŁņØ┤ņ¦Ćņן-ņĘīņן, ļćīĒĢśņłśņ▓┤ ņżæ ļæÉ Ļ││ ņØ┤ņāüņØś ļé┤ļČäļ╣äņāś ņĪ░ņ¦üņŚÉņä£ ņóģņ¢æ ļśÉļŖö ņ”ØņŗØņØ┤ ļ░£ņāØĒĢśļŖö Ļ▓āņØä ĒŖ╣ņ¦Ģņ£╝ļĪ£ ĒĢśļŖö ņ¦łĒÖśņØ┤ļŗż. 11q13 ņŚ╝ņāēņ▓┤ņŚÉ ņ£äņ╣śĒĢ£ MEN 1 ņ£ĀņĀäņ×ÉņØś ļÅīņŚ░ļ│ĆņØ┤Ļ░Ć ņøÉņØĖņ£╝ļĪ£ ļ░ØĒśĆņĀĖ ņ׳ņ£╝ļ®░, ņāüņŚ╝ņāēņ▓┤ ņÜ░ņä▒ņ£╝ļĪ£ ņ£ĀņĀäļÉ£ļŗż. ļé©ņä▒Ļ│╝ ņŚ¼ņä▒ņŚÉĻ▓ī Ļ░ÖņØĆ ļ╣äņ£©ļĪ£ ļéśĒāĆļéśļ®░, ļ░£ņāØ ļ╣łļÅäļŖö ņĢĮ ņØĖĻĄ¼ 3ļ¦ī ļ¬ģļŗ╣ 1ļ¬ģņ£╝ļĪ£ ļ¦żņÜ░ ļō£ļ¼Ė ņ¦łĒÖśņØ┤ļŗż. ņäĖ Ļ░Ćņ¦Ć ņĀäĒśĢņĀüņØĖ ļé┤ļČäļ╣äņāśņóģņ¢æ ņÖĖņŚÉļÅä ļČĆņŗĀĒö╝ņ¦łņóģņ¢æ, ĻĖ░Ļ┤Ćņ¦Ć, ņåīĒÖöĻ┤Ć, ĒØēņäĀņŚÉ ļ░£ņāØĒĢśļŖö ņ╣┤ļź┤ņŗ£ļģĖņØ┤ļō£ ņóģņ¢æ, ņ¦Ćļ░®ņóģ, ĒśłĻ┤Ćņä¼ņ£Āņóģ, ņĢäĻĄÉņ¦łņóģņØ┤ ļé«ņØĆ ļ╣łļÅäļĪ£ ļÅÖļ░śļÉśĻĖ░ļÅä ĒĢ£ļŗż[1]. Ļ│ĀĒśĢņĢöĻ│╝ ņŚ░Ļ┤ĆļÉ£ ņé¼ĻĄ¼ņ▓┤ ņ¦łĒÖśņØĆ ļ¦ēņä▒ ņé¼ĻĄ¼ņ▓┤ņŗĀņŚ╝ņØś ĒśĢĒā£Ļ░Ć ņĢĮ 70% ņĀĢļÅäļĪ£ Ļ░Ćņן ĒØöĒĢśĻ│Ā, ļ»ĖņäĖļ│ĆĒÖöņŗĀņ”ØņØś Ļ▓ĮņÜ░ Ļ│ĀĒśĢņĢöņŚÉņä£ļŖö ļō£ļ¼╝ļ®░, ņŻ╝ļĪ£ ĒśĖņ¦ĆĒé©ļ│æĻ│╝ ņŚ░Ļ┤ĆļÉ£ Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż[2]. MEN 1 ĒÖśņ×ÉņŚÉņä£ ļ»ĖņäĖļ│ĆĒÖöņŗĀņ”ØņØ┤ ļÅÖļ░śļÉ£ ņśłļŖö ņĢäņ¦üĻ╣īņ¦Ć ļ¼ĖĒŚīņāü ļ│┤Ļ│ĀļÉ£ ļ░ö ņŚåļŗż. ņØ┤ņŚÉ ņĀĆņ×ÉļōżņØĆ MEN 1 ĒÖśņ×ÉņŚÉņä£ ļÅÖļ░śļÉ£ ļ»ĖņäĖļ│ĆĒÖöņŗĀņ”ØņØä Ļ▓ĮĒŚśĒĢśņŚ¼ ļ¼ĖĒŚīĻ│Āņ░░Ļ│╝ ĒĢ©Ļ╗ś ļ│┤Ļ│ĀĒĢśļŖö ļ░öņØ┤ļŗż.
ĒÖśņ×É: 59ņäĖ ļé©ņ×É
ņŻ╝ņåī: ņĀäņŗĀ ļČĆņóģ
Ļ│╝Ļ▒░ļĀź ļ░Å Ēśäļ│æļĀź: ĒÖśņ×ÉļŖö ļé┤ņøÉ 3ļģä ņĀä ĒŚłļ”¼ĒåĄņ”ØņØä ņŻ╝ņåīļĪ£ ņŗ£Ē¢ēĒĢ£ ņ▓ÖņČö ņĀäņé░ĒÖöļŗ©ņĖĄņ┤¼ņśü ļ░Å ņ×ÉĻĖ░Ļ│Ąļ¬ģņśüņāü Ļ▓Ćņé¼ņŚÉņä£ ņĀäņØ┤ņä▒ Ļ│© ļ│æļ│ĆņØ┤ Ļ┤Ćņ░░ļÉśņ¢┤ Ļ│© ņĪ░ņ¦ü Ļ▓Ćņé¼ņÖĆ ņ¢æņĀäņ×Éļ░®ņČ£ņĀäņé░ĒÖöļŗ©ņĖĄņ┤¼ņśüņØä ņ¦äĒ¢ēĒĢśņśĆļŗż. Ļ▓Ćņé¼ Ļ▓░Ļ│╝ ņĀäņóģĻ▓®ļÅÖņŚÉ ņĢģņä▒ņ£╝ļĪ£ ņØśņŗ¼ļÉśļŖö ņóģņ¢æņØ┤ ļ░£Ļ▓¼ļÉśņŚłĻ│Ā Ļ│© ņĪ░ņ¦ü Ļ▓Ćņé¼ļÅä Ļ░ĆņŖ┤ņāśņŚÉņä£ ĻĖ░ņøÉĒĢśļŖö ņŗĀĻ▓Įļé┤ļČäļ╣äņóģņ¢æņ£╝ļĪ£ ĒÖĢņØĖļÉśņ¢┤ ņ¦äļŗ© ļ░Å ņ╣śļŻī ļ¬®ņĀüņØś ņóģĻ▓®ļÅÖ ņóģņ¢æņĀłņĀ£ņłĀņØä ņŗ£Ē¢ēĒĢśņśĆļŗż. ņĀäņóģĻ▓®ļÅÖ ņóģņ¢æņØĆ ņŗĀĻ▓Įļé┤ļČäļ╣äņóģņ¢æ(neuroendocrine tumor, intermediate grade)ņ£╝ļĪ£ ņ¦äļŗ©ļÉśņŚłĻ│Ā, ĒĢ©Ļ╗ś ņĀłņĀ£ĒĢ£ ņŗ¼ļéŁļ¦ē ņŻ╝ļ│ĆņØś ņŚ░ļČĆņĪ░ņ¦üņØĆ Ļ░ĆņŖ┤ņāśņóģ(thymoma, type B3)ņ£╝ļĪ£ ĒÖĢņØĖļÉśņŚłļŗż. ņØ┤Ēøä, ļŗżļ░£ļé┤ļČäļ╣äņāśņóģņ¢æņØä ņØśņŗ¼ĒĢśņŚ¼ ņŗ£Ē¢ēĒĢ£ Ļ▓Ćņé¼ņŚÉņä£ ļČĆĻ░æņāüņāśņ”ØņŗØņ”Ø(parathyroid hyperplasia), ļćīĒĢśņłśņ▓┤ Ļ▒░ļīĆņāśņóģ(pituitary macroadenoma), ļČĆņŗĀņāśņóģ(adrenal adenoma)ņØ┤ ņČöĻ░ĆļĪ£ ĒÖĢņØĖļÉśņŚłĻ│Ā, MEN1 ņ£ĀņĀäņ×ÉņØś 10ļ▓łņ¦Ė ņŚæņåÉ(exon) ļČĆņ£äņŚÉņä£ c.1378C>T, p.Arg460* ļÅīņŚ░ļ│ĆņØ┤Ļ░Ć ļ░£Ļ▓¼ļÉśņ¢┤ MEN 1ņ£╝ļĪ£ ņ¦äļŗ©ļÉśņŚłļŗż. ņłśņłĀ Ēøä ņŚÉĒåĀĒżņé¼ņØ┤ļō£(etoposide) + ņŗ£ņŖżĒöīļØ╝Ēŗ┤(cisplatin) ĒĢŁņĢöĒÖöĒĢÖņÜöļ▓Ģ 6ņŻ╝ĻĖ░ ļ░Å Ļ│© ņĀäņØ┤ ļČĆņ£äņŚÉ ļīĆĒĢ£ ļ░®ņé¼ņäĀņÜöļ▓ĢņØä ņŗ£Ē¢ēĒĢśņśĆĻ│Ā ļ░śņØæĒÅēĻ░ĆņŚÉņä£ ņĢłņĀĢļ│æļ│Ć(stable disease)ņØ┤ ĒÖĢņØĖļÉśņŚłļŗż. ļČĆĻ░æņāüņāś ĻĖ░ļŖźĒĢŁņ¦äņ”Ø(hyperparathyroidism)ņØ┤ ļ░£ņāØĒĢśņŚ¼ ļČĆĻ░æņāüņāś ņĀłņĀ£ņłĀņØä ņŗ£Ē¢ēĒĢśņśĆĻ│Ā, ļćīĒĢśņłśņ▓┤ņāśņóģ, ļČĆņŗĀņāśņóģņŚÉ ļīĆĒĢ┤ņä£ļŖö ņČöņĀü Ļ┤Ćņ░░ĒĢśņśĆļŗż.
2ļģä Ēøä ĒØēļČĆ ļ░Å ļ│ĄļČĆ ņĀäņé░ĒÖöļŗ©ņĖĄņ┤¼ņśü ņČöņĀü Ļ▓Ćņé¼ņŚÉņä£ ņĀäņóģĻ▓®ļÅÖ ņóģņ¢æņØś ņ×¼ļ░£ ņåīĻ▓¼ņØĆ ņŚåņŚłņ£╝ļéś, ņĘīņןļ»ĖļČĆ ņóģņ¢æņØ┤ ņāłļĪŁĻ▓ī ļ░£ņāØĒĢśņśĆĻ│Ā, ņ¢æņĀäņ×Éļ░®ņČ£ņĀäņé░ĒÖöļŗ©ņĖĄņ┤¼ņśü ļ░Å Ļ│© ņŖżņ║ö(bone scan)ņŚÉņä£ ņāłļĪŁĻ▓ī ļ░£ņāØĒĢ£ Ļ│© ņĀäņØ┤ļ│æļ│ĆņØ┤ ĒÖĢņØĖļÉśņ¢┤ ņĢöņØś ņ¦äĒ¢ē(disease progression) ņåīĻ▓¼ņØä ļ│┤ņśĆļŗż. ņĘīņןļ»ĖļČĆņĀłņĀ£ņłĀ ļ░Å ļ╣äņןņĀłņĀ£ņłĀņØä ņŗ£Ē¢ēĒĢśņśĆĻ│Ā, ņŗĀĻ▓Įļé┤ļČäļ╣äņóģņ¢æ(neuroendocrine tumor, grade 3)ņ£╝ļĪ£ ņ¦äļŗ©ļÉśņŚłļŗż. ņłśņłĀ Ēøä ņŚÉĒåĀĒżņé¼ņØ┤ļō£(etoposide) + ņ╣┤ļ│┤ĒöīļØ╝Ēŗ┤(carboplatin) ĒĢŁņĢöĒÖöĒĢÖņÜöļ▓ĢņØä ņŗ£ņ×æĒĢśņśĆļŗż. ĒĢŁņĢö ņ╣śļŻī 2ņŻ╝ĻĖ░ļź╝ ļ¦łņ╣śĻ│Ā ņĢĮ 2ņŻ╝ Ļ▓ĮĻ│╝ĒĢ£ ņŗ£ņĀÉļČĆĒä░ ņĀäņŗĀļČĆņóģ, ļŗ©ļ░▒ļć©, ņĀĆņĢīļČĆļ»╝Ēśłņ”ØņØä ļÅÖļ░śĒĢ£ ņŗĀņ”ØĒøäĻĄ░ņØ┤ ļ░£ņāØĒĢśņŚ¼ ņØ┤ļć©ņĀ£, ņĢłņ¦ĆņśżĒģÉņŗĀ ņłśņÜ®ņ▓┤ ņ░©ļŗ©ņĀ£ļź╝ Ēł¼ņŚ¼ĒĢśņśĆņ£╝ļéś ĒśĖņĀäļÉśņ¦Ć ņĢŖĻ│Ā ļČĆņóģ ņĢģĒÖöļĪ£ ņØæĻĖēņŗżņŚÉ ļé┤ņøÉĒĢśņŚ¼ ņ×ģņøÉĒĢśņśĆļŗż. ļé┤ņøÉ 5ņØ╝ ņĀä ĒśłņĢĪņÜöņåīņ¦łņåī 26.2 mg/dL, Ēśłņżæ Ēü¼ļĀłņĢäĒŗ░ļŗī 0.92 mg/dLņŚÉņä£ Ļ░üĻ░ü 56.5 mg/dL, 1.6 mg/dLļĪ£ ņāüņŖ╣ĒĢśņŚ¼ ĻĖēņä▒ ņŗĀĻĖ░ļŖź Ļ░Éņåīņ”ØņØä ļ│┤ņśĆņ£╝ļ®░, ņĢĮ 1ņŻ╝ņØ╝Ļ░ä ņ×ģņøÉ ņ╣śļŻīļź╝ ņ¦ĆņåŹĒĢśņśĆņ£╝ļéś 1.92 mg/dLļĪ£ ņŗĀĻĖ░ļŖź ĒśĖņĀäņØä ļ│┤ņØ┤ņ¦Ć ņĢŖņĢä ņŗĀņן ņĪ░ņ¦ü Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢśņśĆļŗż.
Ļ░ĆņĪ▒ļĀź: ĒÖśņ×ÉņØś ņ▓½ņ¦ĖļöĖņØĆ 4ļģä ņĀäņŚÉ ļČĆĻ░æņāüņāśņóģ, ļŗżļ░£ņä▒ Ļ│© ņĀäņØ┤ļź╝ ļÅÖļ░śĒĢ£ Ļ░ĆņŖ┤ņāśņĢöņóģņØ┤ ļ░£ņāØĒĢśņŚ¼ ĒĢŁņĢö ņ╣śļŻīļź╝ ļ░øņĢśĻ│Ā, ļéśļ©Ėņ¦Ć ļæÉ ļ¬ģņØś ņ×ÉļģĆ(ļöĖ 1, ņĢäļōż 1)ļŖö ņ”ØņāüņØĆ ņŚåņŚłņ£╝ļéś ĒÖśņ×ÉĻ░Ć MEN1ņ£╝ļĪ£ ņ¦äļŗ©ļÉ£ Ēøä ņ£ĀņĀä ņāüļŗ┤Ļ│╝ ņ£ĀņĀäņ×É Ļ▓Ćņé¼ļź╝ ņ¦äĒ¢ēĒĢśņśĆĻ│Ā ĒÖśņ×ÉņÖĆ ļÅÖņØ╝ĒĢ£ ļČĆņ£äņØś c.1378C>T, p.Arg460* MEN 1 ņ£ĀņĀäņ×É ļÅīņŚ░ļ│ĆņØ┤Ļ░Ć ĒÖĢņØĖļÉśņŚłļŗż.
ņé¼ĒÜīļĀź: 20ļģä ņĀäļČĆĒä░ ĻĖłņŚ░ ņ£Āņ¦Ć ņżæņØ┤ļ®░ ņØīņŻ╝ļĀźņØĆ ņŚåņŚłļŗż.
ņØ┤ĒĢÖņĀü ņåīĻ▓¼: ĒÖśņ×ÉļŖö ļ¦īņä▒ ļ│æņāēņØä ļ│┤ņśĆĻ│Ā ĒśłņĢĢ 153/97 mmHg, ļ¦źļ░Ģ 63ĒÜī/ļČä, ĒśĖĒØĪņłś 16ĒÜī/ļČä, ņ▓┤ņś© 36.2ŌäāļĪ£ ņĖĪņĀĢļÉśņŚłļŗż. ņØśņŗØņØĆ ļ¬ģļŻīĒĢśņśĆĻ│Ā ļæÉĻ▓ĮļČĆ Ļ▓Ćņé¼ņŚÉņä£ Ļ│Ąļ¦ēņØś ĒÖ®ļŗ¼ ņåīĻ▓¼ņØĆ ņŚåņŚłļŗż. ĒØēļČĆ ņ▓Łņ¦ä ņåīĻ▓¼ņŚÉņä£ ņłśĒżņØīņØĆ ļōżļ”¼ņ¦Ć ņĢŖņĢśĻ│Ā ņŗ¼ļ░ĢļÅÖņØĆ ĻĘ£ņ╣ÖņĀüņØ┤ņŚłņ£╝ļ®░ ņŗ¼ņ×ĪņØīņØĆ ļōżļ”¼ņ¦Ć ņĢŖņĢśļŗż. ļ│ĄļČĆ ņ¦äņ░░ņŚÉņä£ Ļ▓Įņ¦üņØĆ ņŚåņŚłņ£╝ļ®░ ņןņØīņØĆ ļōżļ”¼ņ¦Ć ņĢŖņĢśļŗż. Ļ░äņØś ļ╣äļīĆ ņåīĻ▓¼ņØĆ ņŚåņŚłĻ│Ā ļ╣äņןņØĆ ļ¦īņĀĖņ¦Ćņ¦Ć ņĢŖņĢśļŗż. ņĀäņŗĀ ļČĆņóģ, ĒŖ╣Ē׳ ļ│ĄļČĆņÖĆ ņé¼ņ¦ĆņØś ĒĢ©ņÜö ļČĆņóģņØ┤ Ļ┤Ćņ░░ļÉśņŚłĻ│Ā ņŗĀĻ▓ĮĒĢÖņĀü Ļ▓Ćņé¼ņŚÉņä£ļŖö ņØ┤ņāü ņåīĻ▓¼ ņŚåņŚłļŗż.
Ļ▓Ćņé¼ ņåīĻ▓¼: ņŗ£Ē¢ēĒĢ£ ĒśłņĢĪ Ļ▓Ćņé¼ņŚÉņä£ ļ░▒ĒśłĻĄ¼ 6,200/┬ĄL (ņżæņä▒ĻĄ¼ 62.3%, ļ”╝ĒöäĻĄ¼ 28.4%, ļŗ©ĒĢĄĻĄ¼ 7.3%, ĒśĖņé░ĻĄ¼ 0.5%, ĒśĖņŚ╝ĻĖ░ĻĄ¼ 1.5%), Ēśłņāēņåī 12.7 g/dL, ĒśłņåīĒīÉ 589,000/┬ĄL, ņ┤Ø ļŗ©ļ░▒ņ¦ł 4.2 g/dL, ņĢīļČĆļ»╝ 1.8 g/dL, ĒśłņĢĪņÜöņåīņ¦łņåī 56.5 mg/dL, Ēü¼ļĀłņĢäĒŗ░ļŗī 1.6 mg/dL, Ļ│äņé░ļÉ£ ņé¼ĻĄ¼ņ▓┤ ņŚ¼Ļ│╝ņ£©(estimated glomerular filtration rate, eGFR) 44.62 mL/min/1.73 m2, Ēśłņ▓Ł ņåīļööņøĆ 137 mMol/L, ņĢäņŖżĒīīļź┤ĒģīņØ┤ĒŖĖ ņĢäļ»ĖļģĖņĀäņØ┤ĒÜ©ņåī 40 U/L, ņĢīļØ╝ļŗīņĢäļ»ĖļģĖņĀäņØ┤ĒÜ©ņåī 30 U/L, ņĢīņ╣╝ļØ╝ņØĖ ĒżņŖżĒīīĒģīņØ┤ĒŖĖ 87 U/L, ņ┤Ø ņĮ£ļĀłņŖżĒģīļĪż 325 mg/dL, ņåīļ│Ć Ļ▓Ćņé¼ņŚÉņä£ ļŗ©ļ░▒ļć© 3+, Ēśłļć© 2+, RBC 1/HPF, ņåīļ│Ć ļŗ©ļ░▒ņ¦ł Ēü¼ļĀłņĢäĒŗ░ļŗī ļ╣äņ£©(spot urine protein/creatinine)ņØĆ 10.27, ņÜö ņåīļööņøĆ 20 mMol/L ļ»Ėļ¦īņ£╝ļĪ£ Ļ▓ĆņČ£ļÉśņŚłļŗż. Ēśłņ▓Ł ļ│┤ņ▓┤ ņłśņ╣śļŖö C3 169 mg/dL (90-180 mg/dL), C4 44 mg/dL (9-37 mg/dL) ņśĆļŗż. Anti-PLA2R immunoglobulin G < 0.6 RU/mLļĪ£ ņØīņä▒ņØ┤ņŚłļŗż. BĒśĢ Ļ░äņŚ╝ ĒĢŁņøÉ Ļ▓Ćņé¼ ļ░Å CĒśĢ Ļ░äņŚ╝ ĒĢŁņøÉ Ļ▓Ćņé¼ Ļ▓░Ļ│╝ļŖö ņØīņä▒ņØ┤ņŚłļŗż.
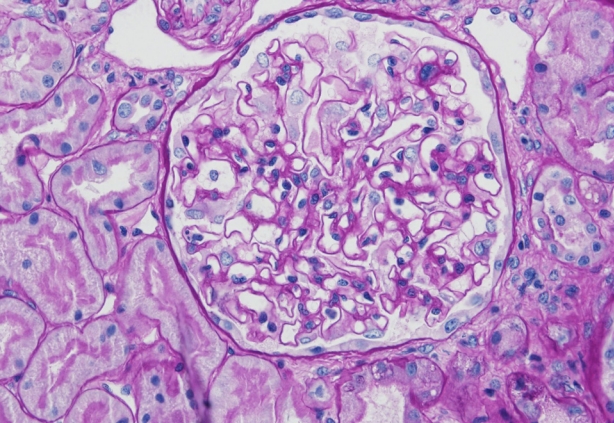
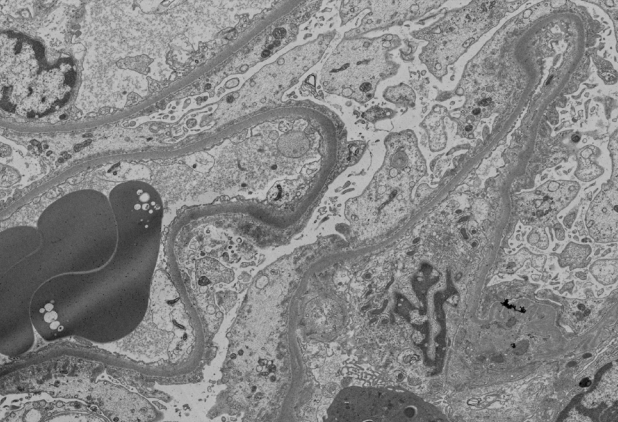
ņŗĀņן ņĪ░ņ¦ü Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢśņśĆĻ│Ā ļ»ĖņäĖļ│ĆĒÖöņŗĀņ”Ø(minimal change disease, MCD)ņØ┤ ņ¦äļŗ©ļÉśņŚłļŗż. 25Ļ░£ņØś ņé¼ĻĄ¼ņ▓┤(glomeruli)Ļ░Ć ĒżĒĢ©ļÉ£ ņŗĀņן Ēö╝ņ¦ł(renal cortex) ņĪ░ņ¦üņŚÉņä£ Ļ┤æĒĢÖ Ēśäļ»ĖĻ▓Į ņåīĻ▓¼ ņāü 2Ļ░£ļ¦ī ņĀäĻ▓ĮĒÖöņ”Ø(global sclerosis)ņØä ļ│┤ņØ┤Ļ│Ā, ļéśļ©Ėņ¦Ć ņé¼ĻĄ¼ņ▓┤ļōżņØĆ ļ¬©ļæÉ ņĀĢņāü ņåīĻ▓¼ņØ┤ņŚłņ£╝ļ®░, ņäĖļć©Ļ┤Ć, ņé¼ņØ┤ņ¦ł, ļ¬©ņäĖĒśłĻ┤ĆļÅä ņØ┤ņāü ņåīĻ▓¼ņØĆ ņŚåņŚłļŗż(Fig. 1). ļ®┤ņŚŁ ĒśĢĻ┤æ ņŚ╝ņāē ņåīĻ▓¼ņØĆ ņØīņä▒ņØ┤ņŚłĻ│Ā, ņĀäņ×É Ēśäļ»ĖĻ▓Į ņåīĻ▓¼ņāü ļŗżļ”¼ņäĖĒż ļÅīĻĖ░(podocytic process)ņØś ļ»Ėļ¦īņä▒ ņåīņŗż(diffuse effacement)ņØ┤ Ļ┤Ćņ░░ļÉśņ¢┤ ļ»ĖņäĖļ│ĆĒÖöņŗĀņ”ØņŚÉ ĒĢ®ļŗ╣ĒĢ£ ņåīĻ▓¼ņØ┤ņŚłĻ│Ā, ņĀäņ×ÉĻ│Āļ░ĆļÅäņ╣©ņ░®ļ¼╝(electron dense deposit)ņØĆ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż(Fig. 2).
ļ░®ņé¼ņäĀĒĢÖņĀü Ļ▓Ćņé¼: ļŗ©ņł£ĒØēļČĆņ┤¼ņśü ņåīĻ▓¼ ņŗ¼ņן ļ╣äļīĆ Ēś╣ņØĆ ĒÅÉļČĆņóģ ņåīĻ▓¼ņØĆ ņŚåņŚłļŗż.
ņ╣śļŻī ļ░Å Ļ▓ĮĻ│╝: ĒÖśņ×ÉļŖö ņŚÉĒåĀĒżņé¼ņØ┤ļō£ + ņ╣┤ļ│┤ĒöīļØ╝Ēŗ┤ 2ņŻ╝ĻĖ░ ņ¦äĒ¢ē Ēøä ņŗ£Ē¢ēĒĢ£ ļ░śņØæĒÅēĻ░ĆņŚÉņä£ ņĢöņØś ņ¦äĒ¢ē(disease progression)ņØä ļ│┤ņśĆņ£╝ļ»ĆļĪ£ ļÅģņåīļŻ©ļ╣äņŗĀ(doxorubicin)ņ£╝ļĪ£ ĒĢŁņĢöĒÖöĒĢÖņÜöļ▓ĢņØä ļ│ĆĻ▓ĮĒĢśņŚ¼ 2ņŻ╝ĻĖ░Ļ╣īņ¦Ć ņ¦äĒ¢ēĒĢśņśĆĻ│Ā, ļ»ĖņäĖļ│ĆĒÖöņŗĀņ”ØņŚÉ ļīĆĒĢśņŚ¼ ĒöäļĀłļō£ļŗłņåöļĪĀ 50 mg/day (0.9 mg/kg/day)ļź╝ ņ£Āņ¦ĆĒĢśņŚ¼ Ēć┤ņøÉĒĢśņśĆļŗż. ņĢĮ 4ņŻ╝ ļÆż ņÖĖļל ņČöņĀü Ļ▓Ćņé¼ņŚÉņä£ ņåīļ│Ć ļŗ©ļ░▒ņ¦ł Ēü¼ļĀłņĢäĒŗ░ļŗī ļ╣äņ£©ņØĆ 10.27ņŚÉņä£ 0.94ļĪ£ Ļ░ÉņåīĒĢśņśĆļŗż. Ēśłņ▓Ł ņĢīļČĆļ»╝ņØĆ 1.8 g/dLņŚÉņä£ 3.5 g/dL, Ēśłņ▓Ł Ēü¼ļĀłņĢäĒŗ░ļŗīņØĆ 1.6 mg/dLņŚÉņä£ 0.91 mg/dL, Ļ│äņé░ļÉ£ eGFRņØĆ 44.62 mL/min/1.73 m2ņŚÉņä£ 60.00 mL/min/1.73 m2 ņØ┤ņāüņ£╝ļĪ£ ĒśĖņĀäļÉ£ Ļ▓░Ļ│╝ļź╝ ļ│┤ņśĆļŗż. ņØ┤Ēøä 3ņŻ╝ĻĖ░ ĒĢŁņĢö ņ╣śļŻīĻ╣īņ¦Ć ņ¦äĒ¢ēĒĢśņśĆĻ│Ā, 4ņŻ╝ĻĖ░ ņ╣śļŻī Ļ│äĒÜŹĒĢśļŹś ņżæ ĒÅÉļĀ┤ņØ┤ ļ░£ņāØĒĢśņŚ¼ ņ×ģņøÉĒĢśņśĆĻ│Ā ĒÅÉļĀ┤ ņĢģĒÖöļĪ£ ņØĖĒĢ£ ļŗżļ░£ņä▒ ņןĻĖ░ļČĆņĀäņØ┤ ņ¦äĒ¢ēļÉśņ¢┤ ņé¼ļ¦ØĒĢśņśĆļŗż.
MEN 1ņØĆ 11ļ▓ł ņŚ╝ņāēņ▓┤ņŚÉ ņ£äņ╣śĒĢ£ MEN 1 ņ£ĀņĀäņ×ÉņØś ļČłĒÖ£ņä▒ĒÖö ļÅīņŚ░ļ│ĆņØ┤ļĪ£ ļ░£ņāØĒĢśņŚ¼ ņāüņŚ╝ņāēņ▓┤ ņÜ░ņä▒ņ£╝ļĪ£ ņ£ĀņĀäļÉśļ®░, Ļ░ĆņĪ▒ļĀźņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░Ļ░Ć ļīĆļČĆļČäņØ┤ļéś ņĢĮ 10%ļŖö ņāłļĪ£ņÜ┤ ņ£ĀņĀä ļ│ĆņØ┤(de novo mutation)ņŚÉ ņØśĒĢ┤ ņé░ļ░£ņĀüņ£╝ļĪ£ ļ░£ņāØĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż. 94% ņØ┤ņāüņØ┤ 50ļīĆ ņØ┤ņĀäņŚÉ ļ░£ļ│æĒĢśļ®░, ļČĆĻ░æņāüņāś, ļćīĒĢśņłśņ▓┤ ņĀäņŚĮ, ņŗŁņØ┤ņ¦Ćņן-ņĘīņן ņżæ ņĄ£ņåī 2Ļ░Ćņ¦Ć ņØ┤ņāüņØś ņĀäĒśĢņĀüņØĖ ļé┤ļČä ļ╣äņóģņ¢æņØ┤ ļ░£ņāØĒĢĀ Ļ▓ĮņÜ░ ņ¦äļŗ©ņØ┤ Ļ░ĆļŖźĒĢśļŗż. MEN 1ņØś ņ¦üĻ│ä Ļ░ĆņĪ▒ļĀźņØ┤ ņ׳ņØä Ļ▓ĮņÜ░ņŚÉļŖö MEN 1Ļ│╝ ņŚ░Ļ┤Ćņä▒ņØ┤ ņ׳ļŖö ņóģņ¢æ ņżæ 1Ļ░Ćņ¦Ć ņØ┤ņāü ļ░£ņāØĒĢśņśĆĻ▒░ļéś, ņ£ĀņĀäņ×É Ļ▓Ćņé¼ņŚÉņä£ MEN 1 ņ£ĀņĀäņ×ÉņØś ļÅīņŚ░ļ│ĆņØ┤ļź╝ ļ│┤ņØ╝ Ļ▓ĮņÜ░ņŚÉļŖö ņĢäņ¦ü ņóģņ¢æņØ┤ ļ░£ņāØĒĢśņ¦Ć ņĢŖņØĆ ņāüĒā£ļØ╝ļÅä ņ¦äļŗ©ņØ┤ Ļ░ĆļŖźĒĢśļŗż[3].
ļ»ĖņäĖļ│ĆĒÖöņŗĀņ”Ø(Minimal change disease, MCD)ņØĆ ĒŖ╣ļ░£ņä▒ņØĖ Ļ▓ĮņÜ░Ļ░Ć ļ¦Äņ£╝ļéś, ļō£ļ¼╝Ļ▓ī ņóģņ¢æ, ņĢĮļ¼╝ ļÅģņä▒ ļ░śņØæ ļśÉļŖö ņĢīļĀłļź┤ĻĖ░ ļ░śņØæ, ņ×ÉĻ░Ćļ®┤ņŚŁ ņ¦łĒÖś, Ļ░ÉņŚ╝ ļō▒ņØś ņøÉņØĖņŚÉ ņØśĒĢ┤ ņØ┤ņ░©ņĀüņ£╝ļĪ£ ļ░£ņāØĒĢĀ ņłś ņ׳ļŗż. ļČĆņóģņ¢æņä▒ ņé¼ĻĄ¼ņ▓┤ ņ¦łĒÖś(paraneoplastic glomerulopathy)ņØś ĒśĢĒā£ļĪ£ ļ░£ņāØĒĢśļŖö Ļ▓ĮņÜ░ ĒśĖņ¦ĆĒé© ļ”╝Ēöäņóģ, ļ╣äĒśĖņ¦ĆĒé© ļ”╝Ēöäņóģ, ļ░▒Ēśłļ│æ ļō▒ņØś ĒśłņĢĪņĢöņŚÉ ļÅÖļ░śļÉśļŖö Ļ▓ĮņÜ░Ļ░Ć Ļ░Ćņן ļīĆĒæ£ņĀüņØ┤ļ®░, ĒśĖņ¦ĆĒé© ļ”╝Ēöäņóģ ĒÖśņ×ÉņØś ņĢĮ 1%ņŚÉņä£ MCDĻ░Ć ļ░£ņāØĒĢ£ļŗż. Ļ│ĀĒśĢņĢöņØś Ļ▓ĮņÜ░ ĒÅÉņĢö, ļīĆņןņĢö, ņŗĀņןņĢö, ĒØēņäĀņóģņŚÉņä£ ļ░£ņāØĒĢ£ ņśłĻ░Ć ļ│┤Ļ│ĀļÉ£ ļ░ö ņ׳ļŗż[4].
ļ│Ė ņ”ØļĪĆņØś ĒÖśņ×ÉļŖö MEN 1ņ£╝ļĪ£ ņ▓śņØī ņ¦äļŗ©ļ░øņĢśņØä ļŗ╣ņŗ£ņŚÉļŖö ņŗĀņ”ØĒøäĻĄ░ņØ┤ ļÅÖļ░śļÉśņ¦Ć ņĢŖņĢśņ£╝ļéś ņĢĮ 2ļģä Ēøä ņĘīņןņØś ņŗĀĻ▓Įļé┤ļČäļ╣äņóģņ¢æ ļ░£ņāØ ļ░Å Ļ│© ņĀäņØ┤ļ│æļ│ĆņØś ņ¦äĒ¢ē ņåīĻ▓¼ņ£╝ļĪ£ ņłśņłĀ Ēøä ĒĢŁņĢö ņ╣śļŻīļź╝ ņ¦äĒ¢ēĒĢśļŹś ņżæ ņŗĀņ”ØĒøäĻĄ░ņØ┤ ļ░£ņāØĒĢśņŚ¼ Ļ│ĀĒśĢņĢöņŚÉņä£ Ļ░Ćņן ĒØöĒĢśĻ▓ī ļ░£ņāØĒĢśļŖö ļ¦ēņä▒ ņé¼ĻĄ¼ņ▓┤ņŗĀņŚ╝ņ£╝ļĪ£ ņØśņŗ¼ĒĢśņśĆņ£╝ļéś, ņŗĀņן ņĪ░ņ¦ü Ļ▓Ćņé¼ņŚÉņä£ MCDļĪ£ ņ¦äļŗ©ļÉśņŚłļŗż. ņ×ģņøÉ ļŗ╣ņŗ£ MCDņŚÉņä£ļŖö ĒØöĒĢśņ¦Ć ņĢŖņØĆ ĻĖēņä▒ ņŗĀĻĖ░ļŖź ņĀĆĒĢśĻ░Ć ļÅÖļ░śļÉśņŚłļŖöļŹ░, ļŗ╣ņŗ£ ņÜö ņåīļööņøĆņØ┤ 20 mMol/L ļ»Ėļ¦īņ£╝ļĪ£ Ļ░ÉņåīļÉśņ¢┤ ņ׳ņŚłĻ│Ā, ņåīļööņøĆ ļČäĒÜŹ ļ░░ņäż(FENa) 0.07ļĪ£ ņ▓┤ņĢĪļ¤ē Ļ░ÉņåīņŚÉ ņØśĒĢ£ ņŗĀņĀäņä▒ ĻĖēņä▒ ņŗĀņåÉņāüņØ┤ ļÅÖļ░śļÉśņŚłņØä Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉśņŚłļŗż. ņŗĀņ”ØĒøäĻĄ░ņØ┤ ļ░£ņāØĒĢśĻĖ░ ņĀä ĒÖśņ×ÉĻ░Ć ņé¼ņÜ®ĒĢ£ ĒĢŁņĢöņĀ£ ņżæ ņ╣┤ļ│┤ĒöīļØ╝Ēŗ┤ņØĆ ņŻ╝ļĪ£ ĒśłĻ┤Ćļé┤Ēö╝ņäĖĒżņØś ņåÉņāüņØä ņØ╝ņ£╝ĒéżļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ņ£╝ļ®░, MCDņÖĆņØś ņŚ░Ļ┤Ćņä▒ņØĆ ļ░ØĒśĆņĀĖ ņ׳ņ¦Ć ņĢŖļŗż. ļ╣äņŖżĒżņŖżĒżļäżņØ┤ĒŖĖ ņĀ£ņĀ£Ļ░Ć ļō£ļ¼╝Ļ▓ī MCDļź╝ ņ£Āļ░£ĒĢĀ ņłś ņ׳ļŗżĻ│Ā ņĢīļĀżņĀĖ ņ׳ņ£╝ļéś[5], ļ│Ė ĒÖśņ×ÉņŚÉņä£ MCDĻ░Ć ļ░£ņāØĒĢśĻĖ░ ņĀäņŚÉ 2ļģä ņØ┤ņāü ļČĆņ×æņÜ® ņŚåņØ┤ ņ£Āņ¦ĆĒĢśļŹś ņĢĮņĀ£ņØ┤ļ»ĆļĪ£ ņĢĮļ¼╝ ļÅģņä▒ņ£╝ļĪ£ ņØĖĒĢ£ MCD Ļ░ĆļŖźņä▒ņØĆ ļ░░ņĀ£ĒĢśņśĆļŗż.
MEN 1ņØĆ ļŗżņ¢æĒĢ£ ļé┤ļČäļ╣ä ņóģņ¢æņØś ļ░£ņāØņØä ĒŖ╣ņ¦Ģņ£╝ļĪ£ ĒĢśļŖö ņ”ØĒøäĻĄ░ņ£╝ļĪ£ ļ│Ė ĒÖśņ×ÉņŚÉņä£ MCD ļ░£ņāØņØś ĻĖ░ņĀäņØä ļ¬ģĒÖĢĒ׳ ļ░ØĒ׳ĻĖ░ļŖö ņ¢┤ļĀżņÜ░ļéś ņóģņ¢æņäĖĒżņŚÉņä£ ļČäļ╣äĒĢśļŖö ĒśĖļź┤ļ¬¼, ņä▒ņןņØĖņ×É, ņé¼ņØ┤ĒåĀņ╣┤ņØĖ, ņóģņ¢æ ĒĢŁņøÉ ļō▒ņØä ņøÉņØĖņ£╝ļĪ£ ņČöņĀĢĒĢ┤ ļ│╝ ņłś ņ׳ļŗż. ĒĢ£ ņśłļĪ£, ĒśłĻ┤Ćļé┤Ēö╝ņä▒ņןņØĖņ×É(vascular endothelial growth factor, VEGF)ļŖö ņŗĀņāØĒśłĻ┤ĆņāØņä▒ņØä ņ£Āļ░£ĒĢśņŚ¼ ņóģņ¢æņäĖĒżņØś ņä▒ņן, ņāØņĪ┤, ņĀäņØ┤ņŚÉ ņżæņÜöĒĢ£ ņŚŁĒĢĀņØä ĒĢśļŖö ļ¼╝ņ¦łļĪ£ MCD ļ░£ņāØĻ│╝ņØś Ļ┤ĆļĀ©ņä▒ņØä ļ░ØĒ׳ĻĖ░ ņ£äĒĢ£ ņŚ░ĻĄ¼ļōżņØ┤ ņ¦äĒ¢ēļÉśņŚłļŗż. Taniguchi ļō▒[6]ņØĆ ņ¦üņןņĢö ĒÖśņ×ÉņŚÉņä£ ļåÆņØĆ VEGF ņłśņ╣śņÖĆ MCD ļ░£ņāØņØś ņŚ░Ļ┤Ćņä▒ņØä ļ│┤Ļ│ĀĒĢśņśĆĻ│Ā, Veron ļō▒[7]ņØĆ ņä▒ņ▓┤ ņźÉ ļ¬©ļŹĖņŚÉņä£ ļŗżļ”¼ņäĖĒż(podocyte)ņŚÉ VEGFļź╝ Ļ│╝ļ░£Ēśä ņŗ£Ēé¼ Ļ▓ĮņÜ░ ņé¼ĻĄ¼ņ▓┤ ļ╣äļīĆ, ļ®öņé░ņ¦ĆņøĆ ņ”ØņŗØ, ĻĖ░ņĀĆļ¦ē ļ╣äĒøä, ņäĖĻĘ╣ļ¦ē(slit diaphragms)ņØś ņåīņŗż, ļŗżļ”¼ņäĖĒż ļÅīĻĖ░ ņåīņŗż(podocyte effacement), ļŗ©ļ░▒ļć©ļź╝ ĒŖ╣ņ¦Ģņ£╝ļĪ£ ĒĢśļŖö ņé¼ĻĄ¼ņ▓┤ņŗĀņŚ╝ņØ┤ ņ£Āļ░£ļÉśļŖö Ļ▓āņØä ĻĘ£ļ¬ģĒĢśņśĆļŗż. ļŗżļźĖ ņśłļĪ£, ĒśĖņ¦ĆĒé© ļ”╝Ēöäņóģ, ļ”╝ĒöäĻĄ¼ ņÜ░ņäĖĒśĢ ĒØēņäĀņóģ(lymphocyte predominant thymoma)ņŚÉņä£ ļ”╝ĒöäĻĄ¼ ĻĖ░ļŖźņØś ņĪ░ņĀłļČłļ¤ēņ£╝ļĪ£ TH2 ņäĖĒżĻ░Ć Ļ│╝ļÅäĒĢśĻ▓ī ĒÖ£ņä▒ĒÖöļÉśĻ│Ā, IL-13Ļ│╝ Ļ░ÖņØĆ TH2 ņé¼ņØ┤ĒåĀņ╣┤ņØĖņØ┤ Ļ│╝ļ░£ĒśäļÉśņ¢┤ MCDļź╝ ņ£Āļ░£ĒĢĀ Ļ░ĆļŖźņä▒ņØ┤ ņ׳ļŗżĻ│ĀļÅä ļ│┤Ļ│ĀļÉ£ ļ░ö ņ׳ļŗż[8,9]. ļ│Ė ĒÖśņ×ÉņØś Ļ▓ĮņÜ░ņŚÉļŖö ņŗĀņ”ØĒøäĻĄ░ņØ┤ ļ░£ņāØĒĢ£ ņŗ£ņĀÉņŚÉļŖö ņĀäņé░ĒÖöļŗ©ņĖĄņ┤¼ņśüņŚÉņä£ ņĀäņóģĻ▓®ļÅÖņØś ĒØēņäĀņóģ ņ×¼ļ░£ņØä ņØśņŗ¼ĒĢĀ ņłś ņ׳ļŖö ņåīĻ▓¼ņØĆ ņŚåņŚłņ£╝ļ®░, ņāłļĪ£ ļ░£ņāØĒĢ£ ļ╝ł ņĀäņØ┤ ļČĆņ£äļŖö ņĪ░ņ¦ü Ļ▓Ćņé¼ļź╝ ņ¦äĒ¢ēĒĢśņ¦Ć ļ¬╗ĒĢśņŚ¼, ĒØēņäĀņóģĻ│╝ MCD ļ░£ņāØņØś ļ¬ģĒÖĢĒĢ£ ņØĖĻ│╝Ļ┤ĆĻ│äļź╝ ĒÖĢņØĖĒĢĀ ņłśļŖö ņŚåņŚłļŗż.
ņØ╝ļ░śņĀüņ£╝ļĪ£ ņä▒ņØĖņŚÉņä£ ļ░£ņāØĒĢ£ MCDņØś ņ╣śļŻīļŖö ņŖżĒģīļĪ£ņØ┤ļō£ļĪ£ ņŗ£ņ×æĒĢśļ®░, ĒŖ╣ļ░£ņä▒ MCDņØś Ļ▓ĮņÜ░ 80% ņØ┤ņāüņØś ĒÖśņ×ÉņŚÉņä£ ņÖäņĀäĻ┤ĆĒĢ┤Ļ░Ć ņØ┤ļŻ©ņ¢┤ņ¦Ćļéś ņ×¼ļ░£ņØ┤ ĒØöĒĢśļŗż. ņŖżĒģīļĪ£ņØ┤ļō£ņØś ĻĖłĻĖ░ņ”ØņØ┤Ļ▒░ļéś, 16ņŻ╝ ņØ┤ņāüņØś ņ╣śļŻīņŚÉļÅä ļ░śņØæņØ┤ ņŚåļŖö ļČłņØæņä▒ņØ╝ Ļ▓ĮņÜ░ ņé¼ņØ┤Ēü┤ļĪ£ĒżņŖżĒīīļ¦łņØ┤ļō£, ņé¼ņØ┤Ēü┤ļĪ£ņŖżĒżļ”░Ļ│╝ Ļ░ÖņØĆ ļ®┤ņŚŁ ņ¢ĄņĀ£ ņ╣śļŻīļź╝ ņŗ£ļÅäĒĢ┤ ļ│╝ ņłś ņ׳ļŗż[10]. ļČĆņóģņ¢æņä▒ ņ”ØĒøäĻĄ░ņ£╝ļĪ£ ļ░£ņāØĒĢ£ ņØ┤ņ░©ņä▒ MCDņØś Ļ▓ĮņÜ░ ņŖżĒģīļĪ£ņØ┤ļō£ ļČłņØæņä▒ņØä ļ│┤ņØ╝ Ļ░ĆļŖźņä▒ņØ┤ ļŹö ļåÆņ£╝ļ®░ ņøÉņØĖ ņ¦łĒÖśņŚÉ ļīĆĒĢ£ ĒĢŁņĢö ņ╣śļŻīĻ░Ć ĒĢ©Ļ╗ś ņØ┤ļŻ©ņ¢┤ņĀĖņĢ╝ ĒĢ£ļŗż. ļ│Ė ņ”ØļĪĆņØś ĒÖśņ×ÉļŖö ĒĢŁņĢö ņ╣śļŻīņÖĆ ĒöäļĀłļō£ļŗłņåöļĪĀ ņ╣śļŻīļź╝ ļ│æĒ¢ēĒĢśļ®┤ņä£ ņ╣śļŻī 4ņŻ╝ Ēøä ļŗ©ļ░▒ļć©, ņŗĀļČĆņĀäņØś ĒśĖņĀäņØä ļ│┤ņśĆļŗż. ņŖżĒģīļĪ£ņØ┤ļō£ ņ╣śļŻīņŚÉ ļ░śņØæņØä ļ│┤ņØĖ ņĀÉņŚÉņä£ļŖö ĒŖ╣ļ░£ņä▒ MCDņØ╝ Ļ░ĆļŖźņä▒ļÅä ļ░░ņĀ£ĒĢĀ ņłś ņŚåņ£╝ļ®░, ņØ┤Ēøä ĒÖśņ×ÉĻ░Ć ĒÅÉļĀ┤ņ£╝ļĪ£ ņØĖĒĢ┤ ņé¼ļ¦ØĒĢśņŚ¼ ņןĻĖ░ņĀüņØĖ ņ╣śļŻīņØś ĒÜ©Ļ│╝ ļ░Å ņ×¼ļ░£ ņŚ¼ļČĆ, MEN 1Ļ│╝ņØś ņØĖĻ│╝Ļ┤ĆĻ│äļź╝ ĻĘ£ļ¬ģĒĢśļŖö ļŹ░ ĒĢ£Ļ│äņĀÉņØ┤ ņ׳ņŚłļŗż. ļ│Ė ĒÖśņ×ÉņŚÉņä£ ņŗĀĻ▓Įļé┤ļČäļ╣äņóģņ¢æņŚÉ ņØśĒĢ£ ņØ┤ņ░©ņä▒ņØ╝ņ¦Ć, ņĢäļŗłļ®┤ ĒŖ╣ļ░£ņä▒ MCDņØ╝ņ¦ĆņŚÉ ļīĆĒĢ£ ņĀĢĒÖĢĒĢ£ ņ¢ĖĻĖēņØĆ ĒĢśĻĖ░ ņ¢┤ļĀżņÜ░ļéś, ĒØźļ»ĖļĪ£ņÜ┤ ņĀÉņØĆ ņŗĀņ”ØĒøäĻĄ░ņØś ņøÉņØĖņ£╝ļĪ£ Ļ│ĀĒśĢņĢöņŚÉņä£ ņØ╝ļ░śņĀüņ£╝ļĪ£ ļÅÖļ░śļÉśļŖö ļ¦ēņä▒ ņŗĀņŚ╝ņØä ņØśņŗ¼ĒĢśņŚ¼ Ļ▓Ćņé¼ļź╝ ņ¦äĒ¢ēĒĢśņśĆņ£╝ļéś, ļ»ĖņäĖļ│ĆĒÖöņŗĀņ”ØņØ┤ ņ¦äļŗ©ļÉśņŚłļŗżļŖö Ļ▓āņØ┤ļŗż. ĒĢŁņĢö ņ╣śļŻīņŚÉ ļ░śņØæņØ┤ ņŚåņØä Ļ▓ĮņÜ░ ĒŖ╣ļ░£ņä▒ MCD Ļ░ĆļŖźņä▒ņŚÉ ļīĆĒĢśņŚ¼ ņŖżĒģīļĪ£ņØ┤ļō£ ņ╣śļŻīļź╝ ņŗ£Ē¢ēĒĢśļŖö Ļ▓āņØ┤ ĒĢäņÜöĒĢśņ¦Ćļ¦ī, ņĢöņØś ņ¦äĒ¢ē ļ░Å Ļ░ÉņŚ╝Ļ│╝ Ļ░ÖņØĆ ĒĢ®ļ│æņ”Ø ļ░£ņāØņØś Ļ░ĆļŖźņä▒ņØ┤ ļåÆņĢäņ¦ł ņłś ņ׳ņ¢┤ ņØ┤ņŚÉ ņŻ╝ņØśĻ░Ć ĒĢäņÜöĒĢśļŗż.
REFERENCES
1. Marini F, Falchetti A, Del Monte F, et al. Multiple endocrine neoplasia type 1. Orphanet J Rare Dis 2006;1:38.



2. Cambier JF, Ronco P. Onco-nephrology: glomerular diseases with cancer. Clin J Am Soc Nephrol 2012;7:1701ŌĆō1712.

3. Al-Salameh A, Baudry C, Cohen R. Update on multiple endocrine neoplasia type 1 and 2. Presse Med 2018;47:722ŌĆō731.


4. Glassock RJ. Secondary minimal change disease. Nephrol Dial Transplant 2003;18 Suppl 6:vi52ŌĆōvi58.


5. Markowitz GS, Bomback AS, Perazella MA. Drug-induced glomerular disease: direct cellular injury. Clin J Am Soc Nephrol 2015;10:1291ŌĆō1299.



6. Taniguchi K, Fujioka H, Torashima Y, Yamaguchi J, Izawa K, Kanematsu T. Rectal cancer with paraneoplastic nephropathy: association of vascular endothelial growth factor. Dig Surg 2004;21:455ŌĆō457.

7. Veron D, Reidy KJ, Bertuccio C, et al. Overexpression of VEGF-A in podocytes of adult mice causes glomerular disease. Kidney Int 2010;77:989ŌĆō999.


8. Lien YH, Lai LW. Pathogenesis, diagnosis and management of paraneoplastic glomerulonephritis. Nat Rev Nephrol 2011;7:85ŌĆō95.





 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




