대장내시경 후 발생한 급성 인산염 신병증
Sodium Phosphate-Induced Acute Phosphate Nephropathy after Colonoscopy: A Case Report
Article information
Trans Abstract
Acute phosphate nephropathy is caused by exposure to excess sodium phosphate. Calcium phosphate is deposited in the renal tubular epithelial cells, leading to tubulointerstitial nephritis. We report the case of a 71-year-old female who developed acute kidney injury after undergoing a colonoscopy. She had taken 28 sodium phosphate tablets, equivalent to 42 g of sodium phosphate, as bowel purgatives prior to the colonoscopy. A biopsy of the native kidney revealed acute tubular injury with calcium phosphate deposits. This case report suggests that sodium phosphate tablets can induce acute phosphate nephropathy, particularly in patients with predisposing factors. Therefore, physicians should be vigilant of kidney injury when choosing sodium phosphate as a pre-colonoscopy bowel purgative.
서 론
대장내시경 후 발생한 급성 인산염 신병증은 2003년 Desmeules가 경구 인산 나트륨을 장세척제로 사용한 후 발생한 acute kidney injury에 대하여 신조직 검사를 통해 calcium phosphate 결정의 침착을 증명하여 처음으로 알려지기 시작하였다[1]. 한동안 액상형 인산나트륨 제제가 비교적 적은 양으로도 간단하게 장세척이 가능하여 대장내시경을 위한 전 처치로 널리 사용되었다. 그러나 이러한 부작용 사례들이 계속 보고되면서 현재는 장세척 목적의 액상형 인산나트륨 제제는 사용이 금지된 상태이다. 대신 polyethylene glycol (PEG) 혹은 oral sodium sulfate (OSS)와 같은 약물이 널리 사용되고 있다. 그러나 인산나트륨 제제는 여전히 액상형이 아닌 정제형으로 제형을 달리하여 대장내시경 전 장세척 목적의 처방이 가능하다. 저자들은 대장내시경 후 발생한 신장기능 이상으로 내원한 환자에게 신장 조직 검사를 시행하여 정제형 인산나트륨 제제로 인해 발생한 급성 인산염 신병증을 진단하였다. 증례를 통해 인산나트륨 제제의 위험성에 대해 환기하기 위하여 이를 문헌 고찰과 함께 보고하는 바이다.
증 례
환 자: 71세 여자
주 소: 전신 위약감
현병력: 4일 전부터 심해진 전신 무력, 피로감을 주소로 내원하였다. 1주일 전 타 병원에서 검진 목적의 대장내시경을 위하여 검사 전일 인산나트륨 정제 4정을 물 240 mL와 함께 15분 간격으로 총 20알 복용하였고 검사 당일 같은 간격으로 총 8정 복용하여 총 28정의 인산나트륨을 복용하였으며 이는 42 g에 해당하였다. 이 과정에서 2 kg가량의 체중 감소가 있었다. 평소 당뇨 및 고혈압에 대하여 metformin 500 mg/day, rosuvastatin 10 mg/day, olmesartan 20 mg/day, amlodipine 5 mg/day, hydrochlorothiazide 12.5 mg/day를 복용하여 조절해 왔다. 4개월 전 정기 혈액 검사에서 혈청 크레아티닌은 0.8 mg/dL였으나 내원 1일 전 외부 병원 검사에서는 8.1 mg/dL였다.
신체 진찰 소견: 내원 시 의식은 명료하였고 활력 징후는 혈압 143/76 mmHg, 맥박수 81회/분, 호흡수 16회/분, 체온 36.0℃였다. 급성 병색은 보이지 않았으며 흉부, 복부 진찰상 특이 소견은 없었고 부종 및 갈비척추각 압통 소견도 보이지 않았다.
검사실 소견: 입원 당시 시행한 검사에서 말초 혈액은 백혈구 9,700/mm3 (중성구 84.3%), 혈색소 11.5 g/dL, 혈소판 171,000/mm3였다. 혈청 생화학 검사는 혈중 요소질소 82.7 mg/dL, 크레아티닌 8.28 mg/dL, 총 단백 6.70 g/dL, 알부민 3.71 g/dL, 공복 혈당 110 mg/dL, 아스파테이트아미노전이효소 23 IU/L, 알라닌아미노전이효소 12 IU/L, 총 빌리루빈 0.55 mg/dL, 나트륨 121 mmol/L, 칼륨 4.7 mmol/L, 염소 91.4 mmol/L, 칼슘 8.9 mg/dL, 인 6.2 mg/dL 등이었다. 소변 검사에서는 요비중 1.009, pH 5.0, 요잠혈, 요단백, 요빌리루빈뇨은 모두 음성이었으나 임의뇨 검사상 단백질/크레아니틴 비율은 207 mg/g이었다. 뇨삼투압은 290 mOsm/kg, 소변 내 나트륨은 64 mmol/L였고 나트륨 분획 배설률은 7.7%였다. 급속 진행성 사구체신염을 감별하기 위하여 시행한 검사에서 혈청 보체 농도는 정상이었고 anti-nuclear antibody, anti-neutrophil cytoplasmic antibody, anti-glomerular basement membrane antibody 등은 모두 음성이었다.
방사선학적 소견: 흉부 방사선 사진에서는 특이 소견이 보이지 않았으며 심전도에서는 정상 동율동이었다. 비조영 복부 전산화단층촬영에서 수신증, 요로 결석 등의 문제는 발견되지 않았으며 왼쪽 콩팥에 각각 2.5 cm, 1.9 cm 크기의 단순 신낭종이 있었고 양측 신장 크기의 위축은 보이지 않았다.
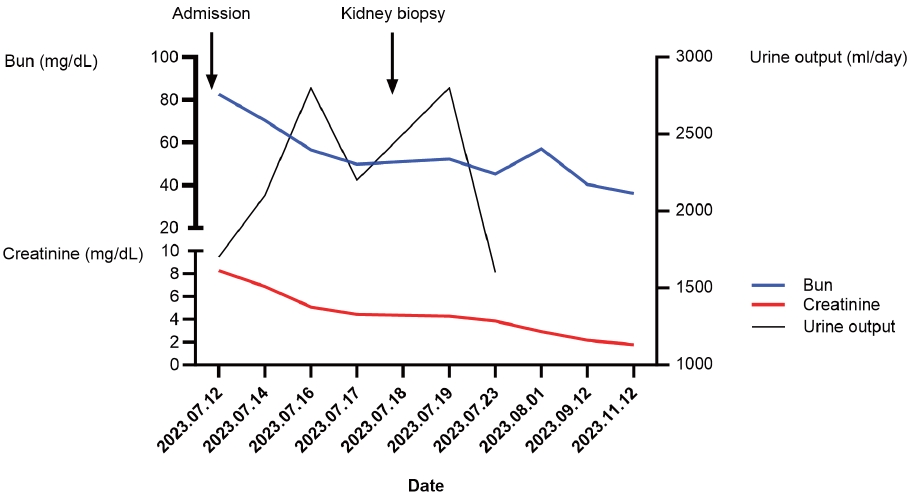
경과 및 치료: 신전성 급성 신손상 가능성을 배제하기 위하여 0.9% 생리 식염수 1 L를 40 mL/h로 주입하였으며 소변량이 원활하게 유지되며 유의한 전해질, 산염기 불균형은 보이지 않아 신대체 요법은 하지 않고 보존적인 치료를 유지하였다. 검사 결과상 신기능의 전반적인 호전은 보이고 있었으나 정확한 원인 감별을 위하여 입원 7일째 혈청 크레아티닌은 4.43 mg/dL까지 호전된 상태에서 신장 조직 검사를 시행하였다. 검사 결과 급성 인산염 신병증을 진단받고 퇴원하였으며 외래에서 추적 관찰하며 혈청 크레아티닌은 1.76 mg/dL까지 호전된 상태이다(Fig. 1).
신조직 소견: 입원 7일째 신조직 검사를 시행하였다. 총 18개의 사구체가 확인되었고 사구체 경화나 반월상 등의 이상은 보이지 않았다. 세관사이질에서는 급성 세뇨관 괴사와 함께 원주체가 확인되었으며 면역 형광 염색상 면역 복합체의 침착은 확인되지 않았다. 전자 현미경 검사상 발돌기 소실은 미미하였고 침착물은 보이지 않았다. 특수 염색 검사상 Von Kossa에서 세뇨관 내 칼슘-인 침착 소견이 확인되었고 급성 인산염 신병증에 합당한 소견이었다(Fig. 2).
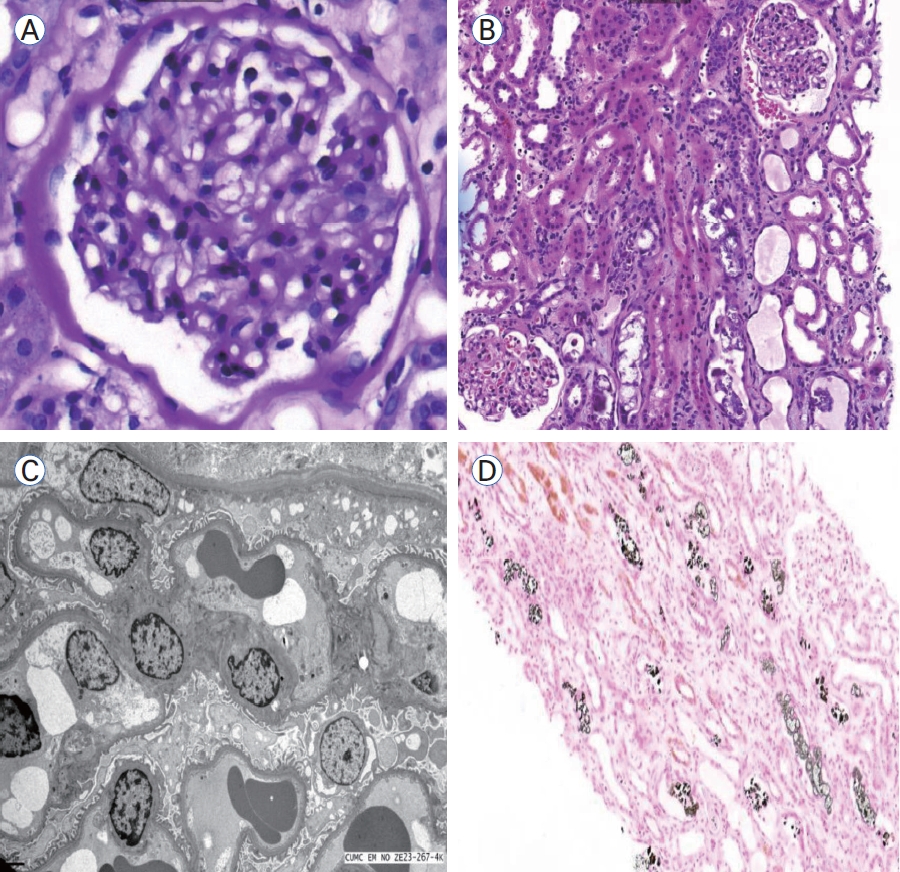
Renal biopsy findings. (A) A normal glomerulus is observed (periodic acid-Schiff stain, × 400 magnification). (B) Tubular casts acute tubular necrosis are evident (hematoxylin and eosin stain, × 100 magnification). (C) Electron microscopy showed focal effacement of epithelial cell foot process (toluidine blue stain, × 4,000 magnification). The capillary or mesangial basement membranes appear normal without deposits. (D) Black stained calcium phosphate crystals are seen in the renal tubules (Von Kossa stain, × 100 magnification).
고 찰
경구 인산나트륨 제제는 PEG, 혹은 OSS 제제와 비교하여 복용량이 많지 않아 비교적 간편하게 우수한 장세척 효과를 거둘 수 있어 한때 널리 사용되었다. 그러나 2003년 Desmeules가 처음으로 인산염 신병증을 보고한 이후 많은 증례가 보고되었고[2,3] 국내에서도 장세척 목적의 액상형 경구 인산나트륨 제제의 사용은 허가가 삭제되어 사용이 중단되었다[4]. 현재 국내에서 사용할 수 있는 국가 검진을 위한 대장내시경 전 처치 하제는 PEG, OSS뿐이다. 그러나 인산나트륨 제제는 제형을 달리하여 정제형으로는 대장내시경 전 처치에 여전히 사용 중이며 국가 암 검진이 아닌 일반 대장내시경 검사에서 종종 사용된다.
급성 인산염 신병증은 calcium phosphate 결정이 신세뇨관 상피세포에 침착되면서 발생하는 세관사이질 질환이다. 이는 산화 스트레스를 유발하여 급성 세뇨관 손상과 위축, 사이질 섬유화 등으로 이어져 신기능의 저하를 가져오게 된다. 가장 흔한 발생 원인은 대장내시경 전 처치에 사용하는 인산나트륨 제제 복용이다. 그 이외에 과량의 인산염 섭취, 사르코이드증, 악성 종양, 수질성 해면신, 시스틴 축적증 등이 있다. 급성 인산염 신병증이 발생할 수 있는 위험 인자로는 신기능 저하, angiotensin converting enzyme inhibitor/angiotensin receptor blocker (ARB)를 복용한 경우, 고령, 이뇨제나 비스테로이드 소염진통제를 복용하는 경우, 여성, 고혈압이나 당뇨와 같은 기저질환을 가진 경우 등이 있다[5,6]. 임상 양상으로는 급성 발현형과 지연 발현형으로 나눌 수 있다. 급성 발현형은 수시간 혹은 수일 내 발생 가능하며 고인산혈증과 저칼륨혈증에 의한 혼수, 착란, 발작, 강직 등의 신경학적 증상을 유발하는 것이 특징이다. 지연 발현형은 수일에서 수주가 지난 뒤 발생할 수 있으며 길게는 8주 뒤에 인산염 신병증이 보고된 사례도 있었다[7]. 피로감, 오심, 구토, 전신 쇠약감 등의 비특이적인 증상을 경험하는 경우가 대부분이며 진단 시 혈중 칼슘, 인 수치가 정상인 경우도 많다. 신장 조직 검사상에서는 신석회화와 미만성 세관 사이질 손상을 보이는 것이 특징이며 급성 세뇨관 괴사나 원주체 등이 관찰될 수 있다. 보통 사구체에 영향을 주지는 않기 때문에 사구체의 경화나 염증세포의 침윤 등은 잘 관찰되지 않는다. Von Kossa 특수 염색을 통해 검은색의 calcium phosphate 침착물을 확인할 수 있다[8].
본 증례의 환자는 정제형 인산나트륨 제제를 대장내시경 전 처치 목적으로 총 28알 복용하여 급성 인산염 신병증이 발생한 경우이다. 장정결 당시 약간의 체중 감소가 있었지만 요비중, 요삼투압, 소변 내 나트륨 분획 배설률 검사 결과를 참고하여 신전성 원인보다 신내성 신부전 가능성이 높다고 판단하고 신조직 검사를 시행하였다. 약제에 의한 급성 신부전에서 사이질 염증이 확인되면 스테로이드 치료를 고려해 볼 수 있으나[9] 해당 환자는 보존적인 치료만으로 신기능이 호전을 보이고 있고 조직 검사에서 세뇨관 괴사 소견만 확인되었기에 스테로이드를 포함한 면역 억제 치료는 시행하지 않았다. 6개월 정도 추적 관찰 기간 동안 creatinine은 이전 기저 수치였던 0.8 mg/dL만큼은 아니지만 지속적으로 호전되어 1.76 mg/dL에 도달하였고 만성 콩팥병의 유의한 합병증은 나타나지 않는 상태로 경과 관찰 중이다. 장정결 과정에서 금식으로 인한 혈장량 부족, ARB와 이뇨제 복용, 고령, 여성 등의 알려진 위험인자가 급성 인산염 신병증이 발생하는 데 기여하였을 것으로 생각된다.
건강보험심사평가원 보건의료빅데이터 개방 시스템을 참고해 보면 진단 및 치료 목적으로 국내에서 시행된 대장내시경은 2018년부터 2022년까지 연간 총 220만 건 이상을 유지하고 있다[10]. 국가 암 검진과는 달리 일반 대장내시경 검사는 전처치 하제를 선택할 수 있는 폭이 넓어 정제형 인산나트륨 제제도 쓰이고 있다. 임상의들은 이 약제를 처방하고자 할 경우 인산염 신병증의 위험인자를 면밀히 고려하여야 하고 환자에게도 부작용 발생 가능성을 설명하는 등 주의를 기울여야 한다. 본 증례를 통해 저자들은 정제형 인산나트륨 제제 또한 액상형 인산나트륨 제제와 같은 기전을 통해 급성 인산염 신병증을 유발할 수 있음을 신조직 검사를 통해 확인할 수 있었다.
Notes
CONFLICTS OF INTEREST
No potential conflict of interest relevant to this article was reported.
FUNDING
None.
AUTHOR CONTRIBUTIONS
Injoon Hwang wrote the first draft of the manuscript as the first author and gathered data. Hyung Duk Kim, Bum Soon Choi, Byung Soo Kim, Young Sub Lee were involved in data analysis. Tae Hyun Ban, Sungmi Kim were responsible for the interpretation of the results and the critical revision of the article.
ACKNOWLEDGEMENTS
None.