사이클로스포린으로 치료한 스테로이드 의존성 급성 세관사이질신염 1예
A Case of Acute Tubulointerstitial Nephritis Manifesting Steroid Dependence Successfully Treated with Cyclosporine
Article information
Trans Abstract
Acute tubulointerstitial nephritis (ATIN) is a prominent cause of acute kidney injury that is often triggered by drug reactions and autoimmune diseases. Although the treatment of ATIN should ideally target the underlying cause, in cases of progression, a consideration of immunosuppressive therapy is warranted. Glucocorticoids are typically the first-line therapeutic agents, with discontinuation following a response. In the case described herein, glucocorticoid therapy was initiated after diagnosing ATIN with an undetermined etiology. Although, the patient showed an initial response to the glucocorticoids, recurrent episodes of ATIN occurred upon the tapering of these drugs. Given the necessity for an alternative immunosuppressive agent, cyclosporine was administered, leading to the recovery of renal function. Notably, even after the cessation of steroid treatment, the patient continued to experience favorable outcomes when administered cyclosporine alone. This case highlights the importance of transitioning to alternative immunosuppressive agents when glucocorticoid therapy either fails or presents challenges regarding tapering during the initial management of ATIN. Moreover, it indicates that cyclosporine can be a viable option for the treatment of this condition.
서 론
급성 세관사이질신염(acute tubulointerstitial nephritis, ATIN)은 신장 사이질과 세관에 영향을 미치는 염증성 질환으로 약제 유발이나 감염, 자가 면역 질환, 여러 전신 질환에 의하여 발생할 수 있다. 다양한 원인 중 약물 반응이 가장 흔한 원인이나 종종 뚜렷한 원인이 밝혀지지 않는 경우도 있다[1,2]. ATIN의 치료의 핵심은 빠르게 진단하여 신속한 치료를 시행하고 신기능 상실을 되돌려 비가역적인 신장 손상으로 진행되는 것을 막는 것이다[2].
ATIN 진단 후 글루코코티코이드 치료를 통해 신기능 회복을 보인 사례는 많이 찾아볼 수 있다[1-3]. 하지만 글루코코티코이드 의존성으로 용량 감량이 어렵거나 부작용으로 인하여 글루코코티코이드 투약이 어려운 경우도 존재한다. 이 경우 글루코코티코이드 이외의 다른 면역억제제를 고려할 수 있다고하나 구체적인 권고 사항이 아직까지 정립되어 있지 않다. 저자들은 글루코코티코이드 의존성 ATIN을 사이클로스포린으로 성공적으로 치료한 사례가 아직까지 국내에서 보고된 적이 없기에 문헌 고찰과 함께 본 증례를 보고하는 바이다.
증 례
환자: 65세 여자
주소: 기력 저하, 식이량 감소로 타 병원에서 보존적 치료 중 혈액 검사에서 신기능 저하 소견을 보여 외래로 의뢰되었다.
현병력: 외래 진료 당시 환자는 기력 저하나 메스꺼움 등의 비특이적 증상만 호소하고 있었다. 외래 검사상으로 급성 신손상이 확인되었으나 혈청 크레아티닌의 상승 및 단백뇨의 원인이 불분명하였기에 입원하여 급성 신손상의 치료 및 원인에 대한 일련의 검사들을 시행하였다. 입원 중 보존적 치료만 시행하였음에도 혈청 크레아티닌은 호전 추이를 보여 추가로 사구체신염(glomerulonephritis) 관련 혈액 검사와 신장 조직 검사를 진행하고 수주 뒤 외래에서 검사 결과를 확인하기로 하고 퇴원하였다. 하지만 환자는 퇴원 10일 뒤 예약된 일정보다 이르게 구토를 주소로 응급실로 내원하였다. 진찰 시 구토 및 구역감은 호전된 상태였으나 COVID-19 감염이 확인되었고 혈액 검사에서는 이전 검사 수치보다 급격히 상승한 혈청 크레아티닌 수치와 대사성 산증 소견을 보여 구토 및 구역감이 요독 증상과 연관된 것임을 의심하였다.
과거력: 환자의 기저 질환으로 고혈압, 고지혈증이 있었으며 레이노드신드롬(Raynaud’s syndrome) 감별을 위하여 본원 류마티스 내과 외래 추적 관찰 중이었다. 환자는 고혈압 및 고지혈증으로 valsartan, atorvastatin, ezetimibe를 복용하고 있었으나 복용하는 약물 중 비스테로이드성 항염증제(nonsteroidal anti-inflammatory drug, NSAID), 항생제 등 약제 유발성 ATIN을 유발하는 것으로 알려진 약물은 없었다. 그 외에 건강 보조 식품이나 한약 등을 복용하지도 않았다고 하였다.
가족력: 특이 사항이 없었다.
신체 진찰 소견: 응급실 내원 시 의식은 명료하였고 혈압 110/70 mmHg, 맥박 분당 76회, 호흡수 분당 20회, 체온 36.4℃로 활력 징후는 정상이었다. 결막 창백이나 충혈 및 공막 황달 소견은 없었고 흉부 및 복부 진찰상 복부 압통, 반발통은 없었으며 부종 및 갈비척추각 압통 소견도 없었다. 신경학적 이상 소견도 없었다.
검사실 및 영상 소견: 환자의 이전 기록에서 6개월 전 기저 혈청 크레아티닌 수치는 0.6 mg/dL였으나 첫 외래 내원 시에는 혈청 크레아티닌이 3.45 mg/dL, 소변 단백질/크레아티닌 비율(urine protein to creatinine ratio, UPCR)이 3.18 g/gCr로 급성 신손상 및 다량의 단백뇨를 보이고 있었으며 소변에서 적혈구는 검출되지 않았다. 소변 알부민/크레아티닌 비율(urine albumin to creatinine ratio)은 350.7 mg/g Cr로 UPCR에 비해 높지 않아 세뇨관성 단백뇨가 의심되었다. 이후 응급실 내원 시에는 혈청 크레아티닌이 6.16 mg/dL로 더 상승한 수치를 보였다. 혈청 총 콜레스테롤 수치는 81 mg/dL, 저밀도지단백질은 24 mg/dL로 높지 않았으며 혈청 단백질은 8.2 g/dL, 알부민은 3.7 g/dL였다. 혈청, 소변 단백질 전기영동 검사에서 단클론성 감마글로불린 병증은 확인되지 않았다.
첫 입원 시 시행한 사구체신염 선별 검사에서 anti-glomerular basement membrane antibody, anti-phospholipase A2 receptor immunoglobulin G (IgG) antibody, anti-neutrophil cytoplasmic antibody 모두 음 성 소견이었고 말초 혈액 도말 검사에서도 특이 사항이 없었으며 kappa/lamda ratio도 정상 범위였다. 혈청 immunoglobulin A는 275.4 mg/dL로 정상, 혈청 보체C3, C4의 감소 소견도 없었으며 바이러스 표지자도 모두 음성이었다. 그 밖의 전신 질환 감별을 위한 혈청학적 검사에서 항핵항체(antinuclear antibody)는 1:80으로 양성 소견이었지만 류마티스 인자는 음성, anti- Sjögren’s syndrome-related antigen A autoantibodies, anti-Sjögren’s syndrome-related antigen B autoantibodies는 모두 음성, anti-double stranded DNA도 음성으로 류마티스 질환을 의심할 만한 추가적인 소견은 확인되지 않았다. 응급실에서 COVID-19가 확진되었으나 관련된 증상 및 감염 표지자, 영상학적 검사에서는 이상 소견이 없었다. 특히 복부 전산화단층촬영 및 신장 초음파에서 신장의 종괴나 수신증, 실질 위축 등의 구조적 문제는 보이지 않았다.
신장 조직 소견: 첫 입원 시 시행하였던 신장 조직 검사의 광학현미경 소견에서 신세관의 세관염, 호중구성 원주(neutrophitic cast) 소견과 사이질의 섬유화, 호중구, 림프조직구 등이 침윤된 염증 소견이 확인되어 ATIN으로 확진되었다(Fig. 1). 면역형광염색에서 침착된 항체는 확인되지 않아 IgG4 연관 질환은 배제하였다. 전자현미경 소견에서는 국소적인 족세포 소실을 보이고 있었으나 미세변화신증후군 소견은 아니었다.
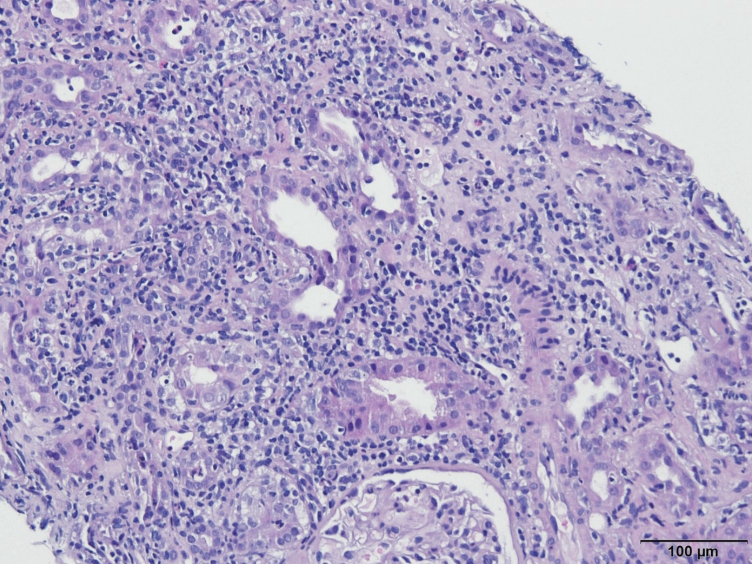
Light microscopic examination revealed a tubulointerstitial inflammation with prominent lymphoplasmacytic cells admixed with neutrophils and a few eosinophils. Tubulitis with neutrophilic and lymphocytic infiltration was also observed (hematoxylin and eosin stain, original magnification × 200).
임상 경과 및 치료: 일련의 검사들을 시행하였으나 환자의 ATIN 유발 원인은 명확히 밝혀지지 않았다. 환자의 병력, 사구체신염 관련 검사 및 류마티스 질환 스크리닝 검사에서 모두 특이 사항이 없었으며 감염 질환도 배제되었기에 다른 특별한 원인이 없는 특발성 ATIN으로 잠정 진단하였고 조직 검사 결과 확인 후 바로 글루코코티코이드 치료를 시작하였다.
초기 치료로 프레드니솔론(prednisolone) 1 mg/kg/day (50 mg/day)로 투약을 시작하였고 프레드니솔론에 대한 신기능 회복 여부 평가는 혈청 크레아티닌 및 UPCR을 통해 확인하였다. 프레드니솔론은 10일간 동일 용량 유지하였고 환자의 경과는 빠르게 호전되어 UPCR 및 크레아티닌 모두 호전을 보여 각각 1.13 g/gCr, 1.4 mg/dL로 퇴원하였으며 프레드니솔론은 5일간 빠르게 감량하였다. 하지만 2주 뒤 외래 검사에서 혈청 크레아티닌이 4.84 mg/dL로 다시 상승되고 단백뇨도 3.36 g/gCr로 악화된 것이 확인되었다. 환자에게 감염, 탈수, 신독성 약제 복용 등의 급성 신손상을 재차 유발할 다른 요인은 없는 것으로 확인되었다. 처음 치료 용량대로 1 mg/kg으로 프레드니솔론 투약을 재시작하였고 치료에 반응을 보여 신기능이 호전되어 2주 뒤부터 2주마다 10 mg/day씩 서서히 감량하면서 추적하였다. 3달 뒤 10 mg까지 감량한 뒤에는 재차 1.1 mg/dL에서 1.41 mg/dL로 혈청 크레아티닌이 상승하였고 0.4 g/gCr 이 1.43 g/gCr로 단백뇨의 악화가 나타났으나 전과 마찬가지로 급성 신손상을 유발할 다른 요인은 없었다.
두 차례 재발 결과 다른 급성 신손상의 원인이 배제되었기에 스테로이드 의존성 ATIN으로 판단 후 다른 면역억제제 도입을 고려하였고 그중 칼시뉴린억제제(calcineurin inhibitor)인 사이클로스포린(cyclosporine)을 투약하였다. 프레드니솔론을 유지하면서 사이클로스포린 3 mg/kg/day (150 mg/day) 오전 100 mg, 저녁 50 mg을 도입하였다. 한 달 뒤 혈청 크레아티닌 및 UPCR이 감소하여 프레드니솔론은 5 mg까지 감량하였고 이후로도 안정적 추이를 보여 프레드니솔론은 2달 뒤 중단하였다(Fig. 2).
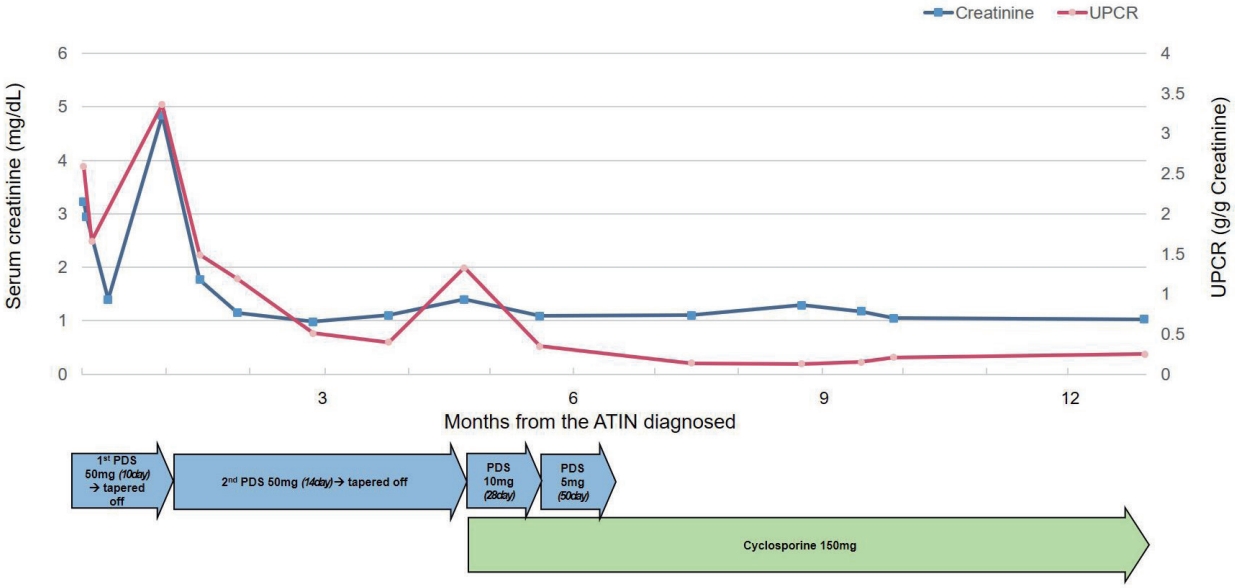
Serum creatinine and urine protein-to-creatinine ratio values according to prednisolone (PDS) and cyclosporine doses. UPCR, urine protein to creatinine ratio; ATIN, acute tubulointerstitial nephritis.
현재는 4달 이상 사이클로스포린 단독으로 투약 유지 중으로 혈액 검사 결과는 지속적으로 안정 추이를 보이고 있다. 사이클로스포린 투약 중에는 특별한 부작용 및 재발을 보이지 않았으며 신기능이 유지되면서 기력 저하나 구역, 구토 등의 증상도 호전되었다.
본 증례는 ATIN의 초기 치료로 선택되는 스테로이드에 의존성을 보여 감량이 어려운 경우 다른 면역억제제로의 변경이 필요하며 그중 사이클로스포린이 좋은 치료 옵션이 될 수 있음을 보여주었다.
고 찰
ATIN의 임상 양상은 혈청 크레아티닌 상승 및 단백뇨와 같은 신장 손상이 동반되고 주 증상으로 발열, 피부 발진, 호산구증가증이 동반될 수 있으나 세 가지 모두 나타나는 경우는 드물어 임상 양상만으로 의심하기에는 무리가 있다[1,2]. 따라서 ATIN을 진단하기 위해서는 조직 검사가 필수적이며 뚜렷한 원인 없이 신기능이 급성으로 악화될 경우 ATIN의 가능성을 염두에 두어야 한다[1,2,4].
ATIN으로 진단 시 주요 병리 소견은 사이질 부종, 염증, 사구체 또는 혈관 침범이 없는 세관염 등으로 나타난다. 사이질의 염증 세포 침윤은 주로 림프구, 단핵구, 호산구, 호중구 등이 침윤하며 국소적, 전반적 모든 양상으로 침범 가능하다[2]. 병리학적 소견을 보았을 때 ATIN은 염증세포의 침윤을 주로 보이므로 ATIN의 진행을 막기 위해서는 면역 반응의 억제가 필요하다[1,2].
ATIN 진단 후 치료 결정은 원인을 찾아 제거하는 것이 우선되어야 한다. 약물 유발 ATIN을 유발하는 대표적인 약물은 항생제, NSAIDs, 양성자펌프저해제 등이 있어 기존 약물 복용력을 구체적으로 확인하여야 한다. 그 밖의 흔한 원인은 감염, 전신 질환이므로 감염 질환 동반 시 감염에 대한 치료를, 쇠그렌증후군 및 전신홍반루프스와 같은 전신 질환이 동반될 경우 해당 질환에 대한 치료를 선행하여 급성 신손상 호전 추이를 살펴본다. 하지만 일련의 검사를 시행하였음에도 원인을 알 수 없거나 하나로 특정하기 어려운 경우도 많고 원인 질환을 치료함에도 호전이 더딘 경우도 있다[4].
따라서 앞선 원인들이 배제되었거나 원인 약물을 중단하고 원인 질환 치료를 선행하였음에도 급성 신손상이 지속될 경우 면역억제제 투약을 고려하며 글루코코티코이드 투약을 먼저 시작한다[5,6]. 대부분의 경우 원인 약제 중단 후 7일 내 글루코코티코이드를 도입하면 1-2주 내에 신장 기능의 회복을 보인다[5-7]. 치료 시작 용량은 1 mg/kg이 일반적이며 신기능 개선이 보이면 치료 1-2주 후부터 10 mg씩 용량을 줄인다[5]. 총 치료 기간은 개인의 치료에 대한 반응 및 부작용에 따라 조정될 수 있으나 글루코코티코이드를 3주 이상 고용량으로 투약하거나 8주 이상 장기 투약하는 것은 신기능 회복과 큰 관련이 없다는 결과가 있었다[1,3].
일부 환자들 중 글루코코티코이드 투약에 반응이 없거나 일시적인 호전을 보였다가 다시 악화를 보이는 재발성 ATIN이 나타날 수 있다[8,9]. 또는 스테로이드에 반응하지만 투여량을 줄일 경우 재발하여 장기간 투약하게 되는 경우도 있다.
글루코코티코이드 치료에 반응하지 않거나 부작용에 대한 우려로 치료 중단이 필요한 환자에게 면역억제제 중 마이코페놀레이트모페틸(mycophenolate mofetil, MMF) 및 칼시뉴린억제제인 사이클로스포린, 사이클로포스퍼마이드(cyclophosphamide) 등을 고려할 수 있다[8-10].
모집단의 범위는 제한적이었으나 해외에서 발표된 몇몇 사례에서 스테로이드 저항성 ATIN 환자 8명에게 MMF를 투약하면서 스테로이드 용량을 감량하였고 그중 6명에서 성공적인 결과를 얻었음을 보여주었다[8].
다른 사례에서는 ATIN 및 급성 신손상이 동반된 반코마이신 유발성 과민 반응(vancomycin-induced hypersensitivity reaction) 환자에서 사이클로스포린으로 치료한 예를 보여주었다. 환자는 반코마이신을 중단하고 경험적 글루코코티코이드를 사용하였지만 다시 악화된 경과를 보여 사이클로스포린을 투약하였고 이후 글루코코티코이드 감량에 성공하였다[9].
본 증례의 환자는 치료 용량 1 mg/kg에서는 신기능 호전을 보이다가 용량 감량 시 반복적으로 다시 혈청 크레아티닌 및 요단백뇨의 상승 추이를 보였다. 따라서 스테로이드로 관해가 어렵다고 판단하고 초기 치료에 적절히 반응하지 않는 경우 그 다음으로 고려해 볼 수 있는 면역억제제인 사이클로스포린을 도입하였다.
사이클로스포린은 T세포의 활성을 억제하며 세포성 면역이 중요한 역할을 하는 자가 면역 질환에서 면역 치료제로 기능할 수 있다. 여러 동물 모델에서 사이클로스포린의 도입이 세포 매개성 자가 면역 질환의 발생을 억제시킨 결과를 보여주었다[10].
ATIN에서의 연구 결과는 아니었지만 신증후군 환자에서 사이클로스포린이 MMF에 비해 스테로이드 치료에 저항성을 보이는 경우 관해율이 더 높았다는 연구 결과가 있었다[11]. 하지만 스테로이드로 관해되지 않은 ATIN의 치료에 대한 다른 면역억제제의 효과 및 안정성에 대한 비교 임상시험 연구는 부족하였다.
임상에서 스테로이드에 반응을 보이지 않는 ATIN을 종종 접할 수 있지만 국내 문헌에서는 스테로이드 의존성 ATIN을 사이클로스포린을 통해 성공적으로 치료한 사례를 찾을 수 없었고 스테로이드 다음으로 고려해 볼 수 있는 면역억제제의 선택 및 용량에 대한 구체적인 지침이 제시되어 있지 않아 본 증례 보고를 하게 되었다. 또한 ATIN에서 사이클로스포린을 초기 치료로 선택한 사례나 글루코코티코이드와 사이클로스포린을 각각 단독 투여한 후 치료 결과를 비교한 사례도 찾기 어려웠다.
글루코코티코이드 장기 투약 시 부작용이 우려되는 환자에서 사이클로스포린, MMF 등과 같은 다른 면역억제제가 유용한 치료 옵션이 될 수 있고 글루코코티코이드 도입 전 초기 요법으로 선택하는 것도 고려해 볼 수 있기에 ATIN의 진료 지침 정립을 위해서는 이와 관련된 구체적인 사례 및 연구가 더 필요하겠다.
요약하자면 ATIN은 다양한 원인으로 발생하는 질환으로 원인 질환에 대한 치료에도 호전되지 않는 경우 면역억제제를 고려할 수 있다. 저자들은 글루코코티코이드 요법으로 일시적인 신기능 호전을 보이나 용량 감량이 어려운 ATIN에서 사이클로스포린을 투약하여 성공적으로 글루코코르티코이드를 감량하였으며 신기능도 유지되고 있는 사례를 경험하여 보고하는 바이다.
Notes
CONFLICTS OF INTEREST
No potential conflict of interest relevant to this article was reported.
FUNDING
This study was supported by grant (BCRI-24032) from the Chonnam National University Hospital Biomedical Research Institute.
AUTHOR CONTRIBUTIONS
Conceptualization: TR Oh.
Writing - original draft: SY Jeong.
Writing - review and editing: SY Jeong, TR Oh, HS Choi, and EH Bae.
Supervision: CS Kim, SK Ma, SW Kim, and EH Bae.
ACKNOWLEDGEMENTS
None.