간질성 폐질환에서의 영상 분석 최신 기술 동향
Recent Advances in Imaging Analysis for Interstitial Lung Disease
Article information
Trans Abstract
Interstitial lung disease (ILD) encompasses a heterogeneous group of pulmonary disorders with variable etiologies, clinical courses, and prognoses. Recent advances in imaging analysis, particularly automated quantification and artificial intelligence-based technologies, have significantly enhanced diagnostic precision and prognostic modeling. Quantitative high-resolution computed tomography allows objective assessment of disease extent, pattern classification, and regional distribution of fibrotic lesions, providing essential information for staging and treatment decisions. Deep-learning-based segmentation and pattern recognition techniques can extract high-dimensional imaging features, facilitating phenotype clustering, risk stratification, and longitudinal monitoring. Recent efforts to integrate imaging data with clinical parameters and multi-omics profiles have further advanced the field of precision medicine. This review discusses the current state of imaging analysis technologies for ILD, emphasizing clinical applications, disease-specific use cases, and emerging directions for biomarker discovery and individualized patient care.
서 론
간질성 폐질환(interstitial lung disease, ILD)은 다양한 원인에 의하여 폐간질에 염증 또는 섬유화가 발생하는 이질적인 질환군으로 임상 양상, 병리적 기전, 예후가 매우 다양하다[1]. 특히 특발성 폐섬유증(idiopathic pulmonary fibrosis, IPF) 및 진행성 섬유화성 ILD는 조기 진단 및 빠른 예후 예측이 환자 관리에 중요한 영향을 미치기 때문에 이를 위하여 흉부 영상 평가의 정밀화가 더욱 요구되고 있다[2-4].
전통적으로 ILD의 진단 및 중증도 평가는 고해상도 흉부 컴퓨터단층촬영(high-resolution computed tomography, HRCT)을 기반으로 한 영상의학적 판독에 의존하여 왔으며 육안 판독(visual assessment)을 통한 영상 소견의 해석은 다학제 진단의 핵심 요소로 여겨져 왔다[5]. 그러나 육안 판독은 판독자 간 변동이 크고 병변의 미세한 분포나 양적 변화를 정량적으로 표현하는 데 한계가 있다[6,7]. 이러한 한계를 극복하고자 최근에는 정량화 영상 분석 기술(quantitative imaging analysis) 및 인공지능 기반 분석 기법이 ILD 영상 판독에 도입되고 있다.
정량화 기술은 병변의 밀도, 분포, 형태학적 특성 등을 구체적으로 수치화함으로써 육안 평가의 주관성을 보완하고 보다 표준화된 진단 기준 정립에 기여할 수 있다. 특히 머신러닝(machine learning) 또는 딥러닝(deep learning) 기반의 인공지능 분할(segmentation) 기술은 ILD 병변(간유리 음영[ground-glass opacity], 망상 음영[reticulation], 벌집 음영[honeycombing] 등)을 자동으로 탐지하고 분할하며 병변의 부피, 위치, 진행 양상을 시간축상에서 정량적으로 평가할 수 있도록 한다(Fig. 1). 이러한 기술은 진단적 활용을 넘어 치료 반응 예측이나 예후 평가를 위한 영상 기반 바이오마커로도 주목받고 있다.
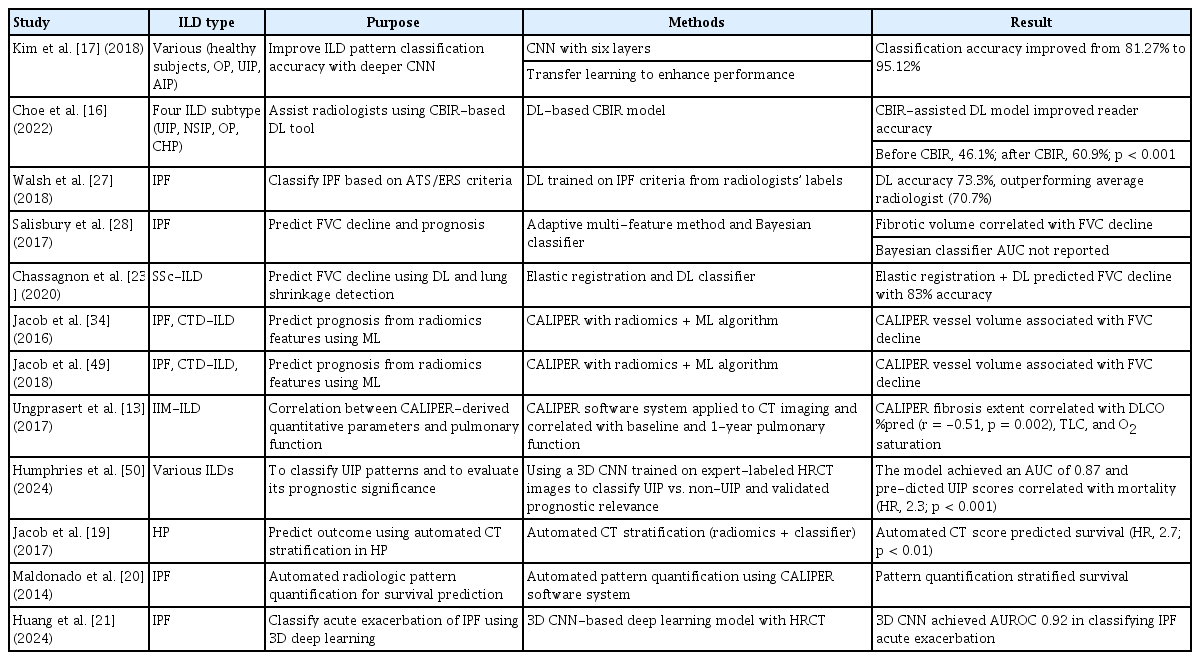
Overview of artificial intelligence-based analysis of high-resolution computed tomography of the chest. Images first undergo automated segmentation to delineate lesions, typically using deep learning models. Various radiomic features within segmented regions are then quantified and the information can be used in disease diagnosis or severity assessment. CT, computed tomography.
본 종설에서는 ILD에서 활용되는 자동화 정량화 및 인공지능 기반 영상 분석 기술의 발전 현황을 고찰하고 질환별 적용 사례, 임상 지표로서의 활용 가능성, 영상-오믹스 융합 분석으로의 확장성 그리고 임상 적용 시 직면하는 기술적, 윤리적 문제를 논의함으로써 ILD 분야에서의 인공지능 영상 분석 기술의 현재와 미래를 조망하고자 한다.
흉부 영상 자동화 영상 분석 기술
전통적 흉부 영상 판독의 한계
IDL의 영상 진단은 주로 HRCT를 기반으로 하며 육안 판독을 통한 병변의 유형 구분 및 질병의 진행 정도의 핵심적인 진단 수단으로 활용되어 왔다[2,3]. 그러나 이러한 전통적 영상 판독은 진단자 간 판단 차이, 경계가 불분명한 병변의 정량적 평가 어려움, 시계열 분석의 비정량성 등의 한계를 지닌다[6,7]. 특히 ILD에서는 간유리 음영, 망상 음영, 벌집 음영 등 다양한 병변 패턴이 복합적으로 존재하며 이들의 명확한 구분과 정도 평가가 필수적이지만 육안 판독만으로는 정확성과 재현성이 떨어질 수 있다[2]. 이러한 한계로 인하여 보다 객관적이고 정량적인 분석 기법의 필요성이 대두되어 왔다.
자동 정량화 및 인공지능 기반 분석 기술 개발
흉부 CT 영상의 자동 정량화 기술은 픽셀(pixel) 또는 복셀(voxel) 단위의 정보를 활용하여 병변의 밀도, 분포, 형태 등의 특성을 수치화하는 방법이며 thresholding, region growing, texture analysis, 히스토그램(histogram) 기반 분할 등 다양한 방식으로 구현될 수 있다[8]. 예를 들어 폐실질에서 -600에서 -250 HU와 같은 특정 HU 범위에 해당하는 영역의 비율을 계산하는 high attenuation area (HAA) 혹은 저밀도 부위를 정량화하는 low attenuation area는 히스토그램 기반 thresholding 방식의 정량화 기법으로 비교적 간단하고 반복 가능한 평가가 가능하다[9,10]. Multi-ethnic study of atherosclerosis 코호트를 포함한 Podolanczuk 등[9]은 HAA가 간질성 폐질환과 관련된 생물학적 마커(matrix metalloproteinase-7, interleukin-6), 폐기능 저하, 운동 능력 감소 그리고 사망률 증가와 유의한 연관성을 보였다고 보고함으로써 HAA가 ILD의 진행 정도와 예후를 반영할 수 있는 정량적 영상 지표로 활용될 수 있음을 시사하였다[9]. 또한 Rea 등[11]은 89명의 IPF 환자를 대상으로 HRCT 영상에서 육안 분석과 영상 밀도 히스토그램 지표들(mean lung attenuation, skewness, kurtosis)을 비교한 결과 자동 정량화 지표들이 시각적 점수보다 폐기능 지표들과 더 강한 상관관계를 보여 임상적으로 더 유용함을 확인하였다.
최근에는 이러한 전통적 영상 분할 기법을 벗어나 머신러닝 또는 딥러닝 기반의 인공지능 기술을 적용한 영상 분할 및 정량화 기술이 새롭게 주목받고 있다(Table 1) [12-17]. 다양한 ILD의 진단 및 예후 평가 연구에 널리 활용되고 있는 Computer-Aided Lung Informatics for Pathology Evaluation and Rating (CALIPER) 소프트웨어는 정량적 CT 분석 기법 중 하나로 숙련된 영상의학 전문의에 의해 훈련된 머신러닝 알고리즘을 기반으로 작동한다[12,13]. CALIPER를 통하여 흉부 CT 영상에서 해부학적 폐 구조를 자동으로 분할하고 추출할 수 있으며 ILD에서 특징적인 간유리 음영, 망상 음영, 벌집 음영, 정상 폐조직, 혈관 관련 구조물(vessel-related structure) 등의 영상 소견을 정량화할 수 있다(Fig. 2) [12,13,18]. 이들 정량 지표의 절대값과 시계열적 변화는 질병의 중증도 및 진행 상태, 치료 반응 평가 등 다양한 임상 영역에서 적용되고 있다[12,13,18-20]. 딥러닝 기반 흉부 영상 분석 알고리즘 또한 기존 규칙 기반이나 intensity-threshold 접근보다 민감도와 특이도가 높아 복잡한 병변 패턴을 정밀하게 탐지할 수 있으며 ILD 분석에 널리 쓰인다[21]. 대표 모델인 U-Net과 변형 구조(2D/3D U-Net, Attention U-Net, nnU-Net)는 CT 영상에서 폐실질을 복셀 단위로 분석하여 병변의 형태, 부피, 위치를 자동 추출한다[22,23]. 이때 섬유화 범위, 혈관 관련 구조물, 기도 크기 등의 지표를 수치화할 수 있으며 이는 진단뿐 아니라 급성 악화와 사망 예측 모델에도 활용된다[22,23].
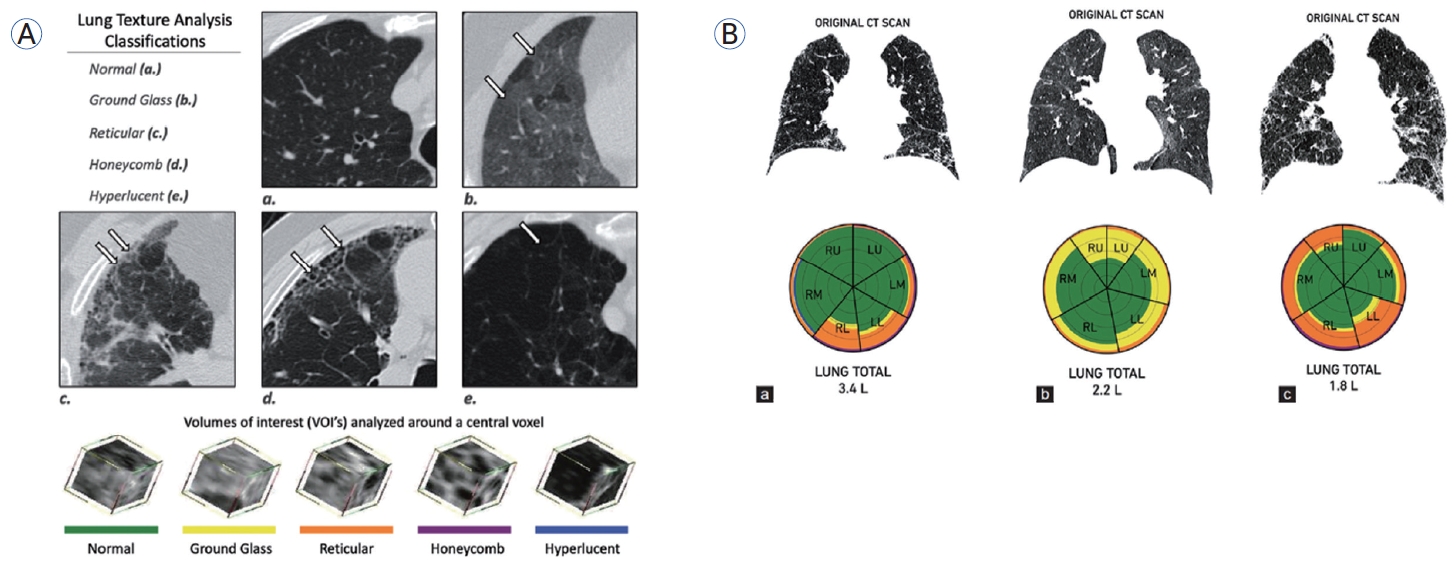
Representative example of chest HRCT analysis using CALIPER software. (A) Voxel-wise classification into healthy lung, ground-glass opacity, reticular pattern, honeycombing, and cysts is color-coded. (B) Bar charts visualize distribution of lesions into lobe and central/peripheral regions. Reproduced from Jankharia et al. [18]. CT, computed tomography; RU, right upper; LU, left upper; RM, right middle; LM, left middle; RL, right lower; LL, left lower; HRCT, high-resolution CT; CALIPER, Computer-Aided Lung Informatics for Pathology Evaluation and Rating.
더욱이 인공지능 기반 분할 모델은 흉부 영상에서 ILD 병변의 정량화뿐만 아니라 폐실질 이상 소견의 공간적 분포 특성까지 반영하여 통상 간질성 폐렴(usual interstitial pneumonia, UIP), 비특이 간질성 폐렴(non-specific interstitial pneumonia, NSIP)의 패턴 분류를 가능하게 하였다. 최근에는 비지도 학습 기반 패턴 클러스터링 기술(unsupervised pattern clustering)이 적용되어 다양한 병변 유형이 혼재된 ILD 영상에서 복합적인 패턴을 분석하고 사망률과 관련된 하위 아형을 자동 분류하여 예후 예측에 활용되었다[24,25].
이러한 인공지능 기반 기술은 최근 다기관 코호트 및 공용 영상 데이터베이스를 통한 외부 검증을 통해 신뢰성을 확보하고 있으며 향후 임상 진료에 실질적으로 적용되기 위한 기반 기술로 주목받고 있다.
간질성 폐질환에서 자동화 영상 분석 기술 적용
특발성 폐섬유증(idiopathic pulmonary fibrosis)
IPF는 ILD에서 자동 정량화 및 인공지능 기반 영상 분석의 적용이 가장 활발하게 이루어진 영역이다. 특히 망상 음영, 벌집 음영 등의 기저 섬유화 병변에 대한 정량 지표 및 시계열적 변화량을 제공하여 진단 및 예후 예측에 활용하였다[15,20,21,26-28]. Kim 등[26]에 따르면 157명의 IPF 환자의 HRCT 영상에서 섬유화 점수(quantitative lung fibrosis, QLF)의 정량적 변화량이 6개월 사이에 4% 이상 증가한 경우 이후 폐기능 저하 및 질병 진행의 위험이 유의하게 증가하며 이는 예후 예측에 중요한 영상 지표로 활용될 수 있음을 보여주었다. 특히 기저에서 가장 심한 병변을 가진 폐엽의 QLF score가 4% 이상 증가한 환자군은 4% 미만인 군에 비해 약 6배 높은 질병 진행 위험(hazard ratio [HR], 5.92, p= 0.001)을 보였고 예측 정확도(C-index)는 0.71로 보고되었다[26]. 최근에는 단일 시점의 HRCT 영상만으로 IPF의 향후 진행을 복셀 단위에서 예측하는 머신러닝 기반 모델도 개발되었다[29,30]. Kim 등 [30]은 193명의 IPF 환 자를 대 상으로 baseline HRCT 영상의 texture feature를 활용하여 quantum particle swarm optimization and random forest 기반 예측 모델을 구축하고 이를 통해 whole-lung 수준의 진행 확률 지표인 single-scan total probability (STP) 점수를 제시하였다. STP는 6-12개월 후의 QLF 변화(r = 0.47, p< 0.001) 및 forced vital capacity (FVC) 변화(r = -0.42, p< 0.001)와 유의한 상관관계를 보였으며 높은 STP 점수를 가진 군은 더 빠른 질병 진행 위험을 나타냈다(HR = 1.53, p= 0.041) [30]. 따라서 추적 영상 없이도 baseline HRCT만으로 질병 진행을 조기에 예측할 수 있는 가능성을 제시하였다.
또한 IPF에서는 급성 악화의 정확한 진단이 예후에 큰 영향을 미치는데, Huang 등[21]은 HRCT상에서 IPF의 급성 악화를 자동 분류하는 3D 딥러닝 기반 모델(SlowFast)을 개발하였다. 독립 테스트 세트에서 IPF의 급성 악화를 area under the curve (AUC) 0.96, 정확도 93.9%, 민감도 90.0%, 특이도 95.7%로 분류하여 방사선 전문의보다 높은 진단 정확도와 일관성을 보였으며 이 급성 악화 진단 모델의 score는 PaO2/FiO2 비율과 유의한 음의 상관관계(r = -0.57, p<0.001)를 보여주어 임상 지표와의 높은 연관성 또한 보여주었다[21].
비특이 간질성 폐렴(non-specific interstitial pneumonia)
NSIP는 간유리 음영와 미만성 섬유화 소견이 특징적이며 UIP에 비해 병변 경계가 불분명하고 분포가 광범위하여 수동 판독에 어려움이 많다[31,32]. 인공지능 기반 영상 분석은 이러한 NSIP 병변을 복 셀 단위로 분할하고 병변의 밀도 및 분포 패턴을 기반으로 진단 보조 도구로 활용되고 있다[25]. Mei 등[25]은 HRCT 영상과 임상 데이터를 통합한 딥러닝 기반 분류 시스템을 개발하여 5가지 ILD 아형(UIP, NSIP, 과민성 폐렴 등)을 자동 분류하였으며 특히 NSIP 진단에서 AUC 0.849, 민감도 65.9%, 특이도 90.5%로 방사선 전문의(민감도 54.6%, 특이도 85.7%)보다 더 높은 정확도와 일관성을 보였다[25].
과민성 폐렴(hypersensitivity pneumonitis)
과민성 폐렴(hypersensitivity pneumonitis, HP)은 HRCT에서 모자이크 감쇠(mosaic attenuation), 중심소엽 결절(centrilobular nodules), 공기 포획(air trapping) 등의 특징적 소견을 보이며 경과에 따라 섬유화 소견을 동반한다[33]. Jacob 등[19]은 98명의 HP 환자를 대상으로 HRCT 영상에 대해 CALIPER 기반 자동 분석을 수행하였고 정량화된 망상 음영의 범위가 독립적인 사망 예측 인자임을 확인하였다(HR, 1.12; 95% confidence interval [CI], 1.05-1.19, p= 0.001). 또한 영상 기반 자동 계층화(stratification) 모델은 ILD-GAP 모델과 유사한 사망 예측력을 보였으며(C-index, 0.73) 두 모델을 통합하였을 예측력이 유의하게 향상되었다(C-index, 0.77) [19]. 다만 간유리 음영과 망상 음영의 정량 평가에서는 육안 판독과 CALIPER 분석 간에 다소 차이를 보였는데(간유리 음영 점수, 11.2% vs. 23.4%; 망상 음영 점수, 28.6% vs. 20.8%) 이는 간유리 음영 위에 망상 음영이 중첩된 복합 병변에 대한 해석 방식의 차이에 기인하였다[19]. 해당 연구에서 시각 판독자들은 해당 부위를 망상 음영으로 분류한 반면 CALIPER는 이를 간유리 음영으로 자동 분류하였다[19]. 이러한 결과는 자동 정량화 도구가 일관된 기준으로 병변을 분석할 수 있는 장점을 가지는 한편 복합 병변에 대한 임상적, 병리학적 맥락을 충분히 반영하기에는 아직 한계가 있음을 시사하였다.
결합조직질환 관련 간질성 폐질환(connective tissue disease-associated interstitial lung disease)
결합조직질환 관련 간질성 폐질환(connective tissue disease-associated interstitial lung disease) 환자에서 병변 패턴을 자동 분류 및 정량화하여 정확도와 예후 예측에 활용한 연구들이 다수 보고되었다[13,23,34,35]. Chassagnon 등[23]은 전신경화증 관련 ILD 환자의 HRCT에 딥러닝 기반 AtlasNet을 적용하여 간유리 음영, 망상 음영, 견인성 기관지확장증, 벌집 모양 음영 등 ILD 범위를 자동 정량화하였다. 그 결과 영상의학 전문의 판독과 유사한 정확도(다이스 계수, 0.74-0.75)를 보였고 diffusing capacity for carbon monoxide (r = -0.76), FVC (r = -0.62)와도 유의한 상관관계를 보여 임상적 유용성을 입증하였다[23]. Oh 등[35]은 144명의 rheumatoid arthritis-IDL (RA-ILD) 환자 HRCT에서 자동 정량화 시스템을 적용하여 QLF를 산출하였다. 그 결과 QLF가 5년 사망률과 유의한 상관성을 보이며 독립적 예측 인자로 확인되었다(HR, 1.068; 95% CI, 1.026-1.113; p< 0.05). 특히 QLF ≥ 12% 군은 예후가 불량한 IPF와 유사한 생존 곡선을 보였다[35].
Radiomics 및 영상-임상-오믹스 통합 분석의 가능성
Radiomics는 의료 영상으로부터 정량적 특징을 대량으로 추출하고 이를 임상적 및 생물학적 지표와 연관 지어 분석하는 데이터 마이닝 기반의 영상 분석 기법으로 정량화 및 인공지능 기반의 다양한 흉부 영상의 분석법이 이루어짐에 따라 더욱 관심도가 높아지고 있다[36]. 표준화된 영상 획득, 관심 병변(섬유화 병변 등)의 분할(segmentation), 의미 기반(semantic) 또는 비의미 기반(agnostic) 영상 특징 추출, 임상-유전-오믹스 데이터를 포함한 수치형 정보의 통합, 이를 활용한 예측 모델링 및 연관성 분석으로 구성되는 일련의 과정은 ILD 분야에서 진단, 질병 중증도 및 예후 예측에 활용되고 있다[37].
Han 등[38]은 RA-ILD 환자를 대상으로 CT 영상에서 추출한 영상 특성과 혈청 KL-6 농도를 통합하여 질병 중증도를 예측하는 모델을 개발하였다[38]. 연구자들은 CT 영상에서 수천 개의 영상 특성(radiomics feature)을 뽑은 뒤 그중 중요한 19가지를 선별하여 radiomics signature를 만들었다. 이 radiomics signature와 KL-6 수치를 결합한 nomogram 모델은 training cohort와 validation cohort에서 각각 AUC 0.948과 0.923의 높은 예측 정확도를 보였다. 이 접근법은 폐기능 검사 시행이 어려운 환자에서도 유용하게 활용될 수 있으며 영상과 생물학적 지표의 융합을 통한 정밀 의료의 가능성을 제시하였다[38].
Radiomics와 단백체 정보를 융합한 radio-proteomics는 영상에서 추출된 특징과 단백질 발현 패턴 간의 연관성을 규명하여 영상 표현형이 생물학적 반응을 반영할 수 있음을 보여주는 기법으로 ILD 연구에서도 적용된 바 있다[39,40]. Lauer 등[40]은 bleomycin으로 폐섬유증을 유도한 마우스 모델에서 항섬유화 치료 전후로 micro-CT 영상을 획득하여 치료 전후 radiomics feature 변화를 분석하고 두 군의 영상 표현형을 도출하였다. 이 두 군 간의 단백질 발현 양상을 비교한 결과 섬유화 생성과 관련된 생물학적 경로 활성도에서 유의한 차이가 있음을 확인하였다. 또한 이러한 섬유화 형성 단백 발현과 밀접히 연관된 영상 지표를 실제 progressive fibrosing-ILD 환자 데이터에 적용한 결과 폐기능 저하 정도와의 관련성이 나타나 추후 radiomics가 치료 반응 예측을 위한 비침습적 바이오마커로 활용될 가능성을 보여주었다[40].
이러한 영상-임상-오믹스 융합 기반의 분석 플랫폼은 향후 환자 맞춤형 치료 전략 수립을 위한 임상 의사결정 지원 시스템의 핵심 요소로 자리 잡을 것으로 기대된다.
현장 적용의 제약과 극복 과제
인공지능 기반 자동 영상 분석 기술은 ILD의 정량적 진단과 예후 예측에 새로운 가능성을 제시하고 있으나 실제 임상 현장에서의 도입과 확산에는 다양한 기술적, 제도적, 윤리적 제약이 존재한다. 이러한 제약을 해결하고 기술의 실용화를 이루기 위해서는 신뢰성 확보와 더불어 임상 환경과의 정합성 그리고 사회적 수용성을 모두 충족시켜야 한다.
표준화, 재현성, 외부 검증의 필요성
가장 큰 제약 중 하나는 영상 데이터와 분석 방법의 표준화 부족이다. 흉부 CT 영상은 촬영 장비, reconstruction algorithm, slice thickness, window 설정 등에 따라 정량화 결과가 크게 달라질 수 있으며 이는 알고리즘의 적용성과 일반화 가능성을 저해한다[41,42]. 따라서 다양한 기관 및 장비 조건에서 일관된 성능을 보장할 수 있는 알고리즘의 개발과 함께 표준화된 영상 프로토콜 및 전처리 파이프라인의 정립이 필수적이다.
또한 대부분의 인공지능 모델은 단일 기관 또는 소규모 코호트에서 훈련되고 평가되어 실제 임상 환경에서의 충분한 외부 검증(external validation)이 부족한 실정이다. 다기관 기반의 대규모 외부 검증 연구는 모델의 일반화 가능성과 신뢰도를 확보하는 데 필수적이며 임상에서 적용 전 필수적으로 수행되어야 할 과정이다[43].
설명 가능성 및 임상 수용성
인공지능 모델은 복잡성 및 고차원적 특성으로 인하여 결과 도출에 대한 내부 작동 원리를 알기 어려워 종종 black box로 간주되며 이로 인하여 판독 결과에 대한 해석 가능성(explainability)이 떨어지는 경우가 많다. 이는 의료진의 신뢰를 떨어뜨리고 진단 및 치료 결정에 적극적으로 활용하는 데 장벽이 될 수 있다[44]. 따라서 모델의 판독 근거를 시각적으로 설명하거나 특정 영상 영역(feature map)을 강조하는 explainable AI 기술의 병행 개발이 중요하다[45,46]. 또한 개발된 모델에 대하여 다양한 코호트에 걸친 정밀하고 반복 가능한 내부 및 외부 검증 절차를 시행하여야 하며 영상 기반 지표가 실제 임상 지표(폐기능 변화, 생존율 등)와 어떤 방식으로 연관되는지를 명확히 입증하는 연구가 수행되어야 인공지능 기반 정량 지표의 임상적 수용성을 높일 수 있다[44].
법적, 윤리적 문제 및 규제 대응
인공지능 기반 진단 도구는 의료기기법 또는 인공지능 의료기기 가이드라인에 따라 규제 대상이 되며 그 안전성과 유효성을 입증하여야 한다[47]. 특히 환자 데이터의 학습, 분석, 저장 과정에서 발생할 수 있는 개인 정보 보호 이슈 및 책임 주체 불명확성은 중요한 법적 및 윤리적 쟁점이다[48]. 예를 들어 인공지능 분석 결과에 근거한 진단 또는 치료 결정에 오류가 발생하였을 경우 의료진, 병원, 알고리즘 개발자 중 어느 주체가 책임을 지는가에 대한 법적 기준이 명확하지 않다. 이러한 문제는 향후 인공지능 기반의 의사결정 참여 비중이 높아질수록 더욱 중요해질 것으로 예상된다.
결론 및 향후 전망
ILD는 병인과 임상 경과의 이질성이 큰 질환군으로 영상 기반의 정밀 진단과 예후 예측이 환자 맞춤형 진료에 필수적이다. 본 종설에서는 ILD 환자에서의 자동화 영상 정량화 및 인공지능 기반 분석 기술의 최근 발전을 살펴보고 정량 지표의 임상적 활용 가능성과 영상-오믹스 통합 분석으로의 확장성과 임상 실무 적용의 제약 요소를 종합적으로 고찰하였다.
최근의 딥러닝 기반 분석 기술은 HRCT 영상에서 ILD 병변의 유형과 범위를 자동 분할하고 정량화함으로써 기존 육안 판독의 주관성과 한계를 보완하는 유용한 도구로 발전하고 있다. 특히 IPF를 포함한 진행성 섬유화성 ILD에서 영상 기반 정량 지표는 폐기능 지표와 상호 보완적으로 작용하며 환자의 예후 예측 및 치료 반응 모니터링에 있어 임상적 활용 가능성을 보여주고 있다. 또한 영상 데이터를 혈청 바이오마커, 단백체 등 다른 오믹스 정보와 통합함으로써 질병의 분자적 특성을 반영할 수 있는 영상 바이오마커의 개발이 가능해졌으며 이는 침습적 검사 없이 환자 맞춤형 진료와 임상시험 대상자 선별 등의 정밀 의료 실현을 가속화할 것으로 기대된다.
그러나 이러한 기술들이 임상 현장에 안정적으로 적용되기 위해서는 영상 획득 및 분석 과정의 표준화, 알고리즘의 외부 검증 및 설명 가능성 확보, 법적, 윤리적 기준 정립이 반드시 병행되어야 한다. 아울러 다양한 인구 집단 및 질환 아형을 포괄하는 대표성 있는 데이터 기반의 모델 개발이 필요하며 이를 통해 진단 정확도뿐 아니라 임상의 신뢰도 역시 제고될 수 있을 것이다.
향후에는 다기관 협력 및 다중 모달 데이터 통합을 기반으로 한 대규모 연구를 통해 영상 기반 인공지능 분석 기술의 임상적 유효성과 안전성을 입증하고 환자 개별 특성에 기반한 진단 및 치료 전략 수립에 실질적으로 기여하는 기술로 자리매김 할 수 있을 것으로 기대된다.
Notes
CONFLICTS OF INTEREST
No potential conflicts of interest relevant to this article were reported.
FUNDING
JWS was supported by the Bio & Medical Technology Development Program (NRF-2022M3A9E4082647) of the National Research Foundation of Korea (NRF) funded by the Ministry of Science & ICT, Republic of Korea, and was also supported by the Korea National Institute of Health research project (2024ER090500) and the Korea Environment Industry & Technology Institute through Core Technology Development Project for Environmental Diseases Prevention and Management Program funded by the Korea Ministry of Environment (RS-2022-KE02197), Republic of Korea.
AUTHOR CONTRIBUTIONS
Ju Hyun Oh contributed to the conceptualization, literature search, drafting, and revision of the manuscript. Jin Woo Song supervised the study, provided conceptual guidance, critically revised the manuscript for important intellectual content, and approved the final version of the manuscript.
ACKNOWLEDGEMENTS
None.