뇌경색 예방을 위한 난원공 경피적 폐쇄술
Patent Foramen Ovale Closure for Secondary Stroke Prevention
Article information
Trans Abstract
Patent foramen ovale (PFO) is a common congenital cardiac anomaly that may serve as a conduit for paradoxical embolism, potentially leading to ischemic stroke. Randomized controlled trials have demonstrated that PFO closure effectively reduces stroke recurrence, with particularly favorable outcomes in patients with high-risk PFO features such as a large shunt size or atrial septal aneurysm. However, real-world clinical data have shown inconsistent findings, raising concerns regarding the generalizability of these results. Additionally, post-procedural atrial fibrillation remains a significant issue and requires careful patient selection. While recent studies have refined the criteria for identifying patients most likely to benefit from PFO closure, direct comparisons between PFO closure and non-vitamin K antagonist oral anticoagulants (NOACs) remain lacking. Further research is required to optimize long-term management strategies and evaluate treatment outcomes across diverse patient populations.
서 론
난원공은 출생 전 태아의 순환에서 중요한 역할을 하지만 대부분 출생 후 12-24시간 안에 닫히게 된다. 그러나 일부에서는 닫히지 않고 개방된 상태로 남아있는데 이를 난원공 개존증(patent foramen ovale)이라고 한다. 난원공 개존증은 전체 인구의 약 20-25%에서 관찰되며 대부분 무증상으로 혈역학적 의미를 가지지 않는다[1]. 하지만 특정 상황에서는 역설적 색전증(paradoxical embolism)을 통해 뇌경색의 원인이 될 가능성이 있다. 난원공 개존증은 우심방의 압력이 좌심방의 압력을 초과할 때 역설적 색전증의 경로를 제공할 수 있는데[2] 일시적인 압력 차이만으로도 션트가 발생할 수 있으며 이는 평소 션트가 없거나 좌우 션트(left-to-right shunt)가 있는 환자에서도 가능하다.
뇌경색은 우리나라에서 사망 원인 4위를 차지하는 중요한 질환으로 그 환자 수는 계속 증가하고 있다[3]. 통계에 따르면 전체 허혈성 뇌경색의 30-40%는 특발성 뇌경색으로 분류되며 이 중 절반 이상이 원인 미상의 색전성 뇌경색(embolic stroke of undetermined source, ESUS) 환자에 해당한다. 이들 중 약 25%가 난원공 개존증을 가지고 있는 것으로 보고되며 나이와 기저 질환을 고려하였을 때 최대 4%에서 난원공 개존증이 뇌경색과 관련된 것으로 추정된다. 특히 55세 미만의 뇌경색 환자의 경우 약 40%가 특발성 뇌경색으로 분류되는데 이들 환자들에서 난원공 개존증의 유병률이 더 높은 것으로 나타났다[4].
이러한 배경에서 난원공 개존증이 뇌경색의 원인으로 추정되는 환자에서 뇌경색의 재발을 막기 위한 방법으로 난원공개존증 폐쇄술이 시도되었다. 초기 무작위 대조군 연구(randomized controlled trials)에서는 뚜렷한 효과를 입증하지 못하였으나[5,6] 2010년대 후반 이후 환자 선택 기준과 시술 기구의 발전을 통해 새롭게 진행된 연구에서 긍정적인 결과가 보고되었다[7-9]. 이후 우리나라에서도 보험 적용이 가능해지면서 시술은 점점 더 많이 시행되고 있다.
이에 본고에서는 2차 뇌경색 예방을 위한 경피적 난원공 개존증 폐쇄술에 대한 연구를 검토하고 특히 적절한 환자 선별의 중요성에 대해 논의하고자 한다.
본 론
난원공 개존증과 연관된 뇌경색
난원공 개존증으로 인한 뇌경색은 전신 정맥 순환계에서 발생한 혈전이 난원공을 통해 직접 대뇌 동맥 순환계로 이동하여 역설적 색전을 유발하면서 발생한다. 주로 작은 혈전이 뇌로 이동하기 때문에 대뇌 피질 부위에 소규모 병변이 나타나며[10] 우심방의 압력이 높아지는 발살바 수기는 상대적으로 후방순 환계의 혈류를 증가시켜 후방순환계 부위의 뇌경색 발생을 더 자주 초래한다[11].
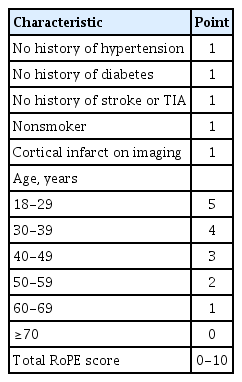
동맥 경화로 인한 뇌경색 환자는 고혈압, 당뇨병, 고지혈증, 흡연력과 같은 주요 위험 요인을 동반하는 경우가 많은 반면 난원공 개존증과 연관된 뇌경색 환자는 이러한 위험 요인이 적은 젊은 연령에서 발생하는 경우가 흔하다. 이러한 특징을 기반으로 개발된 역설적 색전증 위험 점수(risk of paradoxical embolism, RoPE)는 난원공 개존증과의 연관성을 평가하며 6점 이상인 경우 난원공 개존증으로 인한 뇌경색 가능성이 높다(Table 1) [12].
난원공 개존증의 진단
난원공 개존증을 진단하는 가장 정확한 방법은 우심도자술을 통해 좌심방과 우심방 사이의 구멍을 직접 확인하는 것이다. 그러나 실제 임상에서 뇌경색 환자에서 난원공 개존증을 평가하기 위하여 주로 사용되는 검사는 경흉부 초음파(transthoracic echocardiography), 경식도 초음파(transesophageal echocardiography) 그리고 경두개 초음파(transcranial Doppler)이다.
이 중 경식도 초음파는 난원공 개존증 진단의 표준 검사로 난원공의 크기와 모양에 대한 정밀한 해부학적 정보를 제공할 뿐만 아니라 고위험 특징을 평가할 수 있다는 장점이 있다. 검사 과정은 미세 기포가 포함된 식염수(agitated saline)를 정맥으로 주입하여 우심방에서 기포를 포착하고 3개의 심장 주기 이내에 좌심방에서 기포가 관찰되면 우좌 단락을 의심할 수 있다. 이 때 발살바 수기를 사용하여 난원공 개존에 의한 우좌 단락을 유도하여 이를 확인한다[13,14]. 난원공 단락의 크기는 우심방에서 기포가 관찰된 후 3개의 심장 주기 내에 좌심방에서 확인되는 기포의 개수로 평가하는데 좌심방에서 20개 이상의 미세 기포가 관찰되면 난원공의 크기가 큰 것으로 평가할 수 있다. 큰 단락이 관찰되거나 심방중격류(atrial septal aneurysm)가 동반된 경우에는 고위험 특징으로 분류된다[15]. 이 외에도 유스타키안판(Eustachian valve)이나 키아리 네트워크(Chiari’s network)가 관찰되면 고위험 특징의 난원공 개존증으로 간주할 수 있다[16,17]. 경두개 초음파는 발살바 수기를 통해 우좌 단락을 좀 더 간편하게 평가할 수 있어 민감도가 높은 장점이 있지만 폐동정맥 단락이나 해부학적 구조를 직접 시각적으로 평가하기 어렵다는 한계가 있어 특이도는 낮다[18].
재발성 뇌경색 예방을 위한 난원공 개존증 폐쇄술에 관한 연구
난원공 개존증이 있는 원인 불명 뇌경색 환자의 재발성 뇌경색 발생률은 2% 이하로 다른 원인에 비해 낮다. 그러나 이러한 환자들은 비교적 젊은 연령층이 많아 장기적인 누적 발생률이 높아질 가능성이 있다. 이들의 뇌경색은 주로 난원공 개존증을 통한 역설적 색전증(paradoxical embolism)으로 설명되므로 이를 예방하고 재발률을 줄이기 위한 난원공 개존증 폐쇄술의 효과를 평가하는 전향적 무작위 연구가 진행되었다.
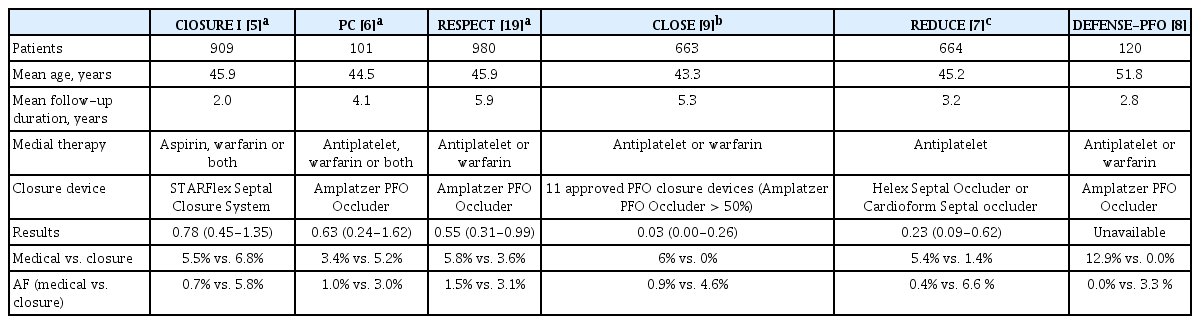
초기 무작위 연구인 CLOSURE I과 PC 연구에서는 난원공 폐쇄술이 약물 치료보다 더 나은 결과를 보이지 못하였다[5,6]. 이러한 결과는 난원공 개존증이 뇌경색 발생과 직접적인 연관성이 높은 환자를 적절히 선별하지 못한 점, 혈전 형성 위험이 있는 기구 사용, 높은 시술 실패율, 통계적 검정력 부족 등이 문제점으로 분석되었다. 이후 연구들은 이러한 초기 연구의 한계를 보완하며 진행되었다. RESPECT 연구에서는 초기에는 중립적인 결과를 보였으나 장기 추적 관찰에서는 난원공 폐쇄술이 재발성 뇌경색 위험을 유의미하게 줄이는 것으로 나타났다[19]. REDUCE 연구에서는 난원공 폐쇄술이 항혈소판 치료 단독 요법보다 뇌경색 발생률을 효과적으로 감소시켰고[7] DEFENSE-PFO 연구에서는 난원공 폐쇄술이 약물 치료와 비교하여 뇌경색, 혈관 사망, 주요 출혈로 구성된 복합 결과의 발생률을 2년간 유의미하게 낮추는 결과를 보였다[8]. CLOSE 연구에서는 난원공 폐쇄술을 받은 환자들에서 허혈성 뇌경색이 한 건도 발생하지 않았다(Table 2) [9].
이러한 연구들과 메타 분석 결과는 난원공 개존증이 있는 원인 불명 뇌경색 환자에서 난원공 폐쇄술이 허혈성 뇌경색의 재발 위험을 감소시키는 데 효과적임을 보여준다. 하지만 난원공 폐쇄술을 받은 환자군에서 뇌경색의 또 다른 대표적인 원인으로 알려진 심방세동(atrial fibrillation)의 발생률이 약물 치료를 받은 환자군보다 높게 보고되었다[20].
난원공 폐쇄술의 무작위 연구와 실제 임상 데이터 간의 차이
최근 무작위 연구들은 난원공 개존증 폐쇄술의 긍정적인 효과를 보고하였으나 실제 임상에서는 이러한 연구 결과와 다른 경향이 일부 관찰되었다. 2023년에 발표된 연구에서는 미국 OptumLabs 데이터베이스의 비식별화된 청구 데이터를 활용한 후향적 코호트 분석을 통해 난원공 폐쇄술을 받은 환자와 항혈소판제 치료군을 비교하였다. 분석 결과 난원공 폐쇄술을 받은 환자군에서 사망률은 낮았으나 뇌경색 재발률은 두 그룹 간 유의한 차이가 없었다[4]. 또한 Bonnesen 등[21]은 덴마크의 인구 기반 레지스트리를 분석한 결과 뇌경색으로 인하여 난원공 폐쇄술을 받은 환자들이 나이와 성별을 매칭한 일반 인구에 비해 뇌경색 발생률이 더 높다고 보고하였다. 이는 난원공 폐쇄술을 받은 환자에서도 지속적인 뇌경색 위험 인자 관리가 필요하며 일부 환자는 난원공 개존증과 무관한 뇌경색임에도 불구하고 폐쇄술을 받았을 가능성을 시사한다.
한편 난원공 폐쇄술 후 심방세동 발생에 대한 우려도 제기되고 있다. 시술 후 발생하는 심방세동은 폐쇄술 기구에 의한 국소 자극(irritation), 심방 조직의 신장(stretching), 좌심방 기능 변화 등의 기전으로 발생하는 것으로 알려져 있으며 일반적으로는 일시적으로 발생한 후 자연적으로 소실된다고 보고된다. 그러나 장기적인 예후에 대한 연구는 아직 부족하다[22]. 무작위 대조 연구에서는 난원공 폐쇄술 후 심방세동 발생률이 3-5% 수준으로 보고되었으나(Table 2) 난원공 폐쇄술 이후 loop recorder를 삽입하여 한 달간 추적한 연구에서는 전체 환자의 20.8%에서 심방세동, 심방조동(atrial flutter) 또는 상심실성 빈맥(supraventricular tachycardia)이 발생한 것으로 나타났다[23]. 이는 기존 무작위 연구보다 높은 발생률을 시사하며 난원공 폐쇄술 후 심방세동이 장기적으로 미치는 영향을 면밀히 평가할 필요가 있음을 강조한다.
이러한 실제 임상 데이터는 난원공 폐쇄술의 효과를 극대화하기 위해서는 환자 선별이 필수적임을 보여준다. 따라서 무작위 연구와 실제 임상 데이터 간의 차이를 고려하여 보다 정교한 기준을 바탕으로 폐쇄술이 적절한 대상에게 시행될 수 있도록 맞춤형 치료 접근이 요구된다.
환자 선별
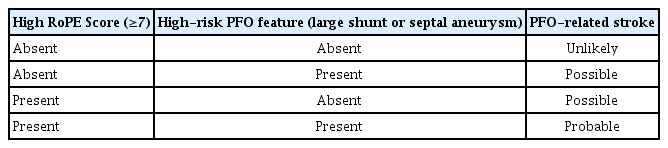
난원공 폐쇄술 효과에 대한 특징을 고려하여 Kent 등[24]은 기존의 난원공 폐쇄술 관련 무작위 연구를 추가 분석하여 난원공-연관 뇌경색 인과 가능성 분류 체계(patent foramen ovale-associated stroke causal likelihood, PASCAL)를 제안하였다. PASCAL 점수는 기존의 RoPE 점수에 더해 큰 단락(large shunt) 또는 심방중격류(atrial septal aneurysm)와 같은 고위험 난원공 특징의 유무를 결합하여 난원공과 뇌경색 간의 인과 가능성을 평가한다. PASCAL 점수 체계에서 큰 단락은 경식도 초음파에서 좌심방에 20개 이상의 미세 기포가 관찰되는 경우로 정의되며 심방중격류는 중심선에서 10 mm 이상 편위되는 경우로 정의된다. PASCAL 알고리즘에 따라 난원공이 뇌경색의 가능한 원인으로 분류된 환자에서 중앙값 57개월 동안의 추적 관찰 결과 재발성 뇌경색 위험이 유의미하게(90%) 감소하였다. 반면 난원공과 무관한 뇌경색으로 분류된 환자에서는 난원공 폐쇄술이 재발성 뇌경색 위험 감소와 관련이 없었으며 오히려 기기 관련 심방세동 발생률이 더 높았다[24]. PASCAL 분류 체계에 따라 가 능성 낮음(unlikely), 가능성 있음(possible), 가능성 높음(probable)으로 분류된 환자의 위험비(hazard ratio)는 각각 1.14 (95% confidence interval [CI], 0.53-2.46), 0.38 (95% CI, 0.22-0.65), 0.10 (95% CI, 0.03-0.35)으로 나타나 PASCAL 분류 체계를 바탕으로 환자를 선별할 수 있는 가능성을 보여주었다(Table 3).
환자 선별 시 특히 신중해야 하는 대상자는 고령의 환자이다. 대부분의 무작위 연구는 60세 이하의 환자를 대상으로 진행하였으나 실제 임상 연구 결과를 살펴보면 60세 이상에서도 종종 시술이 시행되고 있다. 고령에서 난원공 폐쇄술이 더 낮은 효과를 보이는 이유는 난원공 개존증 이외의 다른 원인으로 인한 뇌경색 발생 가능성이 더 높기 때문이다. 65세 이상의 뇌경색 환자에서 subcutaneous electrocardiogram monitoring으로 추적한 결과 34%에서 5분 이상의 잠재성 심방세동(subclinical atrial fibrillation)이 확인되었고 나이가 증가할수록 그 비율은 더 높아졌다. 또 다른 연구에서는 55세 이상의 원인 불명 뇌경색 환자 중 고위험 난원공을 가진 환자들을 대상으로 6개월간 loop recorder를 삽입하여 관찰한 결과 11%에서 심방세동이 동반된 것으로 보고되었다. 고령 환자는 판막 질환, 종양, 동맥경화, 심방 심근병증과 같은 동반 질환의 가능성이 높아 다른 원인에 대한 감별 진단이 필수적이다. 또한 고령 환자에서 난원공 폐쇄술 후 심방세동 발생률이 더 높다는 보고도 있어 고령의 환자에서는 시술 적응증을 보다 신중하게 고려해야 한다.
난원공 폐쇄술의 적응증을 결정할 때는 난원공의 해부학적 위험도를 평가하는 것도 중요한 요소이다. PASCAL 분류에서는 큰 단락과 심방중격류로 평가하지만 이외에도 유스타키안판(Eustachian valve)이나 키아리 네트워크(Chiari’s network)의 동반, 긴 터널 형태 등이 난원공 개존증의 고위험 특징으로 보고된 바 있다. 따라서 이러한 해부학적 고위험 특징이 없는 환자에서는 난원공 폐쇄술은 보다 신중히 고려해야 한다. 즉 난원공 개존증이 단순 동반 소견인지, 뇌경색의 직접적인 원인으로 기여하였을 가능성이 높은지를 철저히 평가하는 것이 중요하며 이를 기반으로 개별화된 치료 전략을 수립할 필요가 있다.
현재의 진료지침
2021년 미국심장협회(American Heart Association, AHA)/미국뇌졸중협회(American Stroke Association, ASA)의 진료 지침에 따르면[25] 난원공 개존증 환자의 2차 뇌경색 예방은 혈관신경학에 전문성을 가진 신경과 전문의와 난원공 개존증 폐쇄에 전문성을 가진 심장내과 전문의가 공동으로 결정해야 한다고 권고하고 있다(class I). 일부 연구에서 60세 이상의 환자가 포함되기는 하였으나 고령 환자에서는 매우 드문 임상 상황에서만 시술을 고려하며 시술 전 반드시 철저한 평가를 통해 다른 뇌경색 원인이 없음을 확인해야 한다고 강조한다. 난원공 개존증 폐쇄술의 효과를 입증한 연구들은 모두 열공성 뇌경색 환자를 제외하였다. 따라서 원인 불명 뇌경색은 열공성 뇌경색을 제외한 ESUS로 정의되며 이러한 근거에 따라 지침은 18-60세 사이의 비열공성 원인 불명 뇌경색 환자를 대상으로 한다. 이 중 해부학적으로 고위험 난원공 특징(큰 단락 크기, 심방중격류 등)이 있는 경우 난원공 폐쇄술을 class IIA로 권고하고 있다. 반면 난원공이 해부학적으로 낮은 위험으로 평가되는 경우 환자 선별에 있어 RoPE의 활용 가능성을 제시하며 이를 class IIB로 권고한다.
유럽뇌졸중학회(European Stroke Organization, ESO) 또한 18-60세 환자 중 난원공 개존증 외 다른 뇌경색 원인이 없는 경우 난원공 개존증 폐쇄술과 항혈소판제 사용을 권고한다. 그러나 60세 이상의 환자에 대해서는 증거가 불충분하다고 언급하고 있다[26].
향후 전망
난원공 폐쇄술의 최적 적응증을 설정하기 위하여 고위험군 식별 연구가 필요하다. 현재까지는 난원공 폐쇄술과 경구항응고제(non-vitamin K antagonist oral anticoagulants [NOAC])의 직접 비교 연구가 부족하며 출혈 위험이 높은 환자에서의 최적 치료 전략도 명확하지 않다. 또한 성별, 인종, 해부학적 특징에 따른 하위 그룹 분석이 충분히 이루어지지 않았다. 향후 연구는 난원공 폐쇄술과 NOAC를 비교하는 무작위 대조 연구와 함께 고위험군 선별 및 개별 맞춤 치료 전략을 보다 다듬는 방향으로 진행될 필요가 있다.
결 론
난원공 개존증은 일부 환자에서 역설적 색전증을 통해 뇌경색의 원인이 될 수 있으며 이에 대한 예방적 접근으로 난원공 폐쇄술이 시행되고 있다. 최근 연구들은 적절한 환자 선별이 이루어진 경우 난원공 폐쇄술이 뇌경색 재발 위험을 줄이는 데 효과적임을 보여주었지만 여전히 해결해야 할 연구 과제가 남아 있다. 특히 난원공과 뇌경색 간의 명확한 인과 관계를 규명할 수 있는 고위험군 선별법, 난원공 폐쇄술과 NOAC의 직접 비교 연구, 출혈 위험이 높은 환자에서의 최적 치료 전략이 추가적으로 연구될 필요가 있다. 또한 성별, 인종, 해부학적 특징에 따른 하위 그룹 분석과 장기적인 예후 평가도 지속적으로 이루어져야 한다. 향후 연구를 통해 난원공 폐쇄술의 최적 적응증과 치료 전략이 보다 정교하게 확립될 것으로 기대된다.
Notes
CONFLICTS OF INTEREST
No potential conflict of interest relevant to this article was reported.
FUNDING
None.
AUTHOR CONTRIBUTIONS
Hyue Mee Kim conceived the topic, drafted, and revised the manuscript.
ACKNOWLEDGEMENTS
None.