비소세포폐암의 표적 치료
Targeted Therapy for Non-Small Cell Lung Cancer
Article information
Trans Abstract
Treatment of progressive non-small cell lung cancer (NSCLC) has advanced remarkably, due in part to the development of targeted therapies. Several gene alterations, including EGFR, ALK, ROS1, and BRAF, play important roles in carcinogenesis. Therefore, many targeted agents focusing these gene alterations have been developed and proving their therapeutic efficacies in many clinical trials. Now we should test these gene mutations and should apply treatments individually and properly to ensure the maximal survival benefit of each patient. In this review, we summarize the target genes and respective therapeutic agents in NSCLC.
서 론
폐암은 전 세계적인 호발 암종으로, 암 관련 사망의 주요 원인이다[1,2]. 국립암센터의 우리나라 암 통계자료에 따르면, 폐암은 암 발생 순위 4위로 연간 25,000명 이상의 환자가 새롭게 폐암 진단을 받는다. 1990년대 대비 2000년대 이후 5년 생존율의 향상을 보이고는 있으나 여전히 폐암은 5년 상대 생존율 28.2%에 머무는 것에 그치고 있고, 원격 전이가 동반된 경우 국내에서 집계된 5년 관찰 생존율은 6.1%로 매우 낮다[3].
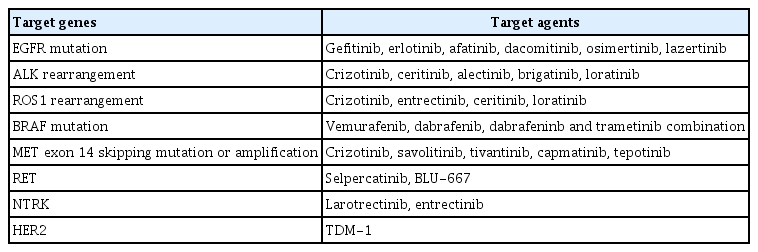
그렇지만 2000년대 이후 전이성 비소세포폐암의 치료에 있어 큰 발전이 있어온 것은 사실이다. 가장 다양하고 효과적인 표적치료제가 개발되고 적용된 암종이며, 면역항암제 역시 좋은 치료 효과를 보여 점점 더 적용 영역을 넓혀가고 있다. 세포독성 항암제 역시 치료의 기본 약제로서 여전히 중요하게 사용되고 있다. 이에 진료 현장에서 완치 목적의 치료가 적용되기 어려운 4기 비소세포폐암 환자의 항암 치료를 결정할 때는 환자 개인별로 가장 효과적인 치료를 받을 수 있도록 환자가 가진 암의 분자병리학적 정보를 우선적으로 확인하고, 이에 맞춰 치료제를 선택해야 한다. 특히 비소세포폐암에서는 일부 유전자 변이를 동반한 환자에서 그 유전자 변이를 타겟으로 하는 표적치료제가 좋은 효과를 보이기 때문에 해당되는 유전자 변이가 있는지에 대한 확인이 매우 중요하다. 유전자 변이 중 중요한 검사는 EGFR, ALK, ROS1, BRAF 유전자의 돌연변이로 이에 대한 검사와 치료제는 보험 급여가 되고 있으며, 이외에도 MET, RET, HER2, neurotrophic receptor tyrosine kinase (NTRK) 등의 유전자 변이가 있을 경우 새로운 치료 약제에 대한 임상시험이 진행 중인 경우도 있으므로 각각의 유전자 변이 검사뿐만 아니라 동시에 수백가지의 유전자 변이 검사를 한번에 시행할 수 있는 차세대염기서열분석(next-generation sequencing, NGS) 기법을 이용하여 유전자 변이 검사를 진행하기도 한다. 본고에서는 현재 비소세포폐암에서 사용되고 있는 표적 치료에 대하여 정리하도록 하겠다(Table 1). 항암제의 효과는 통상적으로 임상 시험에서 전체 생존 기간이나 무진행 생존 기간을 통계적으로 연장시키는 것을 증명하여 입증된다. 따라서 본고를 읽을 때 표적치료제 적용 전 비소세포폐암 치료의 표준 요법이었던 백금 기반 2제 요법 1차 치료의 무진행 생존 기간의 중앙값은 대략 5개월, 전체 생존 기간의 중앙값은 대략 10개월 정도임을 참고하여 비교하면 도움이 될 것이다. 또한 이후 언급되는 무진행 생존 기간과 전체 생존 기간의 값은 모두 중앙값임을 밝혀둔다.
본 론
EGFR 표적 치료
EGFR 돌연변이
EGFR은 HER 또는 erbB family라고도 불리는 티로신키나아제 수용체 그룹의 일부로, erbB family에는 EGFR(HER1/ErbB1), HER2 (ErbB2), HER3 (ErbB3) 그리고 HER4(ErbB4)가 포함된다. EGFR의 돌연변이는 비소세포폐암 중비편평세포암, 특히 선암에서 주로 발견되고 아시아인의 경우 비편평세포암 중 약 50%, 서양인의 경우 약 20% 정도에서 발견된다[4]. 돌연변이는 EGFR의 티로신 키나아제 도메인에 발생하여 EGFR 키나아제의 활성을 증가시키고, 이는 세포 신호전달 체계를 지속적으로 활성화시켜 세포의 분화와 성장이 계속되도록 한다. EGFR 돌연변이는 엑손 18번부터 엑손 21번 사이에서 일어나는데, 가장 흔한 EGFR 돌연변이는 엑손 19번의 결손 또는 엑손 21번의 점 돌연변이로 발생하는 L858R 돌연변이로서 이 두 돌연변이가 전체 EGFR 돌연변이의 90%가량을 차지하며, 표적치료제에 효과가 좋기 때문에 EGFR sensitive (감수성) 돌연변이라고 부르기도 한다[5]. EGFR을 통한 신호전달 체계가 활성화되기 위해서는 ATP가 필요한데, EGFR 표적치료제는 ATP의 결합 부위에 대신 결합하여 작용하여 효과를 나타낸다. 따라서 완치를 목적으로 한 치료를 하기 어려운 진행성 비소세포폐암, 특히 비편평세포암의 경우에는 진단과 동시에 종양의 조직에서 EGFR 유전자 돌연변이 검사를 시행해야 한다. 국내에서는 PNA clamping PCR method를 이용한 검사를 가장 많이 사용하고 있으며, 최근에는 차세대염기서열분석법을 기반으로한 유전자 패널 검사를 사용하기도 한다. 또한 조직이 불충분하거나 추가 조직 검사가 어려운 경우 혈액을 이용하여 혈액 내 순환 암세포(circulating tumor)의 DNA를 추출하여 EGFR 돌연변이 유무를 검사할 수 있다[6].
1세대, 2세대 EGFR 표적치료제
1세대 EGFR 억제제는 ATP 결합 부위에 경쟁적, 가역적으로 결합하는 약제이다. 이 약제는 돌연변이가 없는 EGFR보다 돌연변이를 동반한 EGFR의 ATP 결합 부위에 ATP보다 결합력이 높아 EGFR 신호전달체계의 활성화를 막는다. 1세대 약제로는 경구 약제인 gefitinib과 erlotinib이 있다. 처음에 두 약제의 임상시험은 EGFR 돌연변이 여부와는 상관없이, 진행된 비소세포폐암에서 최적의 보존 치료 대비 효과를 확인하기 위해 진행되었다[7,8]. 두 연구에서 생존 기간의 향상을 입증하지 못하였으나 여성, 선암, 비흡연자, 동아시아 인종, EGFR 유전자의 돌연변이가 있는 경우 효과를 보이는 특징이 확인되었다. 이에 암 조직에 EGFR 감수성 돌연변이인 엑손 19번 결손과 21번 L858R 돌연변이가 있는 비소세포폐암 환자만을 대상으로 글로벌 3상 임상시험들이 진행되었다. 표준 치료인 백금계열 약제를 포함한 2제 세포독성항암제조합 대비 gefitinib 또는 erlotinib의 효과를 확인하고자 하였던 네 개의 3상 임상연구에서 백금 조합 2제의 반응률이 15-36%였던 것에 비해 gefitinib과 erlotinib에서는 58-73%로보다 좋은 반응률을 보였고, 무진행 생존 기간이 백금 조합 2제가 약 4.6-6.3개월이었던 것에 비해 gefitinib 또는 erlotinib은 9.7-13.1개월로 무진행 생존 기간의 연장을 확인할 수 있었다[9-13]. 이것은 gefitinib 또는 erlotinib 복용이 백금 조합 2제에 비해 종양의 크기를 줄여주는 효과가 더 클 뿐만 아니라 종양이 다시 악화될 때까지 걸리는 시간을 연장시켰다는 의미이다. 전체 생존 기간에 있어서는 두 군에서 차이를 보이지 않았는데, 그 이유는 백금 조합 2제를 투약받은 그룹에서 질병의 악화가 발생한 경우, 대부분 gefitinib이나 erlotinib으로 교차투여(cross-over) 되었기 때문이다. 하지만 전체 생존 기간이 짧게는 19.3개월에서 길게는 30.9개월로 보고되어, 진행된 비소세포폐암 4기 환자임에도 EGFR 감수성 돌연변이가 있는 환자에서는 중앙 생존 기간이 2년이 넘게 되는 발전을 이루게 되었다. 또한 이 약제들은 세포독성 항암제와는 다른 부작용이 발생하는데, 세포독성 항암제에서는 구토, 골수기능 억제, 신장 기능 악화 등이 부작용으로 나타나는 반면에 표적치료제에서는 피부 발진, 설사 등이 대부분이며, 상당 부분 조절 가능하여 고령이거나 전신 상태가 비교적 좋지 않은 환자에서도 투약이 가능하고 좋은 효과를 기대할 수 있게 되었다.
뒤이어 2세대 EGFR 억제제로 언급되는 afatinib과 dacomitinib이 개발되었다. Afatinib과 dacomitinib은 ATP 결합 부위에 비가역적으로 결합하여 작용하고, erbB family에 포함된 다른 EGFR에도 작용을 한다는 차이점이 있다[14,15]. Afatinib 역시 EGFR 감수성 돌연변이가 있는 환자에서 백금 조합 2제 대비 afatinib의 효과에 대해 2상, 3상 임상시험을 진행하였고, 무진행 생존 기간 11개월로 백금 조합 2제 요법이 5-7개월을 보인 것에 비해 좋은 결과를 보였다. 전체 생존 기간은 각각 23, 28개월로 이 역시 교차투여로 인해 두 군 간의 차이를 나타내지는 않았으나 전체적인 생존 기간의 향상을 확인할 수 있었으며, 특히 엑손 19번 결손을 가진 환자에서 더욱 뚜렷하였다[16-18]. 1차 요법으로서 1세대 치료제인 gefitinib과의 비교에서는 전체 생존 기간의 차이는 없었지만 무진행 생존 기간의 이득이 있었다[19]. Dacomitinib도 1차 요법으로 gefitinib과 비교한 3상 연구에서 무진행 생존 기간의 연장을 보고하였다[20]. 따라서 현재 4기 비소세포폐암, 특히 선암을 비롯한 비편평세포암으로 진단될 경우 EGFR 돌연변이 유무를 반드시 먼저 확인해야 하며, 그중 EGFR 감수성 돌연변이가 있는 4기 비소 세포폐암에서는 1차 요법으로 EGFR 표적치료제를 반드시 우선 사용해야 한다. 단, 비소세포폐암 중 편평세포암으로 진단되는 경우 EGFR의 돌연변이 비율이 5% 이내로 적고[21], 표적치료제의 효과가 선암에서처럼 크지 않으므로 편평세포암에서는 모든 환자에서 반드시 검사할 것을 권고하지는 않는다[22-24].
1세대, 2세대 EGFR 표적 치료의 저항기전
비록 EGFR 감수성 돌연변이를 가진 일부 환자에 해당되기는 하나, EGFR 표적치료제는 이전의 표준 치료였던 백금기반 2제 요법에 비해 좋은 치료 반응률을 보이고 무진행 생존 기간을 연장시켰으며, 이 영향으로 전체 생존 기간도 연장되었다. 그러나 결국 치료 약제에 대한 내성으로 질병의 악화가 발생한다는 점은 많은 연구자들에게 해결해야 할 중요한 도전 과제로 여겨졌고, 이와 동시에 종양의 분자유전학적 기전에 대한 연구가 크게 발전하면서 1세대, 2세대 EGFR 표적치료제 치료 후 발생하는 내성 기전에 대한 많은 연구가 진행되었다. 대표적인 내성 기전으로는 EGFR의 엑손 20번에서 새로운 돌연변이인 T790M의 발현[25], MET oncogene의 증폭[26], AXL 활성화[27], HER2 증폭[28], PIK3CA 신호전달체계의 활성화[29], 소세포암으로의 조직형 변화[30] 등 다양한 기전들이 제시되고 있다. 이 중에서도 T790M 돌연변이는 엑손 20번의 790번 자리에서 theronine이 methionine으로 치환되면서 새롭게 발생하는 EGFR 돌연변이로 1세대, 2세대 EGFR 표적체료제 내성 원인의 약 50% 정도로 보고된다. 다양한 내성 기전 중 가장 큰 비중을 차지하는 내성 기전으로서 T790M 돌연변이를 표적으로 한 약제의 개발이 이어지게 되었고, 이러한 약제에는 현재 3세대 EGFR 표적치료제로 불리며 사용 중인 osimertinib이 있다.
3세대 EGFR 표적치료제
Osimertinib은 기존의 EGFR 감수성 돌연변이뿐만 아니라 T790M 돌연변이까지 타겟으로 하는 약제이다[31]. 경구 제제이며 야생형 EGFR에 대해서는 1세대, 2세대 치료제보다 비교적 약한 활성도를 보인다. 1세대 EGFR 표적치료제에 악화를 보인 EGFR 돌연변이 환자들을 대상으로 시행한 1, 2상임상시험인 AURA 연구에서 T790M 돌연변이가 있는 환자에서는 61%의 반응률을 보였고, T790M 돌연변이가 없는 환자에서는 21%의 반응률을 보였다[32]. EGFR 표적치료제에 악화를 보인 T790M 돌연변이가 확인된 환자만을 대상으로 진행한 2상 임상시험인 AURA2 연구에서는 반응률 70%, 질병조절률 92%, 무진행 생존 기간 9.9개월[33], 3상 임상시험인 AURA3에서는 백금 기반 2제요법 대비 유의하게 좋은 반응률(osimertinib군 71% vs. 백금 기반 2제요법군 31%)과 무진행 생존 기간(osimertinib군 10.1개월 vs. 백금 기반 2제요법군 4.4개월)을 보이면서 osimertinib은 이전의 EGFR 표적 치료에 악화를 보이며 T790M 돌연변이가 발생한 환자의 표준 치료로 자리잡게 되었다[34]. 따라서 1차 치료로 1세대, 2세대 EGFR 표적치료제 치료 이후 암이 악화되면 T790M 돌연변이 유무에 대한 검사가 필요하다. T790M 돌연변이 발생의 확인은 악화된 부분에 대한 재조직 검사를 통하여 시행하는 것이 표준적이나, 폐암의 경우 암의 위치에 따라 조직 검사가 어렵거나 위험하고 충분한 조직을 얻지 못하는 경우가 있으며, 암 조직을 구성하는 세포의 다양성으로 같은 환자에서도 암 조직의 위치에 따라 유전자 변이 결과가 다를 수 있기 때문에 혈장 내 순환 암세포의 DNA를 검사하는 것에 대한 필요성이 꾸준히 제기되어 왔다[35,36]. AURA2, AURA3 임상시험에서는 조직뿐만 아니라 혈액을 이용하여 혈장 내 순환 암세포 DNA에서도 T790M 확인을 위한 검사를 시행하였으며, 조직에서 T790M 돌연변이가 확인된 그룹과 혈액에서 T790M 돌연변이가 확인된 그룹 모두에서 osimertinib에 대한 효과가 비슷하게 나와 재조직 검사가 어려운 환자에서는 혈액을 이용한 T790M 돌연변이 검사도 적용 가능하다[37,38].
Osimertinib은 EGFR 감수성 돌연변이도 표적으로 하기 때문에 1차 요법 실패 이후가 아닌 1차 치료부터 사용 시에 1세대 표적치료제와의 효과 비교에 대한 임상시험 역시 진행되었다. EGFR 감수성 돌연변이가 있는 환자를 대상으로 1차 치료로 1세대 치료제인 gefitinib 또는 erlotinib 대비 osimertinib의 효과에 대한 임상시험인 FLAURA 연구 결과에서는 무진행 생존기간이 osimertinib 그룹의 경우 18.9개월, 1세대 치료제 그룹이 10.2개월이었으며[39], 전체 생존 기간은 osimertinib 그룹이 38.6개월, 1세대 표적치료제 그룹이 31.8개월(위험도 0.80; 95% CI, 0.64-1.00; p= 0.046)로 발표되었다[40]. 아직은 장기간 추적한 결과와 하위그룹에 대한 분석 등이 필요하지만, 현재 임상진료 현장에서는 EGFR 감수성 돌연변이가 동반된 비소세포폐암 4기 환자에서는 1, 2, 3세대 EGFR 표적치료제 중 하나를 치료제로 사용할 수 있고 1세대, 2세대 표적치료제를 1차 치료로 사용하였을 경우에는 악화 시에 종양 재조직 검사나 혈장 검사를 통해 T790M 돌연변이가 확인될 경우 3차 표적치료제인 osimertinib으로 치료한다. 1차 치료로 osimertinib을 사용하였을 경우에는 악화 시 추가적인 표적 치료는 가능하지 않아 세포독성 항암제 치료를 진행하게 된다.
ALK 표적 치료
ALK 변이
비소세포성 폐암 환자의 약 5%에서는 anaplastic lymphoma kinase (ALK) 재배열(rearrangement) 또는 융합(fusion)이 발견된다[41]. ALK 유전자의 변이는 3가지; 1) 재배열(rearrangement), 2) 증폭(amplification), 3) 점 돌연변이(point mutation)로 나타난다. 대부분의 변이는 전좌(translocation)로 인해 융합 유전자(fusion gene)가 만들어지는 방식이며, 1994년도에 역형성 대세포 림프종(anaplastic large cell lymphoma)에서 NPM1에 융합되는 것이 처음 확인되었다. 이후 거대 미만성 B세포 림프종, 식도 편평상피세포암, 대장암, 유방암 등에서 ALK 유전자의 재배열이 발생하는 것이 확인되었고 NSCLC에서의 ALK 돌연변이는 2007년에 EML4과 ALK의 재배열로 인해 세포의 증식과 생존을 증가시키는 경로의 신호를 활성화시키는 발암성(oncogenic) 티로신 키나아제가 생성되는 것이 처음 알려졌다[42]. 이후 현재까지 EML4, KIF5B, KLC1 그리고 TPR을 포함하는 19개 이상의 ALK 퓨전 파트너가 발견되었다[43]. 그중 가장 많은 퓨전 파트너는 echinoderm microtubule-associated protein-like 4 (EML4)이다. EML4-ALK 융합 유전자는 비소세포폐암 치료의 새로운 분자 표적이 되었으며, 여러 연구에서 ALK 티로신 키나아제 억제제를 투여하였을 때 빠르게 발암성 활동이 감소하는 것을 확인하였다[42]. ALK 재배열은 젊은 나이 및 비흡연자 또는 가벼운 흡연자에서 선암이 진단된 경우에 더 빈번한 것으로 알려져 있으며, 몇몇 연구에서 ALK 양성 비소세포성 폐암 환자의 나이가 평균 55세이며, 약 70% 정도가 비흡연자라고 보고하였다. ALK 양성은 전 세계적으로 남녀 비율이 비슷하게 나타난다[41,44].
ALK 재배열을 진단하는 방법은 4종류로 형광동소부합법(fluorescence in situ hybridization, FISH), 면역조직화학(immunohistochemical, IHC), 역전사 중합효소연쇄반응(reverse transcriptase-PCR, RT-PCR) 그리고 NGS이다. 그중 FISH는 2015년 6월 미국 Food and Drug Administration (FDA)에서 최초로 승인된 검사 방법으로 ALK 재배열을 확인하는 표준(gold standard) 검사법이다[45]. 또한 고감도 ALK 진단 항체를 사용하는 면역조직화학 검사법은 ALK 억제제의 표적이 되는 ALK 단백질을 직접 탐지할 수 있다는 점과 함께 낮은 비용, 짧은 처리 기간 및 쉬운 조작이라는 장점을 가지고 있어 또다른 표준 검사법으로 인정되고 있다[43].
1세대 ALK 표적치료제
ALK 재배열이 비소세포폐암에서의 새로운 표적 치료의 대상이 되면서, crizotinib이 1세대 ALK 억제제로 처음 개발되었다. Crizotinib은 MET, ALK 및 ROS1에 대한 다표적 티로신 키나아제로 2011년에 전이성 비소세포폐암에 대한 치료제로 미국 FDA의 승인을 받았다[46,47]. Crizotinib은 원래 c-MET을 표적으로 하는 약제로 개발되었다. 그러나 c-MET 외에도 ALK와 ROS1 등 다른 티로신 키나아제 수용체를 효과적으로 억제하는 것이 밝혀졌다. 이후 ALK 변이에 대한 검사법이 개발되어 ALK 변이 양성인 비소세포폐암 환자 2명에게 최초로 투여되었고, 질병의 호전이 관찰되며 그 유효성이 입증되었다[44]. 이후 ALK 양성인 진행성 비소세포폐암 환자 82명을 대상으로 한 1, 2상 연구가 진행되었다. 이 환자들은 모두 1가지 이상의 표준항암화학요법을 받은 이후 연구에 참여하였다. 이 PROFILE 1001 연구에서 crizotinib의 반응률은 57% (47명 중 16명이 부분관해, 1명이 완전관해) 이상이며, 질병 조절률(disease control rate)은 90%를 넘는 것이 확인되었다[48]. 또한, 무진행 생존 기간은 9개월이 넘으며, 투약 1년 후 전체 생존율은 75%에 달하였다[46]. 이에 비해 기존 표준항암화학요법으로 치료받은 환자들의 무진행 생존 기간은 2-3개월에 불과하였으며, 반응률도 10% 이하였다[49]. 이후 진행된 단일군 2상 연구(PROFILE 1005)에서도 crizotinib의 치료 효과는 비슷하게 나타났다. 2017년 발표된 바에 따르면 1,066명의 진행성 비소세포폐암 환자에서 crizotinib의 총 반응률은 54% (95% CI, 51-57)이며, 무진행 생존 기간은 8.4개월(95% CI, 7.1-9.7), 전체 생존 기간은 21.8개월(95% CI, 19.4-24.0)로 확인되었다[50]. 이를 계기로 crizotinib은 ALK 변이 양성인 진행성 비소세포폐암의 1차 치료제로 권고되었다. 이후 진행된 2가지 다국적 3상 연구에 대해서 살펴보면 첫 번째로 2013년도에 발표된 2차 치료에서 crizotinib vs. pemetrexed와 cisplatin 또는 carboplatin 병합요법 연구(PROFILE1007)에서도 crizotinib 치료는 훨씬 더 긴 무진행 생존 기간(7.7개월 vs. 3.0개월; 위험도, 0.49; 95% CI, 0.37-0.64, p< 0.001) 및 치료 반응률(65% vs. 20%)을 보여주었다[51]. 뒤이어 2014년도에 발표된 PROFILE 1014 연구는 1차 치료에서 crizotinib vs. 항암요법의 효과를 비교한 다국적 3상 연구로, crizotinib 사용군이 표준항암요법인 pemetrexed와 cisplatin 병합요법보다 유의한 무진행 생존 기간의 연장(10.9개월 vs. 7.0개월; 위험도, 0.45; 95% CI, 0.35-0.60; p< 0.001)과 우월한 치료 반응률(74% vs. 45%)을 보여주었다[52]. PROFILE 연구로 인해 종양유전자에 대한 임상연구와 표적 치료의 중요성과 긍정적인 측면을 다시금 확인하게 되었다.
2세대 ALK 표적치료제
1세대 ALK 표적치료제인 crizotinib의 우월한 치료 성적에도 불구하고, 대부분의 환자는 치료 시작 1-2년 사이에 이에 대한 내성이 발생하며 질병이 진행하게 된다. 내성이 생기는 기전은 크게 다음과 같이 분류할 수 있다. 1) 중추신경계 전이병변에 대한 낮은 반응, 2) 내성 돌연변이의 획득, 3) 우회로(bypass track)의 발달, 4) 조직학적 변형이다. 이러한 내성을 극복하고 다음 치료 효과를 기대하기 위해 2세대 표적치료제가 개발되었다.
2세대 ALK 표적치료제로는 ceritinib과 alectinib, brigatinib을 칭하는데, crizotinib과 비교하여 보다 강력하고 선택적으로 ALK를 억제하며, 혈액 뇌장벽(blood-brain barrier) 통과를 잘하여 중추신경계로 약물 전달이 잘되는 이점이 있다. ALK 변이양성 비소세포폐암 환자의 1차 요법으로 ceritinib의 경우 crizotinib과 head-to-head 연구는 없으나, 백금 조합 2제 대비 ceritinib의 효과에 대한 3상 연구(ASCEND-4)에서 ceritinib의 반응률(72.5% vs. 26.7%)과 무진행 생존 기간(16.6개월 vs. 8.1개월, 위험도 0.55)이 우월함이 밝혀졌다[53]. Crizotinib과 alectinib을 head-to-head로 비교한 연구인 ALEX III 연구에서는 전체 생존 기간에 대해서는 아직 발표되지 않았으나 무진행 생존 기간 34.8개월 vs. 10.9개월(위험도 0.43)로 나타나 1차 요법으로 crizotinib보다 alectinib의 우월함을 입증하였다[54]. 또한 brigatinib도 1차 요법으로 crizotinib과 효과를 비교한 임상시험도 발표되었는데, brigatinib은 무진행 생존 기간이 중앙값에 도달하지 않았지만, crizotinib은 무진행 생존 기간의 중앙값이 9.8개월, 위험도 0.49로 brigatinib 역시 1차 요법으로 crizotinib보다 좋은 결과를 보였다[55]. 이러한 결과를 바탕으로 NCCN 가이드라인에서는 ALK 양성 비소세포폐암의 1차 치료로 alectinib을 category 1로 권고하고 있으며, 그 외 brigatinib, ceritinib도 권고하고 있다. Crizotinib은 2세대 ALK 표적 치료에 비해 중추신경계 전이에 효과가 떨어지므로, 중추신경계 전이가 있을 경우에는 1차 요법으로 crizotinib보다는 alectinib, ceritinib, brigatinib을 추천한다. 현재 우리나라에서는 1차 이상의 치료에서 crizotinib, alectinib, ceritinib이 급여 인정되고 있다.
3세대 ALK 표적치료제
Loratinib은 3세대 ALK 표적치료제로 개발되었으며, ALK와 ROS1 티로신 키나아제를 표적으로 작용한다. 중추신경계를 통과하는 데 좋은 효과를 보이며 1, 2세대 ALK 표적치료제 이후에 발생할 수 있는 ALK 내성 돌연변이를 광범위하게 억제하는 효과가 있다. 1상 연구에서 ALK 표적 치료가 선행된 비소세포폐암 중 주로 중추신경계 전이를 동반한 환자를 대상으로 효과가 관찰되었고, 2상 연구에서 ALK 또는 ROS1 양성 비소세포폐암 환자를 대상으로 1차 치료군, crizotinib 선행군, 2세대 ALK 표적치료제 선행군, 2가지 이상의 ALK 표적 치료 선행군, ROS1 양성군 모두에서 전반적인 치료 효과를 보였으며, 두개 내 병변에 대해서도 치료 효과를 보였다. 이러한 결과는 초치료군부터 3가지 이상의 ALK 표적치료제 선행군까지 모두에서 나타났다[56]. 이를 바탕으로 NCCN 가이드라인에서는 lorlatinib을 ALK 표적치료제 이후 진행된 경우에서의 사용을 category 2B로 권고하고 있다.
ROS1 표적 치료
ROS1 변이
ROS1 (receptor tyrosine kinase 1) 재배열(rearrangement)은 전체 폐암의 약 1-2%에서 발견되는 변이이다. ALK 재배열과 유사하게 ROS1 재배열도 비교적 젊은 나이의 비흡연자 또는 가벼운 흡연자에서 잘 나타나는 것으로 알려졌다. ROS1 유전자 융합은 교모세포종(glioblastoma) 세포에서 맨 처음 확인되었으며, 2007년에 처음으로 비소세포폐암에서 그 역할이 밝혀졌다[57]. 그 외에도 난소암, 염증성 근섬유 아세포 종양(inflammatory myofibroblastic tumor), 담관암, 위암, 혈관육종 등에서 확인된 바 있다. ROS1 재배열은 ALK 재배열과 유사점이 많지만 모든 임상병리학적 특징이 공유되는 것은 아니다[58]. 그 예로 한 연구에서는 ROS1 재배열이 있는 비소세포 폐암 환자군에서는 원격 전이 및 뇌 내 전이 발생률이 더 낮다고 발표하였다[59]. ROS1 재배열의 진단은 ALK와 비슷하게 FISH, IHC, RT-PCR와 NGS 방법을 사용한다. FISH가 표준 검사법이나 IHC는 상대적으로 더 빠른 결과를 얻을 수 있고, 비용 측면에서 경제적이라 대체 검사법으로 고려되나 상대적으로 낮은 특이도를 보여, 추가적인 확진 방법이 필요할 수 있다는 것이 단점이다. 또한 RT-PCR은 유전자 변이 중 새로운 융합은 확인이 어려운 단점이 있다.
ROS1 표적치료제
ROS1의 역할이 비소세포폐암에서 밝혀진 후, ROS1이 비소세포폐암 치료의 표적으로 확인되며, 1상 연구(PROFILE 1001)에서 다표적 MET/ALK/ROS1 억제제인 crizotinib의 ROS1에 대한 치료 효과를 확인하였다[60]. 이 연구에서 ROS1 양성 비소세포폐암에서의 crizotinib의 치료 반응률은 72%, 무진행 생존 기간의 중앙값은 19.2개월, 전체 생존 기간의 중앙값은 51.4개월이었다. 또한 ROS1/NTRK/ALK 티로신키나아제 억제제인 entrectinib도 STARTRK-2 연구에서 ROS1 재배열이 있는 코호트에서 반응률 77.4%, 무진행 생존기간 26.3개월로 보고되었다[61]. 이를 바탕으로 ROS1 양성 비소세포폐암의 치료제로 crizotinib과 entrectinib이 FDA 허가를 받았고, ROS1 양성 비소세포폐암의 초치료로 권고된다. 이외에도 ceritinib, loratinib 등 여러 다른 약제들의 임상시험이 진행되어 발표되고 있다[62,63].
BRAF 표적 치료
BRAF는 serine/threonine 키나아제로 MAP/ERK 신호 경로의 일부이다. BRAF 키나아제는 EGFR이 활성화된 후, 세포 내 신호 전달 과정의 핵심 역할을 한다. 이 BRAF에 변이가 일어나면 세포의 성장과 조절을 통제하는 MAPK 경로를 통해 조절되지 않는 신호를 유발하게 된다. BRAF 변이는 전체 암종의 약 9%에서 관찰되며 그중 valine (V)이 아미노산 600에서 glutamic acid (E)로 치환된 돌연변이인 V600E가 대표적으로 비소세포폐암에서는 약 3%에서 BRAF 변이가 관찰되며, 그중 V600E는 약 50%를 차지하고 나머지 절반은 V600E 외 변이이다. 또한 비소세포폐암 중 선암에서 나타나는 BRAF 변이의 경우 EGFR이나 ALK 변이와 달리 현재 흡연 중이거나, 흡연력이 있는 경우에 나타나는 것이 대부분이며 다른 변이에 비해 무진행 생존 기간 및 전체 생존 기간이 짧은 것으로 나타났다[64]. NCCN 가이드라인에서는 비소세포폐암에서 BRAF 변이 검사를 진행하도록 권고하고 있으며 V600E 변이가 확인될 경우 BRAF/MEK 억제제 사용을 권고한다. BRAF를 표적으로 하는 dabrafenib 단독요법 2상 연구에서 기존 치료가 선행된 BRAF V600E 변이 양성 비소세포폐암을 대상으로 치료 반응률은 33%였으며 무진행 생존 기간은 5.5개월로 나타났다. 초치료를 받지 않았던 환자군의 치료 반응률은 약 66%였다[65]. Vemurafenib 단독요법에 대한 2상 연구에서도 치료 반응률은 42%, 무진행 생존 기간은 7.3개월로 비슷한 결과를 보였다[66]. Dabrafenib과 trametinib 병용요법의 경우, 초치료군에서의 치료 반응률은 64%, 무진행 생존 기간은 14.6개월이었으며 2차 이상의 치료에서는 치료 반응률은 약 63%, 무진행 생존 기간은 9.7개월로 나타났다[67]. 병용요법이 단독요법에 비해 치료 관련 부작용이 높기는 하나, 보다 좋은 치료 성적을 보여 NCCN 가이드라인은 BRAF V600E 변이 양성 치료에서 dabrafenib과 trametinib 병용요법을 우선 권고하고 있으며, 병용요법을 견딜 수 없는 경우 단독요법을 하도록 하고 있다.
기타 표적 치료
MET (hepatocyte growth factor receptor)
MET 증폭(amplification)은 약 3%의 폐암에서 확인되는 것으로 알려진 변이이다. MET이 비소세포폐암의 발현에 공동역할(co-driver)을 할 가능성이 높으며, EGFR과 관련이 있음이 알려졌다. MET 경로에 대한 표적 치료와 MET 증폭이 있는 비소세포폐암을 대상으로 한 그 동안의 연구에서는 유효한 효과가 입증되지 않았으나, 최근 엑손 14번 변경 및 증폭에 초점을 맞추게 되며 crizotinib, capmatinib, tepotinib 등의 의미있는 결과들이 도출되고 있다[68-71]. 또한 EGFR 변이 표적치료 과정에서 T790M 변이가 발생하며 내성이 생기게 되는데, 이때 우회로로 MET 경로가 활성화된다. 따라서 EGFR TKI 및 MET 억제제 병합요법의 필요성이 대두되었고 최적의 사용을 위한 기준을 확인하는 연구가 진행 중이다[72,73].
RET
RET 유전자의 융합은 많은 종류의 암종에서 확인되며, 갑상선암의 10-20%, 폐암의 1-2%에서 확인된다. RET 유전자변이도 발암 기전에서 중요한 역할을 하기 때문에 RET 표적치료에 대한 효과를 확인하는 연구들이 이어졌다. 주로 다표적 티로신 키나아제 억제제가 RET 변이가 있는 암에 사용되었으나, 효과는 기대하였던 만큼 좋지 않았다. Selpercatinib은 강력한 선택적 RET 억제제로 1상 연구에서 다표적 키나아제 억제제보다 우월한 효과와 안전성을 입증하였고, 이후 RET 변이가 있는 갑상선 수질암 환자와 뇌전이를 동반한 폐암 환자에게 약물을 투여한 결과가 발표되었다. 이 환자들은 특히, 이전 치료에서 다표적 키나아제 억제제를 많이 사용하였던 병력에도 불구하고 극적인 치료 효과를 보이면서 selpercatinib과 BLU-667을 투여하는 RET 표적 치료에 대한 기대가 높아지고 있다[74].
NTRK
신경영양 수용체 티로신 키나아제(NTRK) 유전자 NTRK1, NTRK2, NTRK3는 각각 tropomyosin receptor kinase (TRK) 단백질인 TRKA, TRKB, TRKC를 인코딩한다. TRK 융합이 일어나게 되면 종양유전자 중독을 초래하며 전체 고형암의 약 1%에서 연관이 있다고 알려졌다. Larotrectinib은 세 가지 TRK 단백질에 선택적으로 작용하는 강한 소분자 억제제로 2015년 처음으로 환자 치료에 이용되기 시작하였으며, 미국에서 2017년까지 모든 연령 및 종양 유형의 환자를 포함하는 개발 프로그램이 진행되었다. 이 연구에 총 55명의 TRK 융합 양성의 고형암 환자가 등록되었고, 그중 폐암 환자는 7%를 차지하였다. Larotrectinib의 치료 반응률은 75%에 달하였고, 반응이 지속적으로 유지되는 현상이 관찰되었다[75]. 또한 NTRK 융합이 있는 고형암 환자를 대상으로 entrectinib의 효과를 시험한 3개의 1, 2상 임상시험의 종합 분석에서도 전체 환자의 치료 반응률은 57%였으며, 그중 전체 환자의 19%에 해당하였던 비소세포폐암 환자의 치료 반응률은 70%에 달하여 향후 후속 연구 결과가 기대된다[76,77].
HER2 (또는 ERBB2)
HER2 유전자 증폭(amplification)은 유방암에서의 발현이 가장 잘 알려져 있으며, 이에 대한 표적치료제인 trastuzumab은 널리 알려진 표준치료제이다. HER2 증폭은 위암에서도 발견되며, 표적 치료의 효과 역시 입증되어 위암에서도 중요한 치료제로 사용된다. 이와 마찬가지로 비소세포폐암 중 선암에서도 HER2 유전자 이상(증폭 및 변이)이 2-6%에서 발암기전으로 작용하는 것이 확인되었다. HER2는 ErbB/HER 패밀리의 티로신 키나아제에 속하며 EGFR 같은 다른 패밀리 구성원과 결합하며 하부 신호를 활성화한다. 이렇듯 EGFR 내성 발생기전에 HER2가 밀접한 관련이 있다는 것이 알려지며, 비소세포폐암의 치료에 HER2 유전자 이상이 새로운 목표가 되는 연구가 진행되었다. HER2 표적치료제인 trastuzumab emtansine(T-DM1)으로 진행한 2상 연구에서 부분 관해율은 44%, 무진행 생존 기간은 5개월로 나타났다. 이는 폐암에서 HER2 표적 치료의 긍정적 효과를 확인한 첫 번째 연구가 되었다[78]. 이를 바탕으로 NCCN 가이드라인에서 T-DM1이 HER2 유전자 변이가 확인된 경우, 사용 가능하다고 소개가 되어 있으나 아직 한국에서 허가되어 있지는 않다.
결 론
이처럼 비소세포폐암 치료에서 사용할 수 있는 표적치료제의 종류와 치료 적용 범위는 지속적으로 늘어나고 있다. 이와 동시에, 발암과 관련된 분자 유전학적 기전 연구 및 유전자 변이를 표적으로 하는 치료제 개발이 지속적으로 이뤄지고 있고, 약제의 개발과 동시에 기존의 치료제에 대한 내성 기전 및 이를 극복하기 위한 연구가 진행되고 있다. 이와 동시에 수많은 유전자 변이를 짧은 시간 안에 확인할 수 있는 방법, 유전자마다 가장 적절한 검사법, 실제 진료 현장에서 환자마다 최적의 치료법이 최단 시간 내에 적용될 수 있는 방법도 계속 발전하고 있다. 따라서 4기 비소세포폐암의 치료는 환자 개인별로 암이 가진 분자생물학적 특성을 고려한 섬세한 맞춤 치료로서, ‘생존 기간 향상’을 넘어, ‘완치’라는 목표에 보다 빠르게 다가갈 수 있을 것이다.