악성흉수의 진단과 치료
- 남해성, 류정선
Diagnosis and Management of Malignant Pleural Effusion
- Hae-Seong Nam, Jeong-Seon Ryu
- Abstract
-
Malignant pleural effusions (MPEs) are an important clinical problem in patients with neoplastic disease. They can occur as the initial presentation of cancer, a delayed complication in patients with previously diagnosed malignancies, or the first manifestation of cancer recurrence after therapy. Common cancer types causing MPEs include lymphomas, mesotheliomas, and carcinomas of the breast, lung, and ovaries. However, almost all tumor types have been reported to cause MPEs. Regardless of the etiology, the median survival from clinical recognition is 4 months. New imaging modalities assist the evaluation of patients with a suspected MPE. However cytologic or tissue confirmation of malignant cells is necessary to establish a diagnosis. Management of an MPE remains palliative. Managements are directed toward removing pleural fluids and when appropriate, performing pleurodesis or initiating long-term drainage to prevent fluid reaccumulation. Talc pleurodesis is still the choice of treatment although concerns about its safety remain. Several factors such as performance status, expected survival, lung re-expansion following pleural fluid drainage and co-morbidities should be considered before the treatment. (Korean J Med 2011;81:167-173)
- 서 론
- 서 론
악성흉수는 흉수에서 악성 세포가 발견되는 것으로 악성종양 환자에서 이환율의 중요한 원인이다. 악성흉수는 악성종양의 초기에 발현될 수 있으며, 악성종양의 합병증 또는 치료 후 재발의 징후로 발현될 수 있다. 악성흉수의 발생률에 관한 연구는 미비하나, 한 사후 부검 연구에서는 악성종양으로 사망한 환자의 15%에서 악성흉수가 발견되었다[1].악성종양 환자에서 흉수는 다양한 원인에 의하여 발생된다(Table 1) [2]. 일부 연구에서는 종양에 의한 혈관신생으로 혈관내피성장인자에 의한 혈관 투과성 증가와 액체의 혈관 누출에 의하여 흉수가 생성됨을 설명하고 있다[2,3]. 거의 모든 악성종양이 악성흉수의 원인이 될 수 있으나, 75% 이상의 악성흉수는 폐암, 유방암, 난소암, 림프종 등에 의하여 발생되며, 10% 내외에서는 원인 종양이 확인되지 않는 경우도 있다[2,4]. 악성흉수 환자의 예후는 불량하여 원인 종양 질환과 무관하게 중앙 생존 기간은 4개월로 알려져 있으며[5], 이와 같은 이유로 새로 개정된 폐암 TNM병기에서도 악성흉수는 M1a로 재분류되었다[6]. 악성흉수의 원인 질환에 따른 예후를 보면 폐암 환자가 가장 짧은 생존기간을 보였고 난소암 환자의 경우 생존기간이 길었으며, 원인이 불명확한 경우 중간 정도의 생존기간을 보였다[7,8]. 또한 Karnofsky performance scale 점수가 낮을수록, pH 7.20 미만, glucose 60 mg/dL 미만을 보일 경우 예후가 불량한 것으로 알려져 있다[5].본 특집에서는 최근 문헌고찰을 통하여 악성흉수 환자의 진단 및 치료에 대하여 정리하고자 한다.
- 악성흉수의 진단
- 악성흉수의 진단
- 임상양상
- 임상양상
- 영상의학적 검사
- 영상의학적 검사
대부분의 환자에서 흉부방사선 사진상 중등도 이상의 흉수 양(500-2,000 mL)을 보이며, 한 쪽 흉부 전체를 차지하는 대량 흉수의 원인질환은 대부분 악성종양인 경우가 흔하다[10]. 대량의 흉수는 “흉벽 측면에 흉수의 흔적이 있는 반달모양(meniscus) 징후, 반대측으로 종격동 이동, 횡격막의 역위” 등의 소견이 흉부방사선 사진에서 관찰될 수 있다[11].흉부 초음파 검사는 적은 양의 흉수(5 mL)를 발견할 수 있어 흉강천자와 흉관삽입을 위한 가장 좋은 위치를 아는 데 도움을 준다[12]. 악성흉수를 시사하는 초음파 소견으로는 “고체형의 흉막 밀도, 불규칙하거나 명확치 않은 경계를 지닌 저에코의 흉막비후, 종양이 흉막에서 이웃 장기로 침범” 등이 있다[9].- 흉수분석
- 흉수분석
흉부 영상의학기술의 발전에도 불구하고, 악성흉수를 확진하기 위해서는 흉수에서 세포학적 혹은 조직학적 검사에서 암세포를 확인하는 것이 필수적이다.원인 감별을 위해 흉수천자가 필요하며 진단적 흉수검사에서는 세포수와 백분율 산정(total cell count with differential), 화학검사(total protein, lactate dehydrogenase, pH, glucose, albumin 등), 세포학적 검사 등이 필요하다. 대부분의 악성흉수는 삼출액이지만 3-10%에서는 저알부민증, 간경화, 또는 만성 심부전 등과 같은 동반된 질환이 있는 경우에 여출액으로 나타날 수도 있다[15,16]. 악성흉수를 시사하는 특징을 표 2에 정리하였다. 흉수에서 암 표지자(carcinoembryonic antigen, carbohydrate antigens 15-3, 19-9, 549, neuron-specific enolase, squamous cell carcinoma antigen, cytokeratin 19 fragments 등)의 유용성에 대한 연구들에서 암 표지자의 평균치가 악성흉수에서 높았지만 양성과 악성을 구분하는 임계수준 전후에서 중복되는 경향이 있어서 확진을 위해서는 침습적인 검사가 필요할 것이다[2,17,18].- 흉막 조직검사
- 흉막 조직검사
악성흉수가 의심되지만 세포학적 검사가 음성일 때, 흉막 조직검사가 필요하다. 악성흉수를 진단하는 데 있어 세포학적 검사가 흉막 조직검사보다 더 민감하며, 흉막 조직검사의 진단율은 약 40-75%이다[20]. 영상 유도하에 시행되는 흉막 조직검사는 합병증을 줄일 수 있고 악성흉수를 진단함에 있어서 민감도(76-86%)와 특이도(100%)를 향상시킬 수 있으며, 5 mm의 두께의 적은 흉막액에서도 성공적으로 조직검사를 시행할 수 있는 장점이 있다[21].경직성 또는 반경직성 흉강경을 이용한 내과적 흉강경 검사와 비디오 흉강경 수술을 이용한 조직검사에서는 더 많은 조직을 정확히 얻을 수 있으며, 민감도를 90-100%로 향상시킬 수 있다[9,22]. 비디오 흉강경 수술의 높은 진단율에도 불구하고, 비악성 흉수에 대한 확진에 있어서는 덜 효과적이며, 침습적이고 전신마취가 필요하다는 단점이 있다. 따라서 삼출액 흉수가 있는 환자에서 임상적으로 악성흉수가 의심되는 경우 또는 한 달 이상 지속된 증상, 열이 없는 경우, 혈성 흉수, 악성을 암시하는 흉부 전산화 단층촬영 소견이 있는 경우 비디오 흉강경 검사를 고려하도록 추천하고 있다[23].
- 악성흉수의 치료
- 악성흉수의 치료
- 화학 흉막유착술
- 화학 흉막유착술
화학 흉막유착술은 화학물질을 이용하여 흉막에 염증, 섬유소 침착에 의한 유착을 초래하여 흉수의 재축적을 방지하여 호흡곤란을 호전시키고자 하는 방법이다[2,19]. 이런 흉막유착술은 흉수에 의한 호흡곤란 등 호흡기 증상이 있고, 2-3개월 이상의 기대수명, 전신항암치료에 반응하지 않는 악성흉수, 치료적 흉강천자 후 폐 확장 확인된 환자에서 시행한다[9].흉막유착술에 사용되는 약제인 경화제는 흉관 카테터 또는 흉강경 등을 이용하여 주입할 수 있으며, 경화제에 따라서 매우 다양한 치료 효율을 보인다(Table 4) [9]. 경화제의 안전성과 효과에 대한 연구들이 시행되었으나, 아직까지 적절하게 비교된 데이터가 부족하여 가장 이상적인 약제의 선택이라는 측면에서 논쟁의 소지가 있지만 talc가 악성흉수를 방지하는 데 가장 효과적인 약제로 알려져 있다[25,26].일반적으로 talc 사용에 따른 부작용은 호흡곤란, 열, 흉통, 폐렴, 부정맥, 무기폐, 급성호흡부전 등이 알려져 있으며, 가장 치명적인 급성호흡부전의 발생률은 약 1-9%로 보고된다[19,27]. 이런 급성호흡부전의 합병증은 talc 입자의 크기가 클수록 드물게 발생하는 것으로 알려져 있다[27]. 따라서, talc 흉막유착술에 의한 저산소증 등의 합병증을 줄이기 위해서 입자의 크기가 큰 것을 사용하도록 추천하고 있다[4]. 일부 세균의 생산물과 사이토카인 등의 치료 성적이 보고되고 있으나, 아직까지는 널리 사용되기에는 제한적이다(Table 4) [2,9,20].흉막유착술 시행 시 영국흉부학회(British Thoracic Society)에서는 다음과 같은 권고를 하고 있다[4]. 첫째, 악성흉수를 배액 또는 흉막유착술을 위하여 소구경(10-14Fr) 카테터를 사용 한다. 둘째, 리도카인(3 mg/kg; 최대용량 250 mg)은 경화제 주입 전에만 사용한다. 셋째, 시술 전 투약은 흉막유착술과 관련된 통증과 불안을 완화하기 위해서 고려한다. 넷째, 흉막유착술 약제 주입 후 환자를 여러 방향으로 회전 시킬 필요는 없다. 다섯째, 흉막유착술 약제 주입 후 1시간 동안 카테터를 잠근다. 여섯째, 흉막유착술 약재 주입 후 하루에 250 mL 이상의 배액이 없다면 24-48시간 내에 카테터를 제거한다.- 유치 흉막 카테터(indwelling pleural catheter)
- 유치 흉막 카테터(indwelling pleural catheter)
- 흉복막간 단락(pleuroperitoneal shunt)
- 흉복막간 단락(pleuroperitoneal shunt)
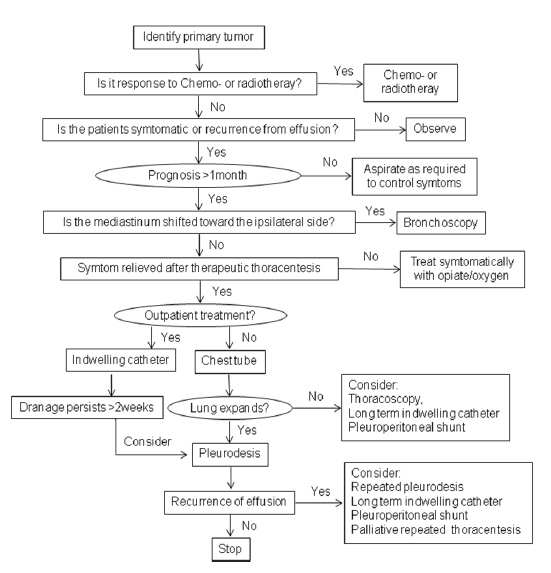
악성흉수에 대한 보존적 치료는 암 환자의 생존율을 향상시키지 못하기 때문에 원인이 되는 종양에 대한 치료가 중요하다. 흉수에 의한 호흡곤란과 같은 증상, 전반적인 건강상태, 수행능력, 기대수명 등을 종합적으로 고려하여 악성흉수에 대한 고식적 치료를 결정한다. 치료의 가장 중요한 목적은 흉수 제거와 재축적 방지를 통하여 호흡곤란 등의 증상을 완화시키는 것이다. 따라서 무증상이면서 원인이 되는 악성종양에 대한 치료가 가능한 환자에서는 경과관찰을 추천한다(Table 3, Fig. 1) [4].
- 결 론
- 결 론
악성흉수는 거의 모든 악성종양에서 발생할 수 있는 흔히 접하는 임상적 문제이다. 새로운 영상의학적 기법의 소개로 진단의 정확도가 향상되었으나, 확진을 위해서는 악성세포를 세포학적, 조직학적 검사를 통하여 확인하는 것이 필요하다. 환자의 전신상태와 원인 질환에 대한 평가 후 악성흉수에 대한 적절한 치료 방법을 선택하는 것이 중요하겠다(Table 3, Fig. 1). 최근 분자생물학의 발전과 조직학적 진단기술의 발전으로 기존 세포학적, 조직학적 검사의 진단율이 향상되고 있다. 향후 신속하고, 효과적인 진단 방법과 안전하고 효율적인 경화제의 개발이 필요할 것이다. 악성흉수 진단 후에는 보다 적극적인 치료적 중재를 통하여 환자 삶의 질을 향상시킬 수 있도록 노력하여야 하겠다.
Table 1.
Mechanisms by which malignant disease leads to pleural effusions [2]
Table 2.
Pleural fluid findings suggestive of malignant pleural effusion (MPE) [9]
Table 3.
Management options for malignant pleural effusions [30]
Table 4.
Available and investigational sclerosing agents for pleurodesis [9]
- References
- References
REFERENCES
1. Rodrîguez-Panadero F, Borderas Naranjo F, López Mejîas J. Pleural metastatic tumours and effusions: frequency and pathogenic mechanisms in a post-mortem series. Eur Respir J 1989;2:366–369.
[PubMed]2. Light RW. Pleural Diseases. 5th ed. Philadelphia: Lippincott Williams & Wilkins, 2007.3. Kraft A, Weindel K, Ochs A, et al. Vascular endothelial growth factor in the sera and effusions of patients with malignant and nonmalignant disease. Cancer 1999;85:178–187.
[Article] [PubMed]4. Roberts ME, Neville E, Berrisford RG, Antunes G, Ali NJ. Management of a malignant pleural effusion: British Thoracic Society Pleural Disease Guideline 2010. Thorax 2010;65(Suppl 2):ii32–ii40.
[Article] [PubMed]5. Heffner JE, Nietert PJ, Barbieri C. Pleural fluid pH as a predictor of survival for patients with malignant pleural effusions. Chest 2000;117:79–86.
[Article] [PubMed]6. Goldstraw P, Crowley J, Chansky K, et al. The IASLC lung cancer staging project: proposals for the revision of the TNM stage groupings in the forthcoming (seventh) edition of the TNM classification of malignant tumours. J Thorac Oncol 2007;2:706–714.
[Article] [PubMed]7. Abbruzzese JL, Abbruzzese MC, Hess KR, Raber MN, Lenzi R, Frost P. Unknown primary carcinoma: natural history and prognostic factors in 657 consecutive patients. J Clin Oncol 1994;12:1272–1280.
[PubMed]8. van de Molengraft FJ, Vooijs GP. Survival of patients with malignancy-associated effusions. Acta Cytol 1989;33:911–916.
[PubMed]9. Heffner JE, Klein JS. Recent advances in the diagnosis and management of malignant pleural effusions. Mayo Clin Proc 2008;83:235–250.
[Article] [PubMed]10. Maher GG, Berger HW. Massive pleural effusion: malignant and nonmalignant causes in 46 patients. Am Rev Respir Dis 1972;105:458–460.
[PubMed]11. Qureshi NR, Gleeson FV. Imaging of pleural disease. Clin Chest Med 2006;27:193–213.
[Article] [PubMed]12. Kocijancic I, Vidmar K, Ivanovi-Herceg Z. Chest sonography versus lateral decubitus radiography in the diagnosis of small pleural effusions. J Clin Ultrasound 2003;31:69–74.
[Article] [PubMed]13. Yilmaz U, Polat G, Sahin N, Soy O, Gülay U. CT in differential diagnosis of benign and malignant pleural disease. Monaldi Arch Chest Dis 2005;63:17–22.
[PubMed]14. Schaffler GJ, Wolf G, Schoellnast H, et al. Non-small cell lung cancer: evaluation of pleural abnormalities on CT scans with 18F FDG PET. Radiology 2004;231:858–865.
[Article] [PubMed]15. Porcel JM, Alvarez M, Salud A, Vives M. Should a cytologic study be ordered in transudative pleural effusions? Chest 1999;116:1836–1837.
[Article] [PubMed]16. Ryu JS, Ryu ST, Kim YS, Cho JH, Lee HL. What is the clinical significance of transudative malignant pleural effusion? Korean J Intern Med 2003;18:230–233.
[PubMed]17. Gaspar MJ, De Miguel J, Garcia Díaz JD, Díez M. Clinical utility of a combination of tumour markers in the diagnosis of malignant pleural effusions. Anticancer Res 2008;28:2947–2952.
[PubMed]18. Porcel JM, Vives M, Esquerda A, Salud A, Pérez B, Rodríguez-Panadero F. Use of a panel of tumor markers (carcinoembryonic antigen, cancer antigen 125, carbohydrate antigen 15-3, and cytokeratin 19 fragments) in pleural fluid for the differential diagnosis of benign and malignant effusions. Chest 2004;126:1757–1763.
[Article] [PubMed]19. Lombardi G, Zustovich F, Nicoletto MO, Donach M, Artioli G, Pastorelli D. Diagnosis and treatment of malignant pleural effusion: a systematic literature review and new approaches. Am J Clin Oncol 2010;33:420–423.
[Article] [PubMed]20. Antony VB, Loddenkemper R, Astoul P, et al. Management of malignant pleural effusions. Eur Respir J 2001;18:402–419.
[Article] [PubMed]21. Rahman NM, Gleeson FV. Image-guided pleural biopsy. Curr Opin Pulm Med 2008;14:331–336.
[Article] [PubMed]22. Maskell NA, Butland RJ. BTS guidelines for the investigation of a unilateral pleural effusion in adults. Thorax 2003;58(Suppl 2):ii8–ii17.
[Article] [PubMed] [PMC]23. Ferrer J, Roldan J, Teixidor J, Pallisa E, Gich I, Morell F. Predictors of pleural malignancy in patients with pleural effusion undergoing thoracoscopy. Chest 2005;127:1017–1022.
[Article] [PubMed]24. Antunes G, Neville E, Duffy J, Ali N. BTS guidelines for the management of malignant pleural effusions. Thorax 2003;58(Suppl 2):ii29–ii38.
[Article] [PubMed] [PMC]25. Shaw P, Agarwal R. Pleurodesis for malignant pleural effusions. Cochrane Database Syst Rev 2004;CD002916.
[Article] [PubMed]26. Tan C, Sedrakyan A, Browne J, Swift S, Treasure T. The evidence on the effectiveness of management for malignant pleural effusion: a systematic review. Eur J Cardiothorac Surg 2006;29:829–838.
[Article] [PubMed]27. Janssen JP, Collier G, Astoul P, et al. Safety of pleurodesis with talc poudrage in malignant pleural effusion: a prospective cohort study. Lancet 2007;369:1535–1539.
[Article] [PubMed]28. Pollak JS, Burdge CM, Rosenblatt M, Houston JP, Hwu WJ, Murren J. Treatment of malignant pleural effusions with tunneled long-term drainage catheters. J Vasc Interv Radiol 2001;12:201–208.
[Article] [PubMed]