žĄú Ž°†
Í≥†Ž†ĻŪôĒ ŽįŹ žīąÍ≥†Ž†ĻŪôĒ žā¨ŪöĆŽ°ú ž†ĎžĖīŽď§Í≥† žěąŽäĒ ŪėĄžě¨, žöįŽ¶¨ŽāėŽĚľžóźžĄúžĚė ÍīÄžÉĀŽŹôŽß• žßąŪôėžĚė ŽįúŽ≥ĎŽ•† ŽįŹ žú†Ž≥ĎŽ•†žĚÄ žĶúÍ∑ľ 10ŽÖĄ žā¨žĚīžóźŽŹĄ Íĺłž§ÄŪēėÍ≤Ć ž¶ĚÍįÄŪēėÍ≥† žěąŽč§[1]. ÍīÄžÉĀŽŹôŽß• žßąŪôėžĚÄ žč¨Í∑ľžóź žāįžÜĆžôÄ žėĀžĖϞ̥ Í≥ĶÍłČŪēėŽäĒ ÍīÄžÉĀŽŹôŽß•žóź ž£ĹžÉĀÍ≤ĹŪôĒŽįėžĚī ŪėēžĄĪŽźėŽäĒ Ž≥Ďž†Ā Í≥ľž†ēžóź ŪēīŽčĻŪēėŽ©į ÍīÄžÉĀŽŹôŽß• žßąŪôėžĚÄ ŪĀ¨Í≤Ć ŽßĆžĄĪ ŪėēŪÉúŽ•ľ Ž≥īžĚīŽäĒ žēąž†ēŪėē ŪėϞ訞¶ĚÍ≥ľ ͳȞĄĪ žßąŪôėžóź ŪēīŽčĻŪēėŽäĒ ͳȞĄĪ ÍīÄžÉĀŽŹôŽß• ž¶ĚŪõĄÍĶįžúľŽ°ú ŽāėŽČúŽč§. žēąž†ēŪėē ŪėϞ訞¶ĚžĚė ÍįÄžě• ŪĚĒŪēú žěĄžÉĀ ž¶ĚžÉĀžĚÄ ŽÖłžěĎžĄĪ ŪĚČŪÜĶžĚīŽ©į Žč§Ž•ł žõźžĚłžóź žĚėŪēú ŪĚČŪÜĶÍ≥ľ ÍĶ¨Ž≥ĄŪēėŽäĒ Í≤ÉžĚī ŪēĄžąėž†ĀžĚīŽč§. ž†ĄŪėēž†ĀžĚł ž¶ĚžÉĀžĚĄ ŪėłžÜĆŪēėŽäĒ ŪôėžěźžĚė Í≤Ĺžöįžóź Ž≥ĎŽ†• ž≤≠ž∑®ŽßĆžúľŽ°ú žČĹÍ≤Ć žēąž†ēŪėē ŪėϞ訞¶ĚžúľŽ°ú žßĄŽč®Ūē† žąė žěąžßÄŽßĆ ŪĚČŪÜĶžĚĄ ž£ľžÜĆŽ°ú ŽāīžõźŪēėŽäĒ Ūôėžěź ž§Ď ŽĻĄž†ĄŪėēž†ĀžĚł ž¶ĚžÉĀžĚĄ ŪėłžÜĆŪēėŽäĒ Í≤ĹžöįŽŹĄ žÉĀŽčĻŪěą žěąÍłį ŽēĆŽ¨łžóź žēąž†ēŪėē ŪėϞ訞¶Ě ŪôėžěźŽ•ľ ž†ēŪôēŪēėÍ≤Ć žßĄŽč®ŪēėŽäĒ ŽćįžóźŽäĒ Ūôėžěź ÍįúÍįúžĚłžĚė ž¶ĚžÉĀÍ≥ľ žěĄžÉĀ žĖĎžÉĀžóź ŽĒįŽĚľ ž†Āž†ąŪēú žßĄŽč®ž†Ā Í≤Äžā¨Ž•ľ žĄ†ŪÉĚŪēėŽäĒ Í≤ÉžĚī Žß§žöį ž§ĎžöĒŪēėŽč§[2,3].
Ž≥ł Ž°†
žěĄžÉĀ ž¶ĚžÉĀ
žč¨Í∑ľžĚė ŪóąŪėąžóź žĚėŪēú ŪĚČŪÜĶžĚÄ žč¨Í∑ľžóźžĄúžĚė žāįžÜĆ žöĒÍĶ¨ŽüČÍ≥ľ ÍīÄžÉĀŽŹôŽß•žĚĄ ŪÜĶŪēú žėĀžĖĎ ŽįŹ žāįžÜĆ Í≥ĶÍłČ žā¨žĚīžĚė žĚľžčúž†Ā Ž∂ąÍ∑†Ūėēžóź žĚėŪēī žīąŽěėŽźėŽäĒŽćį, žēąž†ēŪėē ŪėϞ訞¶ĚžĚė žßĄŽč®žóź žěąžĖī žěĄžÉĀ ž¶ĚžÉĀžóź ŽĆÄŪēú ž†ēŪôēŪēú Ž≥ĎŽ†• ž≤≠ž∑®ÍįÄ Žß§žöį ž§ĎžöĒŪēú Ž∂ÄŽ∂ĄžĚĄ žį®žßÄŪēúŽč§. ŪĚČŪÜĶžĚė ŪäĻžßēžĚÄ ŪĀ¨Í≤Ć žúĄžĻė, žĖĎžÉĀ, žßÄžÜć žčúÍįĄ, ŽÖłžěĎÍ≥ľžĚė ÍīÄŽ†®žĄĪ, žēÖŪôĒ ŪėĻžĚÄ žôĄŪôĒ žöĒžĚł ŽďĪžúľŽ°ú ŽĆÄŽ≥ÄŪē† žąė žěąŽč§. ŪĚČŪÜĶžĚė žúĄžĻėŽäĒ ŪĚČÍ≥®žĚīŽāė žôľž™Ĺ ÍįÄžäīžóź žěąÍ≥† ŪäĻžßēž†ĀžúľŽ°ú žĖĎž™Ĺ ŪĆĒ ŽįŹ žÜźÍ≥ľ ŪĄĪžúľŽ°ú Žį©žā¨ŪÜĶžĚĄ ÍįĖŽäĒŽč§. ŽßĆžēĹ ŪôėžěźÍįÄ ŪÜĶž¶ĚžĚī žěąŽäĒ Ž∂ÄžúĄŽ•ľ žÜźÍįÄŽĚĹžúľŽ°ú ŽįĒŽ°ú žßÄž†ĀŪēėÍĪįŽāė žė§Ž•łž™Ĺ ÍįÄžäīžúľŽ°ú Žį©žā¨ŽźėŽäĒ ŪÜĶž¶ĚžĚĄ ŪėłžÜĆŪēėŽäĒ Í≤ĹžöįŽäĒ žč¨Í∑ľ ŪóąŪėąžóź žĚėŪēú ŪĚČŪÜĶžĚė ÍįÄŽä•žĄĪžĚī ŽāģŽč§. ŪĚČŪÜĶžĚė žĖĎžÉĀžĚÄ ŪôėžěźžĚė žßÄžčĚ, ÍĶźžú°, Ž¨łŪôĒž†Ā žąėž§Äžóź ŽĒįŽĚľ Žč§Ž•īÍ≤Ć ŪĎúŪėĄŽź† žąė žěąžúľŽāė ŽĆÄž≤īž†ĀžúľŽ°ú ‚Äėž°įžĚłŽč§‚Äô, ‚ÄėŽčĶŽčĶŪēėŽč§‚Äô, ‚ÄėŽ¨īÍ≤ĀÍ≤Ć žßĄŽ•łŽč§‚Äô ŪėĻžĚÄ ‚ÄėŽĽźÍ∑ľŪēėŽč§‚Äô ŽďĪžúľŽ°ú ŪĎúŪėĄŽźėŽäĒ Í≤ĹžöįÍįÄ ŽßéŽč§. ŪėłŪĚ°Í≥§ŽěÄÍ≥ľ žčĚžĚÄŽēĞ̥ Ūē®ÍĽė ŽŹôŽįėŪēėŽäĒ Í≤ĹžöįÍįÄ ŽßéÍ≥† ŪĒľŽ°ú, Ž©Ēžä§ÍļľžõÄ, ŪėĄÍłįž¶Ě ŽďĪžĚė ž¶ĚžÉĀžĚīŽāė ž£ĹžĚĄ Í≤É ÍįôžĚÄ Í≥ĶŪŹ¨žč¨ ŽďĪžĚī ŽŹôŽįėŽź† žąė žěąŽč§. ŪĚČŪÜĶžĚė žßÄžÜć žčúÍįĄžĚÄ ŽĆÄž≤īž†ĀžúľŽ°ú 10Ž∂Ą žĚīŽāīŽ°ú ŪėłžÜĆŪēėŽäĒ Í≤ĹžöįÍįÄ ŽßéŽč§. 10Ž∂Ą žĚīžÉĀ žßÄžÜ掟ėŽäĒ ŪĚČŪÜĶžĚė Í≤Ĺžöį ͳȞĄĪ ÍīÄžÉĀŽŹôŽß• ž¶ĚŪõĄÍĶįžĚė ÍįÄŽä•žĄĪÍ≥ľ žßÄžÜ枆ĀžĚł Ž∂Äž†ēŽß•žĚī ŽŹôŽįėŪēėžėĞ̥ ÍįÄŽä•žĄĪžĚĄ Žįįž†úŪēīžēľ ŪēėŽ©į, ŽßĆžēĹ ŪĚČŪÜĶžĚė žßÄžÜć žčúÍįĄžĚī žąėžīą ŽŹôžēąžĚīŽĚľÍ≥† ŪēúŽč§Ž©ī ŪėϞ訞¶ĚžĚė ÍįÄŽä•žĄĪžĚÄ ŽĖ®žĖīžßĄŽč§. žēąž†ēŪėē ŪėϞ訞¶ĚžúľŽ°ú žĚłŪēú ŪĚČŪÜĶžóźžĄú ÍįÄžě• ŪäĻžßēž†ĀžĚīŽ©īžĄú ž£ľžöĒŪēú Ž∂ÄŽ∂ĄžĚÄ ŽÖłžěĎÍ≥ľžĚė žóįÍīÄžĄĪžĚīŽč§. ž†ĄŪėēž†ĀžúľŽ°ú ŪĚČŪÜĶžĚė ž¶ĚžÉĀžĚÄ žöīŽŹô, Í≤©Ūēú Íįźž†ē, žčĚžā¨, ž∂Ēžöī Žā†žĒ® ŽďĪžĚė žöĒžĚłŽď§žóź žĚėŪēī žēÖŪôĒŽźėÍ≥† žĚīŽü¨Ūēú žöĒžĚłŽď§žĚī žā¨ŽĚľž°ĆžĚĄ ŽēĆ ž¶ĚžÉĀžĚī žā¨ŽĚľžßÄŽäĒ ŪäĻžßēžĚĄ Ž≥īžĚīŽ©į ŪôėžěźÍįÄ ŽčąŪ䳎°úͳ϶¨žĄłŽ¶įžĚĄ Ūą¨žó¨Ūē† Í≤Ĺžöį žąėŽ∂Ą žĚīŽāīžóź ž¶ĚžÉĀžĚī ŽĻ†Ž•īÍ≤Ć žÜƞ觎źúŽč§. ŪėłŪĚ°žĚė žĖĎžÉĀžĚīŽāė žěźžĄł Ž≥ÄŪôĒžôÄŽäĒ žóįÍīÄžĄĪžĚī ŽĆÄž≤īž†ĀžúľŽ°ú žóÜžúľŽ©į ÍįĄŪėĻ žßÄžÜ枆ĀžĚł žöīŽŹôžóźŽŹĄ Ž∂ąÍĶ¨ŪēėÍ≥† ŪĚČŪÜĶžĚī žÜƞ觎źėÍĪįŽāė(walk-through ŪėĄžÉĀ), Í∑ł ŪĚČŪÜĶžĚī ŽįúžÉĚŽźėžóąŽćė žĖīŽĖ§ ŪĖČžúĄŽ•ľ Žč§žčú ŪēėžėĞ̥ ŽēĆ ŪĚČŪÜĶžĚī ŽįúžÉĚŽźėžßÄ žēäžĚĄ žąė žěąŽäĒŽćį(warm-up ŪėĄžÉĀ), žĚīŽäĒ ÍīÄžÉĀŽŹôŽß•žĚė žł°Ž∂Ä žąúŪôė ŽįúŽč¨žóź ÍłįžĚłŪē† žąė žěąÍłį ŽēĆŽ¨łžóź žč¨Í∑ľ ŪóąŪėąžóź žĚėŪēú ŪĚČŪÜĶžĚĄ žôĄž†ĄŪěą Žįįž†úŪēīžĄúŽäĒ žēąŽźúŽč§[4-6].
žĚīŽü¨Ūēú žó¨Žü¨ žā¨Ūē≠Žď§žĚĄ ŽįĒŪÉēžúľŽ°ú ŪôėžěźÍįÄ ŪėłžÜĆŪēėŽäĒ ŪĚČŪÜĶžĚĄ ž†ĄŪėēž†Ā ŪĚČŪÜĶ, ŽĻĄž†ĄŪėēž†Ā ŪĚČŪÜĶ ŽįŹ žč¨žě• žôł žöĒžĚłžóź žĚėŪēú ŪĚČŪÜĶžúľŽ°ú Ž∂ĄŽ•ėŪēėÍłįŽŹĄ ŪēėŽ©į(Table 1), ž†ĄŪėēž†Ā ŪĚČŪÜĶžĚĄ ŪėłžÜĆŪēėŽäĒ ŪôėžěźŽď§žĚė ŽĻĄžú®žĚÄ Ž¨łŪóĆ Ž≥īÍ≥†žóź ŽĒįŽ•īŽ©ī 10-15% ž†ēŽŹĄŽ°ú ŽāģÍ≤Ć Ž≥īÍ≥†ŽźėÍłįŽŹĄ ŪēėžėÄŽč§. Ūôėžěź ÍįúÍįúžĚłžóź ŽĒįŽĚľ ŽßéžĚÄ Í≤ĹžöįžóźžĄú ŽĻĄž†ĄŪėēž†Ā ŪĚČŪÜĶžĚĄ ŪėłžÜĆŪē† žąė žěąÍ≥† ŪäĻŪěą 25-40žĄłžĚė ž†äžĚÄ ŪôėžěźŽď§ ŪėĻžĚÄ 75žĄł žĚīžÉĀžĚė Í≥†Ž†Ļ Ūôėžěź, ŽčĻŽá®Ž≥Ď Ūôėžěź ŽėźŽäĒ žó¨žĄĪžóźžĄú žěė ÍīÄžįįŽźėÍłį ŽēĆŽ¨łžóź ž£ľžĚėŽ•ľ žöĒŪēúŽč§[7,8]. žēąž†ēŪėē ŪėϞ訞¶Ě Ūôėžěź ŽĆÄŽ∂ÄŽ∂ĄžĚÄ žč†ž≤ī Í≤Äžā¨žóźžĄú ŪäĻžĚī žÜĆÍ≤¨žĚī žóÜŽč§. žēąž†ēŪėē ŪėϞ訞¶ĚžĚī žĚėžč¨ŽźėŽäĒ ŪôėžěźžóźžĄúŽäĒ žč†ž≤ī Í≤Äžā¨Ž•ľ ŪÜĶŪēī žč¨Žā≠žóľ, žč¨žě•ŪĆźŽßČž¶ĚžĚīŽāė ŽĻĄŪõĄžĄĪ žč¨Í∑ľŽ≥Ďž¶Ě ŽďĪžĚė ŽĻĄŪóąŪėąžĄĪ žč¨žě• žßąŪôėžĚīŽāė žč¨žě• žĚīžôłžĚė Žč§Ž•ł Ž∂ÄžúĄžóźžĄú ÍłįžĚłŪēú ŪĚČŪÜĶžĚĄ Žįįž†úŪēīžēľ ŪēúŽč§[4].
ÍłįŽ≥ł Í≤Äžā¨
žēąž†ēŪėē ŪėϞ訞¶ĚžĚī žĚėžč¨ŽźėŽäĒ Ž™®Žď† ŪôėžěźžóźžĄú ÍłįŽ≥łž†ĀžúľŽ°ú 12 žú†ŽŹĄ žč¨ž†ĄŽŹĄŽ•ľ žč§žčúŪēīžēľ ŪēėŽ©į ST Ž∂Ąž†ąžĚė ŪēėÍįēžĚīŽāė žÉĀžäĻ, TŪĆĆžĚė žó≠žúĄ žú†Ž¨īŽ•ľ žěė žāīŪéīžēľ ŪēúŽč§. žēąž†ēŪėē ŪėϞ訞¶Ě ŪôėžěźžĚė 50%žóźžĄúŽäĒ 12 žú†ŽŹĄ žč¨ž†ĄŽŹĄžóźžĄú ž†ēžÉĀ žÜĆÍ≤¨žĚĄ Ž≥īžĚľ žąė žěąÍ≥† ST Ž∂Ąž†ą ŽįŹ TŪĆĆžĚė Ž≥ÄŪôĒŽäĒ ÍīÄžÉĀŽŹôŽß• žßąŪôėžĚī žóÜŽäĒ ž†ēžÉĀ ŪôėžěźŽď§žĚė 10%žóźžĄúŽŹĄ ŽįúÍ≤¨Žź† žąė žěąŽč§. Í≥†žúĄŪóėÍĶįžóź ŪēīŽčĻŪēėÍĪįŽāė Žč§ŪėąÍīÄ žßąŪôėžĚł Í≤Ĺžöį ST Ž∂Ąž†ąžĚė ŪēėÍįēžĚīŽāė TŪĆĆžĚė žó≠žúĄ ŽďĪžĚī ŽŹôŽįėŪēėŽäĒ Í≤ĹžöįÍįÄ ŽßéÍ≥† ŽĻąŽß•žĄĪ Ž∂Äž†ēŽß•, Žį©žč§ Í≤įž†ą žį®Žč® ŽįŹ ÍįĀžį®Žč® ŽďĪžĚė žÜĆÍ≤¨žĚĄ Ž≥īžĚīÍ≥† žěąŽäĒ Í≤Ĺžöįžóź ÍīÄžÉĀŽŹôŽß• žßąŪôėžĚė ÍįÄŽä•žĄĪžĚī ŽÜížēĄžßĄŽč§[9]. ŪĚČŽ∂Ä Žč®žąú žī¨žėĀžĚÄ žēąž†ēŪėē ŪėϞ訞¶ĚžĚė žßĄŽč®Í≥ľ žúĄŪóėŽŹĄ ŪŹČÍįÄŽ•ľ žúĄŪēú ŽŹĄÍĶ¨žĚīÍłįŽ≥īŽč§ŽäĒ ÍīÄžÉĀŽŹôŽß• žßąŪôėÍ≥ľ žú†žā¨Ūēú ž¶ĚžÉĀžĚĄ ŪėłžÜĆŪēėŽäĒ žč¨Ž∂Äž†Ą, ŪĚČŽā≠ žāľž∂úžĚīŽāė ŽĆÄŽŹôŽß• ŽįēŽ¶¨ ŽďĪžĚė žßąŪôėžĚĄ ÍįźŽ≥ĄŪēėŽäĒ Žćį žú†žö©ŪēėŽč§[10].
ŽĻĄžĻ®žäĶž†Ā Í≤Äžā¨
žöīŽŹôŽ∂ÄŪēė žč¨ž†ĄŽŹĄ(treadmill exercise electrocardiogram)
žöīŽŹôŽ∂ÄŪēė žč¨ž†ĄŽŹĄŽäĒ žąėžč≠ ŽÖĄžóź ÍĪłž≥ź ŽĄźŽ¶¨ žā¨žö©ŽźėÍ≥† žěąžúľŽ©į Bruce Žį©žč̞̥ ž£ľŽ°ú žĚīžö©ŪēėÍ≥† žěąŽč§. žöīŽŹôžĚė ž†ēŽŹĄŽäĒ ŽĆÄžā¨ŽčĻŽüČ(estimated metabolic equivalents [METs])žúľŽ°ú Ž≥īÍ≥†ŪēėŽäĒŽćį 1 METsžĚė ž†ēžĚėŽäĒ Ž∂ĄŽčĻ kgŽčĻ 3.5 mLžĚė Íłįžīą žāįžÜĆÍįÄ žöĒÍĶ¨ŽźėŽäĒ žöīŽŹôŽüČžĚīŽč§[11]. žöīŽŹôŽ∂ÄŪēė žč¨ž†ĄŽŹĄžĚė ž†ąŽĆÄž†Ā ÍłąÍłįŽ°úŽäĒ 2žĚľ žĚīŽāīžĚė ͳȞĄĪ žč¨Í∑ľÍ≤ĹžÉČ, Ūėąžó≠Ūēôž†Ā žĚīžÉĀžĚīŽāė žč¨ÍįĀŪēú ž¶ĚžÉĀžĚĄ žīąŽěėŪēėŽäĒ Ž∂Äž†ēŽß•, ž¶ĚžÉĀžĚī žěąÍĪįŽāė žč¨Ūēú ŽĆÄŽŹôŽß• ŪĆźŽßČ ŪėĎžį©ž¶Ě, ž¶ĚžÉĀžĚī žěąŽäĒ žč¨Ž∂Äž†Ą, ͳȞĄĪ ŪŹźžÉČž†Ąž¶ĚžĚīŽāė ͳȞĄĪ žč¨Í∑ľžóľ ŪėĻžĚÄ žč¨Žā≠žóľÍ≥ľ ͳȞĄĪ ŽĆÄŽŹôŽß• ŽįēŽ¶¨ÍįÄ žěąŽč§. žöīŽŹôŽ∂ÄŪēė žč¨ž†ĄŽŹĄŽ•ľ Í≤Äžā¨ ŽŹĄž§Ďžóź ŽįėŽďúžčú ž§ĎŽč®Ūēīžēľ ŪēėŽäĒ ž°įÍĪīžĚÄ žēąž†ē žÉĀŪÉú ŪėąžēēŽ≥īŽč§ 10 mmHg žĚīžÉĀ ŽĖ®žĖīžßÄŽäĒ Í≤Ĺžöį, ŪôėžěźÍįÄ žč¨Ūēú ŪĚČŪÜĶžĚĄ ŪėłžÜĆŪēėŽäĒ Í≤Ĺžöį, žĖīžßÄŽü¨žõÄžĚīŽāė žč§žč† žßĀž†ĄžĚė žÉĀŪÉú, žąėž∂ēÍłį ŪėąžēēžĚīŽāė žč¨ž†ĄŽŹĄ ÍįźžčúÍįÄ žĖīŽ†§žöī žÉĀŪÉú, ŪôėžěźÍįÄ ž§ĎŽč®žĚĄ žõźŪēėŽäĒ Í≤Ĺžöį, žßÄžÜ枆Ā žč¨žč§ ŽĻąŽß•, QŪĆĆÍįÄ žóÜŽäĒ žú†ŽŹĄžóźžĄú 1 mm žĚīžÉĀžĚė ST Ž∂Ąž†ą žÉĀžäĻ ŽďĪžĚī žěąŽč§. žēąž†ēŪėē ŪėϞ訞¶Ě žßĄŽč®žóź ŽĆÄŪēú žöīŽŹôŽ∂ÄŪēė Í≤Äžā¨žĚė žĖĎžĄĪ Íłįž§ÄžĚÄ PRž†źžĚĄ Íłįž§ÄžúľŽ°ú Ūēėžó¨ ST Ž∂Ąž†ą ŪēėÍįēžĚī žąėŪŹČŪėē ŽėźŽäĒ ŪēėÍįēŪėē žĚľ Í≤ĹžöįžóźŽäĒ Jž†ź ŪõĄ 60-80 ms ž†źžóźžĄú 1 mm žĚīžÉĀžĚľ ŽēĆ, žÉĀžäĻŪėēžĚľ ŽēĆŽäĒ Jž†ź ŪõĄ 80 ms ž†źžóźžĄú 2 mm žĚīžÉĀžĚľ ŽēĆ žĖĎžĄĪžúľŽ°ú ŪĆźž†ēŪēúŽč§. žöīŽŹôŽ∂ÄŪēė žč¨ž†ĄŽŹĄžÉĀ Bruce protocol 1Žč®Í≥ĄžóźžĄú ST Ž∂Ąž†ąžĚī 1 mm žĚīžÉĀ ŪēėÍįēŪēėÍĪįŽāė Ž™®Žď† Žč®Í≥ĄžóźžĄú 2 mm žĚīžÉĀ ST Ž∂Ąž†ąžĚī ŪēėÍįēŪēėŽäĒ Í≤Ĺžöį, žöīŽŹô ž§ĎŽč® ŪõĄžóźŽŹĄ 5Ž∂Ą žĚīžÉĀžĚė ST Ž∂Ąž†ą ŪēėÍįēžĚī žßÄžÜ掟ėŽäĒ Í≤Ĺžöį, žöīŽŹô ž§Ď 10 mmHg žĚīžÉĀ žąėž∂ēÍłį ŪėąžēēžĚī ŪēėÍįēŪēėŽäĒ Í≤Ĺžöį, žöīŽŹô ž§Ď žč¨žč§žĄĪ ŽĻąŽß•žĚī ž∂úŪėĄŪēėŽäĒ Í≤ĹžöįŽäĒ Í≥†žúĄŪóėÍĶįžóź ŪēīŽčĻŪēúŽč§[12,13]. žč¨ž†ĄŽŹĄ žÉĀžóźžĄú žĘĆžč¨žč§ ŽĻĄŽĆÄ, žĘĆÍįĀ ŽįŹ žöįÍįĀ žį®Žč®žĚī žěąŽäĒ Í≤ĹžöįžóźŽäĒ žúĄžĖĎžĄĪžĚī ŽÜíÍ≤Ć ŽāėŪÉÄŽā† žąė žěąÍ≥† digoxinžĚĄ Ūą¨žó¨ŪēėÍ≥† žěąŽäĒ Í≤Ĺžöį ž†ēžÉĀ ŪôėžěźžóźžĄúŽŹĄ ST Ž∂Ąž†ą ŪēėÍįēžĚī ŽāėŪÉÄŽā† žąė žěąžúľŽ©į Ž≤†ŪÉÄ žį®Žč®ž†ú, žßąžāįžóľ ž†úž†úŽāė žĻľžäė ÍłłŪē≠ž†úŽäĒ ST Ž∂Ąž†ą ŪēėÍįēžĚĄ žĚľžúľŪā§žßÄ žēäžĚĄ žąė žěąÍłį ŽēĆŽ¨łžóź ž†ēŪôēŪēú žßĄŽč®žĚĄ žúĄŪēīžĄúŽäĒ 48žčúÍįĄ ž†ĄžóźŽäĒ žēĹŽ¨ľžĚĄ ž§ĎžßÄŪēėÍ≥† Í≤Äžā¨Ž•ľ žč§žčúŪēīžēľ ŪēúŽč§[14].
Ž∂ÄŪēė žč¨žīąžĚĆŪĆĆ(stress echocardiography)
žč¨Í∑ľžĚė žąėž∂ēÍłįŽä• žě•žē†ŽäĒ ŪĚČŪÜĶžĚīŽāė žč¨ž†ĄŽŹĄ Ž≥ÄŪôĒŽ≥īŽč§ Ž®ľž†Ä ŽāėŪÉÄŽāėŽäĒ žč¨Í∑ľ ŪóąŪėąžĚė žÜĆÍ≤¨žĚīŽč§. Ž∂ÄŪēė žč¨žīąžĚĆŪĆĆ Í≤Äžā¨ŽäĒ žč¨Í∑ľ ŪóąŪėąžĚĄ ŽāėŪÉÄŽāīŽäĒ žč¨Í∑ľžĚė žúĄžĻėžôÄ Ž≤ĒžúĄŽ•ľ ŪĆĆžēÖŪē† žąė žěąÍ≥† žč¨žě•žĚė ÍĶ¨ž°įž†Ā žĚīžÉĀ žó¨Ž∂ÄžôÄ žč¨žě•žĚė ÍłįŽä•ŽŹĄ Ūē®ÍĽė ž†ēŪôēŪěą ŪŹČÍįÄŪē† žąė žěąŽč§ŽäĒ žě•ž†źžĚī žěąŽč§. Í≤Äžā¨žĚė žĖĎžĄĪ ŪĆźž†ēžĚÄ žēąž†ē žčú žč¨Í∑ľžĚė žöīŽŹô žÉĀŪÉúžôÄ Ž∂ÄŪēė žÉĀŪÉúžóźžĄúžĚė žč¨Í∑ľžĚė Ž≤ĹžöīŽŹôÍ≥ľ ŽĎźÍĽėŽ•ľ ŽĻĄÍĶźŪēėžó¨ žēąž†ē žčúžóź ÍīÄžįįŽźėžßÄ žēäžēėŽćė ÍĶ≠žÜĆ Ž≤Ĺ žöīŽŹôžĚīžÉĀžĚī ÍīÄžįįŽźėÍĪįŽāė, žēąž†ē žčú žěąžóąŽćė žč¨Í∑ľžĚė ŽĻĄž†ēžÉĀž†ĀžĚł ÍĶ≠žÜĆ Ž≤Ĺ žöīŽŹôžĚī žēÖŪôĒŽź† ŽēĆ žč¨Í∑ľ ŪóąŪėąžĚī žú†ŽįúŽźėŽäĒ Í≤ÉžúľŽ°ú žßĄŽč®ŪēúŽč§[15]. žč¨žě•Ž∂ÄŪēė Žį©Ž≤ēžĚÄ ŪĀ¨Í≤Ć žöīŽŹô ŽėźŽäĒ žēĹŽ¨ľŽ∂ÄŪēėŽ°ú ŽāėŽąĆ žąė žěąŽäĒŽćį žöīŽŹôžĚĄ ŪÜĶŪēú Ž∂ÄŪēėŽ°úŽäĒ ŽčĶžį® žöīŽŹô ŽėźŽäĒ žěźž†ĄÍĪį žöīŽŹôžĚė Žį©Ž≤ēžĚĄ žā¨žö©ŪēėŽ©į žöīŽŹôžĚī žĖīŽ†ĶÍĪįŽāė ž†Ąžč† žÉĀŪÉúÍįÄ ŽāėŽĻ† žöīŽŹôžĚī Ž∂ąÍįÄŽä•Ūēú ŪôėžěźžóźžĄúŽäĒ žēĹŽ¨ľžĚĄ žĚīžö©Ūē† žąė žěąŽč§. žēĹŽ¨ľ Ž∂ÄŪēėž†úŽ°ú ŪėąÍīÄŪôēžě•ž†úžĚł dipyridamole, adenosineÍ≥ľ žč¨Í∑ľžĚė žāįžÜĆžöĒÍĶ¨ŽüȞ̥ ŽäėŽ†§ žč¨Í∑ľ ŪóąŪėąžĚĄ žú†ŽįúžčúŪā§ŽäĒ dobutamine ŽďĪžĚī žěąŽč§. Ž∂ÄŪēė žč¨žīąžĚĆŪĆƞ󟞥ú ÍĶ≠žÜĆž†Ā Ž≤Ĺ žöīŽŹô Ž≥ÄŪôĒŽäĒ 16ÍĶ¨žó≠ ŪėĻžĚÄ 17ÍĶ¨žó≠ Ž™®ŽćłžĚī žěąžúľŽ©į ž£ľŽ°ú 16ÍĶ¨žó≠ Ž™®ŽćłžĚī ŽßéžĚī žā¨žö©ŽźúŽč§. žēąž†ē žčúžóź ŽĻĄŪēėžó¨ žč¨žě• Ž∂ÄŪēėŽ°ú žĚłŪēī žĘĆžč¨žč§ ŽāīÍ≤ĹžĚī ž¶ĚÍįÄŽźėÍ≥† žĘĆžč¨žč§ ÍĶ¨ŪėąŽ•†žĚī ÍįźžÜĆŽźėŽäĒ Í≤Ĺžöį, ÍĶ≠žÜĆ Ž≤Ĺ žöīŽŹô žě•žē†ÍįÄ Ž∂ÄŪēė žīąÍłįžóź žĚľžĖīŽāėŽäĒ Í≤Ĺžöį, 3Íįú žĚīžÉĀžĚė ÍĶ¨žó≠žóźžĄú ÍĶ≠žÜĆ Ž≤Ĺ žöīŽŹôžĚīžÉĀžĚī ŽŹôŽįėŪēėŽäĒ Í≤Ĺžöįžóź Žč§ŪėąÍīÄ žßąŪôė ŽėźŽäĒ žĘĆž£ľÍįĄžßÄŽ≥ĎŽ≥Ä ŽďĪžĚė Í≥†žúĄŪóėÍĶįžúľŽ°ú ŪĆźŽč®ŽźúŽč§[16,17].
ŽŹôžúĄžõźžÜĆ žč¨Í∑ľ ÍīÄŽ•ė žä§žļĒ(myocardial perfusion scan)
žč¨Í∑ľ ÍīÄŽ•ė žä§žļĒžĚÄ Žį©žā¨žĄ† žĚėžēĹŪíąžĚĄ Ūą¨žó¨Ūēėžó¨ žč¨Í∑ľžóźžĄúžĚė žĄ≠ž∑® Ž≥ÄŪôĒŽ•ľ ŪÜĶŪēī žč¨Í∑ľ ÍīÄŽ•ėŽ•ľ ŪŹČÍįÄŪēėŽäĒ Í≤Äžā¨žĚīŽč§. Í≤ĆžĚīŪäł žč¨Í∑ľ ÍīÄŽ•ė single photon emission computed tomography (SPECT)žóźžĄúŽäĒ Ūēú Ž≤ąžĚė Í≤Äžā¨Ž°ú žč¨Í∑ľžĚė ÍīÄŽ•ė žÉĀŪÉúžôÄ žĘĆžč¨žč§ žö©ž†ĀÍ≥ľ žĘĆžč¨žč§ ÍĶ¨ŪėĄžú® ŽįŹ žč¨Í∑ľžĚė Ž≤Ĺ žöīŽŹôÍ≥ľ žóįÍīÄŽźú žó¨Žü¨ ž†ēŽ≥īŽ•ľ ŽŹôžčúžóź žĖĽžĚĄ žąė žěąÍ≥† žĻ®žäĶž†Ā ÍīÄžÉĀŽŹôŽß• ž°įžėĀžą†žóźžĄú ÍīÄžįįŽźėŽäĒ Ž≥ĎŽ≥ÄžĚė žÉĚŽ¶¨ ÍłįŽä•ž†Ā ŪŹČÍįÄŽ•ľ žēĆžēĄŽ≥ľ žąė žěąŽč§ŽäĒ ž§ĎžöĒŪēú žě•ž†źžĚī žěąÍłįžóź ŪėĄžě¨ÍĻĆžßÄŽŹĄ žěĄžÉĀ žč¨žě• žėĀžÉĀ Ž∂ĄžēľžóźžĄú ŪēĶžč¨ž†ĀžĚł žó≠Ūē†žĚĄ ŪēėžėÄÍ≥† ÍīÄžÉĀŽŹôŽß• ž§Ďžě¨žą†žĚĄ žčúŪĖČŪēėŽ†§ŽäĒ Í≤Ĺžöį žčúžą†žěźŽ°ú Ūēėžó¨Íłą ž†Āž†ąŪēú žĻėŽ£Ć Žį©Ž≤ēžĚĄ žĄ†ŪÉĚŪēėŽäĒ Žćį žěąžĖīžĄúŽŹĄ ŽŹĄžõĞ̥ ž£ľÍ≥† žěąŽč§. žč¨Í∑ľ ÍīÄŽ•ė SPECTžóź žĚīžö©ŽźėŽäĒ Žį©žā¨žĄĪžĚėžēĹŪíąžĚÄ Tl-201Í≥ľ Tc-99mžúľŽ°ú ŪĎúžßÄŪēú žĚėžēĹŪíą(MIBI, tetrofosmin) ŽďĪžĚī žěąžúľŽ©į žĚīžö©ŽźėŽäĒ Ž∂ÄŪēė žēĹž†úŽäĒ žč¨Í∑ľ žěźž≤īžĚė žąėž∂ēŽ†•žĚĄ ž¶ĚÍįÄžčúžľú ÍīÄžÉĀŽŹôŽß• ŪėąŽ•ėŽ•ľ ž¶ĚÍįÄžčúŪā§ŽäĒ dobutamine, arbutamine ŪėĻžĚÄ ÍīÄžÉĀŽŹôŽß•žĚĄ Ūôēžě•Ūēėžó¨ ŪėąŽ•ėŽ•ľ ž¶ĚÍįÄžčúŪā§ŽäĒ dipyridamole, adenosine, ATP ŽďĪžĚė ŪėąÍīÄŪôēžě•ž†úÍįÄ žā¨žö©ŽźúŽč§[18]. žč¨Í∑ľ ÍīÄŽ•ė SPECTžóźžĄú Í≤įžÜźžĚė ŪĀ¨ÍłįŽäĒ 5-10%Ž•ľ žěĎžĚÄ Í≤įžÜź, 15-20%Ž•ľ ž§ĎŽďĪŽŹĄžĚė Í≤įžÜź, žĘƞ訞觞Ěė 20% žĚīžÉĀ Í≤įžÜźžĚĄ ŪĀį Í≤įžÜźžĚīŽĚľ ŪēúŽč§. žč¨Í∑ľ ÍīÄŽ•ė SPECTŽäĒ ž§Ďž¶Ě ŽįŹ Žč§ŪėąÍīÄ ÍīÄžÉĀŽŹôŽß• žßąŪôėžĚė žßĄŽč®žóźŽŹĄ žú†žö©Ūēėžó¨, 15% žĚīžÉĀžĚė ÍīĎŽ≤ĒžúĄŪēėÍ≥† žč¨Ūēú ÍīÄŽ•ė Í≤įžÜźÍ≥ľ Žč§ŪėąÍīÄ žėĀžó≠žĚė ÍīÄŽ•ė Í≤įžÜź, Tl-201 ŪŹź žĄ≠ž∑® ž¶ĚÍįÄ ŽďĪžĚī Í≥†žúĄŪóėžĚĄ ŽįėžėĀŪēėŽäĒ žÜĆÍ≤¨žĚīŽč§. Íłįž°ī žēąž†ēŪėē ŪėϞ訞¶Ě žĻėŽ£Ćžóź žěąžĖī Ūôėžěź ÍįúÍįúžĚłžĚė žč¨Í∑ľ ŪóąŪėą ž†ēŽŹĄŽ•ľ žúĄŪóėŽŹĄžóź ŽĒįŽĚľ Ž∂ĄŽ•ėŪēėžó¨ Ūôėžěź Žßěž∂§Ūėē žĻėŽ£Ć(žēĹŽ¨ľ žĻėŽ£Ć vs. ÍīÄžÉĀ ŽŹôŽß• ž§Ďžě¨žą†)Ž°ú žßĄŪĖČŪēėŽäĒ Žį©žčĚžĚÄ žč¨Í∑ľ ÍīÄŽ•ė SPECTŽ•ľ ÍłįŽįėžúľŽ°ú Ūēú žóįÍĶ¨Žď§žĚĄ ŪÜĶŪēī žĚīŽ£®žĖīž°ĆŽč§[19-21].
žč¨Í∑ľ ÍīÄŽ•ė žĖĎž†ĄžěźŽį©ž∂úŽč®žłĶžī¨žėĀ(positron emission tomography, PET)
žč¨Í∑ľ ÍīÄŽ•ė PETŽäĒ žč¨Í∑ľžóź ŪēĄžöĒŪēú ŪŹ¨ŽŹĄŽčĻ ŽďĪžĚė Ž¨ľžßąžóź žĖĎž†ĄžěźŽ•ľ Žį©ž∂úŪēėŽäĒ Žį©žā¨žĄĪ Ž¨ľžßąžĚĄ ŪĎúžßÄŪēėžó¨ žč¨Í∑ľžóźžĄúžĚė žĄ≠ž∑® Ž≥ÄŪôĒŽ•ľ ŪÜĶŪēī žč¨Í∑ľ ÍīÄŽ•ė ž†ēŽŹĄŽ•ľ ŪŹČÍįÄŪēúŽč§. 82Rb, 13NH3, Í∑łŽ¶¨Í≥† H215OÍįÄ ŽĆÄŪĎúž†ĀžĚł ŪĎúžßÄžěźžĚīŽ©į žč¨Í∑ľ ÍīÄŽ•ė SPECTžôÄ žú†žā¨ŪēėÍ≤Ć žč¨Í∑ľžĚė ÍīÄŽ•ė Í≤įžÜźžĚĄ žēąž†ēžčúžôÄ Ž∂ÄŪēėžčúžĚė ŪĎúžßÄžěźžĚė Ž∂ĄŪŹ¨ žį®žĚīŽ•ľ ŪÜĶŪēī ŽāėŪÉÄŽāłŽč§. ŪėϞ訞¶Ě žßĄŽč®žĚė ž†ēŪôēŽŹĄžóź ŽĆÄŪēú žč¨Í∑ľ ÍīÄŽ•ė PET žóįÍĶ¨Žď§žĚÄ ŽĆÄŽ∂ÄŽ∂Ą 82Rb, 13NH3 ŪĎúžßĞ쟎•ľ žĚīžö©Ūēú žóįÍĶ¨Žď§žóź ÍłįŽįėŪēėžėÄžúľŽ©į žč¨Í∑ľ ÍīÄŽ•ė SPECTžôÄ ŽĻĄÍĶźŪēėžó¨ žč¨Í∑ľ ÍīÄŽ•ė PETžĚė Í≤Äžā¨ ž†ēŪôēŽŹĄŽäĒ Žß§žöį ŽÜížēĄ žěĎžĚÄ ÍīÄŽ•ė Í≤įžÜźžĚĄ žßĄŽč®ŪēėŽäĒŽćį žěąžĖīžĄúŽŹĄ žú†Ž¶¨ŪēėŽč§. ŽėźŪēú Žį©žā¨žĄ† ŽÖłž∂ú ž†ēŽŹĄÍįÄ žÉĀŽĆÄž†ĀžúľŽ°ú ž†ĀÍ≥† žēĹŽ¨ľžĚė ŽįėÍįźÍłįÍįÄ žßßÍłį ŽēĆŽ¨łžóź Í≤Äžā¨ ž§ÄŽĻĄ ÍłįÍįĄžĚī žč¨Í∑ľÍīÄŽ•ė SPECTžóź ŽĻĄŪēīžĄú ž†ąžēĹŽźúŽč§[22]. Ž©ĒŪÉÄŽ∂ĄžĄĚžĚĄ ŪŹ¨Ūē®Ūēú žó¨Žü¨ žóįÍĶ¨ Í≤įÍ≥ľ ŪėϞ訞¶ĚžĚė žßĄŽč®žóź žěąžĖī žč¨Í∑ľ ÍīÄŽ•ė PET Í≤Äžā¨žĚė ŽĮľÍįźŽŹĄŽäĒ 84-93%, ŪäĻžĚīŽŹĄŽäĒ 81-88%žėÄŽč§. žč¨Í∑ľ ÍīÄŽ•ė PETŽäĒ žč¨Í∑ľ ÍīÄŽ•ė SPECTžôÄ ŽĻĄÍĶźŪēėžó¨ žėĀžÉĀžĚė ŪēīžÉĀŽŹĄÍįÄ žöįžąėŪēėÍ≥† žč¨Í∑ľ ÍīÄŽ•ė SPECT Í≤Äžā¨žôÄ Žč¨Ž¶¨ žĖīŽäź ž†ēŽŹĄŽ°ú ŪäĻž†ē žßÄŽįį ÍĶ¨žó≠ žč¨Í∑ľžóźžĄúžĚė žč¨Í∑ľ ŪėąŽ•ėžĚė ž†ąŽĆÄÍįí žł°ž†ēžĚī ÍįÄŽä•ŪēėÍłį ŽēĆŽ¨łžóź Žč§ŪėąÍīÄ žßąŪôėžĚĄ ÍįĖŽäĒ ŪôėžěźŽď§žĚīŽāė Í∑†Ūėē ŪóąŪėą(balanced ischemia)žĚĄ Žįįž†úŪēīžēľ ŪēėŽäĒ žÉĀŪô©žóźžĄú ŪäĻžĚī žú†žö©žĄĪžĚī ŪĀ¨Ž©į ŽĮłžĄłŪėąÍīÄ ŪėϞ訞¶ĚžĚė žßĄŽč®žóźŽŹĄ žú†žö©ŪēėŽč§[23,24].
žč¨Í∑ľ ÍīÄŽ•ė žěźÍłįÍ≥ĶŽ™ÖžėĀžÉĀ(magnetic resonance imaging, MRI)
žč¨Í∑ľ ÍīÄŽ•ė MRIŽäĒ žč¨Í∑ľ ÍīÄŽ•ė SPECT ŽįŹ PETžôÄŽäĒ Žč§Ž•īÍ≤Ć Žį©žā¨žĄĪ Ž¨ľžßąŽ°úŽ∂ÄŪĄį žěźžú†Ž°≠Žč§ŽäĒ ŪĀį žĚīž†źžĚī žěąÍ≥† T1 Íįēž°į žėĀžÉĀ ÍłįŽįėžúľŽ°ú Ūēėžó¨ ÍįÄŽŹĆŽ¶¨ŽäĄ ž°įžėĀž†úÍįÄ žč¨žě•žĚĄ ŪÜĶÍ≥ľŪēėŽäĒ ž†ēŽŹĄŽ•ľ ŪŹČÍįÄŪēúŽč§. žč¨žě• MRIŽ•ľ ŪÜĶŪēīžĄú ÍłįŽ≥łž†ĀžúľŽ°ú žĖĽžĚĄ žąė žěąŽäĒ žĘĆžč¨žč§ ÍłįŽä•ŪŹČÍįÄ, ŪõĄÍłį ÍįÄŽŹĆŽ¶¨ŽäĄ ž°įžėĀž¶ĚÍįēžóź ŽĆÄŪēú žėĀžÉĀÍ≥ľ Ūē®ÍĽė žēąž†ē žÉĀŪÉúžôÄ Ž∂ÄŪēė žÉĀŪÉúžóźžĄúžĚė žč¨Í∑ľžóźžĄú ÍįÄŽŹĆŽ¶¨ŽäĄžĚī ž°įžėĀž¶ĚÍįēŽźėŽäĒ ž†ēŽŹĄžĚė žį®žĚīŽ•ľ ŪŹČÍįÄŪēėžó¨ Ž∂ĄžĄĚŪēėŽäĒ Žį©žčĚžúľŽ°ú žč¨Í∑ľžĚė ÍįÄŽŹĆŽ¶¨ŽäĄ žč†Ūėł ž¶ĚÍįÄÍįÄ žÉĀžäĻŪēėŽäĒ Í≤Ĺžā¨ŽŹĄŽ•ľ žł°ž†ēŪēėžó¨ ž†ēŽěĶž†Ā Ž∂ĄžĄĚžĚĄ Ūē† žąė žěąÍ≥† žĚīŽ•ľ ŽįĒŪÉēžúľŽ°ú Žč§ŪėąÍīÄ žßąŪôėÍ≥ľ ŽĮłžĄłŪėąÍīÄ ŪėϞ訞¶Ě ŽďĪžĚĄ žßĄŽč®ŪēėŽäĒ Žćį žú†žö©ŪēėÍ≤Ć žā¨žö©Žź† žąė žěąŽč§[25]. Ž©ĒŪÉÄŽ∂ĄžĄĚ žóįÍĶ¨žóź ŽĒįŽ•īŽ©ī žč¨Í∑ľ ÍīÄŽ•ė MRIŽ•ľ ŪÜĶŪēī 50% žĚīžÉĀžĚė ÍīÄžÉĀŽŹôŽß• ŪėĎžį©ž¶ĚžĚī ŽŹôŽįėŪēú ŪėϞ訞¶Ě ŪôėžěźŽ•ľ žßĄŽč®ŪēėŽäĒ ž†ēŪôēŽŹĄžóź žěąžĖī ŽĮľÍįźŽŹĄ 91% Í∑łŽ¶¨Í≥† ŪäĻžĚīŽŹĄ 81%Ž•ľ Ž≥īžėÄÍ≥† žč¨Í∑ľ ÍīÄŽ•ė SPECTžôÄ ŽĻĄÍĶźŪēėžėĞ̥ ŽēĆŽŹĄ ž†ĄŽįėž†ĀžúľŽ°ú žú†žā¨Ūēú žßĄŽč® ž†ēŪôēŽŹĄŽ•ľ Ž≥īžėÄŽč§[26].
ÍīÄžÉĀŽŹôŽß• ž†ĄžāįŪôĒŽč®žłĶžī¨žėĀ ŪėąÍīÄ ž°įžėĀžą†(computed tomography angiography, CTA)
ÍīÄžÉĀŽŹôŽß• CTAŽäĒ žēąž†ēŪėē ŪėϞ訞¶Ě ŪôėžěźžóźžĄú ÍīÄžÉĀŽŹôŽß• Ž≥ĎŽ≥Äžóź ÍīÄŪēú žĘÖŪē©ž†ĀžĚł ŪėēŪÉúŪēôž†Ā ž†ēŽ≥ī, ž¶Č ŪėĎžį© Ž≥ĎŽ≥Ä Ž∂ÄžúĄ, ŪėĎžį© Ž≥ĎŽ≥ÄžĚė ÍłłžĚī, žĶúžÜĆŽāīÍ≤ĹŽ©īž†Ā, žĶúžÜĆŽāīÍ≤ĹžßÄŽ¶Ą, ŪėĎžį©žĚė ž§ĎŽďĪŽŹĄ Í∑łŽ¶¨Í≥† ŪėĎžį©žĚĄ žĚľžúľŪā§ŽäĒ ž£ĹžÉĀÍ≤ĹŪôĒŽįėžĚė žĖĎžÉĀžóź ŽĆÄŪēú ž†ēŽ≥īŽ•ľ ž†úÍ≥ĶŪēúŽč§[27]. ÍīÄžÉĀŽŹôŽß• CTAŽ•ľ ŪÜĶŪēú žēąž†ēŪėē ŪėϞ訞¶ĚžĚė žßĄŽč® ž†ēŪôēŽŹĄŽäĒ žĻ®žäĶž†Ā ÍīÄžÉĀŽŹôŽß• ž°įžėĀžą†Í≥ľ ŽĻĄÍĶźŪēėžó¨ žĚĆžĄĪžėąžł°ŽŹĄÍįÄ 95-99%Ž°ú Žß§žöį ŽÜíŽč§. ŪēėžßÄŽßĆ ÍīÄžÉĀŽŹôŽß• CTAŽäĒ žĻľžäė ŽįŹ žĚłÍ≥ĶŽ¨ľ ŽďĪžúľŽ°ú žĚłŪēú žúĄžĖĎžĄĪžúľŽ°ú žĚłŪēī žĖĎžĄĪžėąžł°ŽŹĄžôÄ ŪäĻžĚīŽŹĄÍįÄ ŽāģŽč§. ŽėźŪēú, ÍīÄžÉĀŽŹôŽß• CTAŽ•ľ ŪÜĶŪēī žú°žēąž†ĀžúľŽ°ú 50-90%žĚė ŪėĎžį©žĚī ŪôēžĚłŽźú Ž≥ĎŽ≥ÄžĚī žč§ž†úŽ°ú ŪôėžěźžóźÍ≤Ć žč¨Í∑ľ ŪóąŪėąžĚĄ žĚľžúľŪā®Žč§Í≥† Ž≥ľ žąė žóÜÍłį ŽēĆŽ¨łžóź 90% žĚīžÉĀžúľŽ°ú ŪėĎžį©žĚī Žß§žöį žč¨Ūēú Í≤ĹžöįŽ•ľ ž†úžôłŪēėÍ≥†ŽäĒ ŽĆÄŽ∂ÄŽ∂ĄžóźžĄú ž∂ĒÍįÄž†ĀžĚł ŽĻĄžĻ®žäĶž†Ā ÍłįŽä• Í≤Äžā¨ ŪėĻžĚÄ žĻ®žäĶž†Ā ÍłįŽä• Í≤Äžā¨ÍįÄ žöĒÍĶ¨ŽźėŽäĒ Í≤ĹžöįÍįÄ ŽßéŽč§. ž¶Č, ÍīÄžÉĀŽŹôŽß• CTAŽ•ľ ŪÜĶŪēī žĖĽžĚÄ ÍīÄžÉĀŽŹôŽß•žĚė ŽāīÍ≤Ĺ ŪėĎžį©žĚė ž†ēŽŹĄŽßĆžúľŽ°ú ÍīÄžÉĀŽŹôŽß• Ž≥ĎŽ≥Ğ̥ ŪŹČÍįÄŪēėŽäĒ Žį©Ž≤ēžĚĄ ŪÜĶŪēī Ūėąžó≠Ūēôž†ĀžúľŽ°ú žú†žĚėŪēú ÍīÄžÉĀŽŹôŽß• ŪėĎžį©žĚė žßĄŽč® ž†ēŪôēŽŹĄŽ•ľ ŪĖ•žÉĀžčúŪā§ŽäĒ ŽćįžóźŽäĒ žó¨ž†ĄŪěą ž∂©Ž∂ĄŪēėžßÄ žēäŽč§[28]. žĚľŽ∂Ä ŽĻĄÍĶź ŽĆÄž°įÍĶį žóįÍĶ¨Žď§žĚė Í≤įÍ≥ľ ÍīÄžÉĀŽŹôŽß• žßąŪôėžóź žĚėŪēú ŪėϞ訞¶Ě ŪôėžěźžóźžĄú ÍīÄžÉĀŽŹôŽß• CTAŽäĒ ŪôėžěźžĚė žßĄŽč® ŽįŹ žėąŪõĄ ŪŹČÍįÄžĚė ž†ēŪôēŽŹĄžóź žěąžĖī ŽĻĄžĻ®žäĶž†Ā ÍłįŽä• Í≤Äžā¨Žď§Í≥ľ ŽĻĄÍĶźŪēėžėĞ̥ ŽēĆ žú†žā¨Ūēú Í≤įÍ≥ľŽ•ľ Ž≥īžėĎ觎äĒ Ž≥īÍ≥†Žď§ŽŹĄ žěąžßÄŽßĆ žó¨Žü¨ Ž¨īžěĎžúĄ žěĄžÉĀžčúŪóėžóźžĄú žč¨Í∑ľ ÍīÄŽ•ė SPECT ŽįŹ Ž∂ĄŪöćŪėąŽ•ėžėąŽĻĄŽ†•(fractional flow reserve, FFR)žĚĄ ÍłįŽįėžúľŽ°ú Ūēú žě¨ÍīÄŽ•ė žĻėŽ£ĆÍįÄ ÍīÄžÉĀŽŹôŽß• CTAŽ•ľ ÍłįŽįėžúľŽ°ú Ūēú žě¨ÍīÄŽ•ė žĻėŽ£ĆŽ≥īŽč§ ŪôėžěźŽď§žĚė žā¨ŽßĚžĚīŽāė žč¨Í∑ľÍ≤ĹžÉČžĚė ŽįúžÉ̞̥ ž§ĄžĚīÍ≥†, žč¨Í∑ľ ŪóąŪėąžĚė Ž≤ĒžúĄžôÄ ž§Ďž¶ĚŽŹĄÍįÄ ÍīÄžÉĀŽŹôŽß• žßąŪôėžĚĄ ÍįĞߥ ŪôėžěźŽď§žĚė žúĄŪóėžĚė Í≤įž†ēŪēėŽäĒ žöĒžĚłŽď§Ž°ú žēĆŽ†§ž†ł žěąžĖī žēąž†ēŪėē ŪėϞ訞¶Ě ŪôėžěźŽď§žóźÍ≤Ć žč¨Í∑ľ ŪóąŪėąžĚĄ Í∑ľÍĪįŽ°ú ŪēėŽäĒ žĻėŽ£Ć ž†ĎÍ∑ľžĚė ž§ĎžöĒžĄĪžĚī ž†źž†ź Íįēž°įŽźėÍ≥† žěąŽč§[29,30]. žĶúÍ∑ľžóźŽäĒ CTžĚė Íłįžą†ž†Ā Žįúž†ĄÍ≥ľ Ž∂ĄžĄĚ žÜĆŪĒĄŪäłžõ®žĖīžĚė ŪĖ•žÉĀžúľŽ°ú žĚīŽü¨Ūēú ŪēúÍ≥Ąž†źŽď§žĚĄ Í∑ĻŽ≥ĶŪēėÍłį žúĄŪēī ÍīÄžÉĀŽŹôŽß• CT-FFR ŽďĪžĚė žÉąŽ°úžöī žč¨Í∑ľ ŪóąŪėą žßĄŽč® Žį©Ž≤ēŽď§žĚī ÍįúŽįúŽźėÍ≥† žěąŽč§[31].
ŽĻĄžĻ®žäĶž†Ā Í≤Äžā¨žĚė žĄ†ŪÉĚ
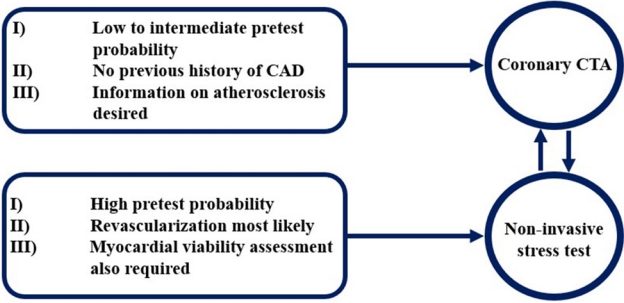
žó¨Žü¨ ÍįÄžßÄ ŽĻĄžĻ®žäĶž†Ā ÍłįŽä• Í≤Äžā¨ ŪėĻžĚÄ ŪėēŪÉúŪēôž†Ā Í≤Äžā¨Ž•ľ ŪÜĶŪēī ÍīÄžÉĀŽŹôŽß• ŪėĎžį©žóź žĚėŪēú ŪėϞ訞¶ĚžĚĄ žßĄŽč®Ūē† žąė žěąŽč§[4]. žöīŽŹô Ž∂ÄŪēė žč¨ž†ĄŽŹĄ Í≤Äžā¨žĚė Í≤Ĺžöį ŪėϞ訞¶Ě ŪôėžěźŽď§žĚĄ žßĄŽč®ŪēėÍ≥† Í∑ł žěĄžÉĀž†Ā žėąŪõĄŽ•ľ ŪĆźŽč®ŪēėŽäĒ Žćį žěąžĖī žó¨Žü¨ žóįÍĶ¨Žď§žĚĄ ŪÜĶŪēī Ž∂ĄžĄĚžĚĄ žčúŪĖČŪēú Í≤įÍ≥ľ Žč§Ž•ł ŽĻĄžĻ®žäĶž†Ā Í≤Äžā¨Žď§Í≥ľ ŽĻĄÍĶźŪēėžó¨ žóīŽďĪŪēėŽč§ŽäĒ Í≤įÍ≥ľŽ•ľ Ž≥īžėÄŽč§. ŽėźŪēú žöīŽŹôŽ∂ÄŪēė žč¨ž†ĄŽŹĄŽäĒ Í≤įÍ≥ľ ŪēīžĄĚžóź žěąžĖī žúĄžĖĎžĄĪÍ≥ľ žúĄžĚĆžĄĪžĚė ÍįÄŽä•žĄĪžĚĄ Í≥†Ž†§Ūēīžēľ ŪēėÍłį ŽēĆŽ¨łžóź Žč§Ž•ł ŽĻĄžĻ®žäĶž†Ā Í≤Äžā¨Žď§žĚė žčúŪĖČžĚī žĖīŽ†§žöī žÉĀŪô© ŽďĪžóźžĄú ŽĆÄž≤ī žó≠Ūē†žĚĄ ŪēėŽäĒ Í≤Äžā¨Ž°ú žó¨Í≤®žßÄÍ≥† žěąŽč§[32]. ŽĻĄžĻ®žäĶž†Ā Í≤Äžā¨ ž§Ď ÍīÄžÉĀŽŹôŽß• CTAžĚė Í≤Ĺžöį žĚĆžĄĪ žėąžł°ŽŹĄÍįÄ ŽÜíÍłį ŽēĆŽ¨łžóź ŪėϞ訞¶ĚžĚė žěĄžÉĀž†Ā ÍįÄŽä•žĄĪžĚī ŽāģžĚÄ ŪôėžěźŽď§, Íłįž°īžóź ŪėϞ訞¶Ě ŽįŹ ÍīÄžÉĀŽŹôŽß• žßąŪôėžĚĄ žßĄŽč®ŽįõžĚÄ ÍłįžôēŽ†•žĚī žóÜŽäĒ ŪôėžěźŽď§žóźÍ≤Ć žĄ†ŪėłŽźúŽč§. ŽĻĄžĻ®žäĶž†Ā ÍłįŽä• Í≤Äžā¨Žď§žĚė Í≤Ĺžöį žĖĎžĄĪ žėąžł°ŽŹĄžôÄ ŪäĻžĚīŽŹĄÍįÄ žÉĀŽĆÄž†ĀžúľŽ°ú ŽÜížĚÄ ŪäĻžßēžĚĄ Ž≥īžĚīŽ©į ŪėϞ訞¶ĚžĚė žěĄžÉĀž†Ā ÍįÄŽä•žĄĪžĚī ŽÜížĚÄ ŪôėžěźŽď§Í≥ľ Íłįž°īžóź ŪėϞ訞¶Ě ŽįŹ ÍīÄžÉĀŽŹôŽß• žßąŪôėžĚĄ žßĄŽč®ŽįõžĚÄ ŪôėžěźŽď§žóźÍ≤Ć žĄ†ŪėłŽźúŽč§(Fig. 1). Íłįž°īžóź žóįÍĶ¨Žď§žĚĄ Ž∂ĄžĄĚŪēėžėĞ̥ ŽēĆ žĻ®žäĶž†Ā ÍīÄžÉĀŽŹôŽß• ž°įžėĀžą†Ž°ú žĚėŽĘįŽźėŽäĒ ŽĻĄžú®žĚÄ ÍīÄžÉĀŽŹôŽß• CTAŽ•ľ ŪÜĶŪēú ŪėēŪÉúŪēôž†Ā Í≤Äžā¨Ž≥īŽč§ ŽĻĄžĻ®žäĶž†Ā ÍłįŽä• Í≤Äžā¨Žď§žĚī ŽāģžēėŽč§[4,33].
žĻ®žäĶž†Ā ÍīÄžÉĀŽŹôŽß• ž°įžėĀžą†(invasive coronary angiography) ŽįŹ ŪėąÍīÄ Žāī žėĀžÉĀ ÍłįŽ≤ē(intra coronary imaging)
žßĄŽč®ž†Ā Ž™©ž†ĀžĚė žĻ®žäĶž†Ā ÍīÄžÉĀŽŹôŽß• ž°įžėĀžą†žĚÄ ŽĻĄžĻ®žäĶž†Ā Í≤Äžā¨žóźžĄú žßĄŽč®žĚī Ž∂ąŪôēžč§Ūēú ŪôėžěźŽď§Í≥ľ ŪäĻž†ē žßĀžó̥֞ ÍįÄžßÄŽäĒ ŪôėžěźŽď§žóźžĄú ŪēĄžöĒŪēėžßÄŽßĆ žēěžóźžĄú žÜĆÍįúŽźú ŽĻĄžĻ®žäĶž†Ā ÍłįŽä• Í≤Äžā¨žóźžĄú Í≥† žúĄŪóėÍĶįžúľŽ°ú ŪĆźŽ™ÖŽźú ŪôėžěźŽď§žĚė žě¨ÍīÄŽ•ėžą† Í≤įž†ēžĚĄ ŪĆźŽ™ÖŪēėŽäĒ žł°Ž©īžóźŽŹĄ Í∑ł Ž™©ž†ĀžĚī žěąŽč§. ŽėźŪēú ÍīÄžÉĀŽŹôŽß• žßąŪôėžĚė žěĄžÉĀž†Ā ÍįÄŽä•žĄĪžĚī Žß§žöį ŽÜížĚÄ ŪôėžěźŽď§žóźžĄú žēĹŽ¨ľ žĻėŽ£ĆžóźŽŹĄ Ž∂ąÍĶ¨ŪēėÍ≥† ž¶ĚžÉĀžĚī žßÄžÜ掟ėŽäĒ Í≤ĹžöįŽāė ŽÖłžěĎžĚė ÍįēŽŹĄÍįÄ ž†ĀžĚÄ žÉĀŪÉúžóźžĄú ž†ĄŪėēž†ĀžĚł ŪĚČŪÜĶžĚĄ ŪėłžÜĆŪēėŽäĒ Í≤ĹžöįžóźŽäĒ ŽĻĄžĻ®žäĶž†ĀžĚł Í≤Äžā¨Žď§žĚĄ žčúŪĖČŪēėžßÄ žēäÍ≥† Í≥ߎįĒŽ°ú žĻ®žäĶž†Ā ÍīÄžÉĀŽŹôŽß• ž°įžėĀžą†žĚĄ Í≥†Ž†§ŪēīŽ≥ľ žąė žěąŽč§[4]. žēąž†ēŪėē ŪėϞ訞¶Ě ŪôėžěźžóźÍ≤Ć žĻ®žäĶž†Ā ÍīÄžÉĀŽŹôŽß• ž°įžėĀžą†žĚĄ žčúŪĖČŪēėŽäĒ Í≤Ĺžöį Ž≥ĎŽ≥Ä žÉĀŪÉúžóź ŽĒįŽĚľ Žč§Ž•ľ žąė žěąžúľŽāė žĻ®žäĶž†ĀžĚł ÍłįŽä• Í≤Äžā¨ÍįÄ ŽŹôŽįėŽźėžĖīžēľ ŪēúŽč§. 50-90%žĚė ŪėĎžį©žĚĄ Ž≥īžĚīŽäĒ ÍīÄžÉĀŽŹôŽß• Ž≥ĎŽ≥Ä, Žč§ŪėąÍīÄ žßąŪôė ŽďĪžóźžĄúŽäĒ FFRžĚĄ ŪÜĶŪēī žč¨Í∑ľ ŪóąŪėąžĚė ž†ēŽŹĄŽ•ľ Ž™ÖŪôēŪēėÍ≤Ć ŪŹČÍįÄŪēėÍ≥† žĚīŽ•ľ ŪÜĶŪēī žēĹŽ¨ľ žĻėŽ£Ć ŪėĻžĚÄ žě¨ÍīÄŽ•ėžą†žĚĄ Í≤įž†ēŪēėŽäĒ Í≤ÉžĚī ž§ĎžöĒŪēėŽč§. ŪÜĶÍ≥Ąž†ĀžúľŽ°ú FFRžĚĄ ŪÜĶŪēú ÍīÄžÉĀŽŹôŽß• Ž≥ĎŽ≥ÄžĚė žě¨ÍīÄŽ•ėžą† Í≤įž†ēžĚÄ 30-50%žĚė ŪôėžěźŽď§žóźžĄú Íłįž°īžĚė žĻėŽ£Ć Žį©žĻ®žóźžĄúŽ∂ÄŪĄįžĚė Ž≥ÄŪôĒŽ•ľ ÍįÄž†łžôĒŽč§[30,34]. žĶúÍ∑ľ ŽĻĄžĻ®žäĶž†Ā ÍłįŽä• Í≤Äžā¨ Íłįž§Ä ž§ĎŽďĪŽŹĄ žĚīžÉĀžĚė žúĄŪóėŽŹĄŽ°ú ŪĆźŽ™ÖŽźú 5,000žó¨ Ž™ÖžĚė žēąž†ēŪėē ŪėϞ訞¶Ě ŪôėžěźŽď§žĚĄ ž°įÍłį žĻ®žäĶž†Ā žĻėŽ£ĆÍĶįÍ≥ľ Ž≥īž°īž†Ā žēĹŽ¨ľ žĻėŽ£ĆÍĶįžúľŽ°ú ŽāėŽąĄžĖī Í∑ł žėąŪõĄŽ•ľ Ž∂ĄžĄĚŪēėžėÄŽč§. žóįÍĶ¨ Í≤įÍ≥ľ ŪŹČÍ∑† 3.3ŽÖĄžĚė ÍīÄžįį ÍłįÍįĄ ŽŹôžēąžóź ž°įÍłį žĻ®žäĶž†Ā žĻėŽ£ĆÍĶįÍ≥ľ Ž≥īž°īž†Ā žēĹŽ¨ľ žĻėŽ£ĆÍĶįžóźžĄú žč¨žĚłžĄĪ žā¨ŽßĚ, žč¨Í∑ľÍ≤ĹžÉČ, Ž∂ąžēąž†ē ŪėϞ訞¶ĚžúľŽ°ú žĚłŪēú žěÖžõź, žč¨Ž∂Äž†Ą ŪėĻžĚÄ žč¨Í∑ľÍ≤ĹžÉČžúľŽ°ú žĚłŪēú žč¨ŪŹźžÜĆžÉĚžą†Ž°ú ÍĶ¨žĄĪŽźú 1žį® žóįÍĶ¨ Ž™©ŪĎúž†źžĚė žį®žĚīŽ•ľ Ž≥īžĚīžßÄ žēäžēėŽäĒŽćį, žĚīŽü¨Ūēú žóįÍĶ¨ Í≤įÍ≥ľŽ•ľ ŽįĒŪÉēžúľŽ°ú žēąž†ēŪėē ŪėϞ訞¶Ě ŪôėžěźžĚė ÍīÄžÉĀŽŹôŽß• Ž≥ĎŽ≥ÄžĚė žě¨ÍīÄŽ•ėžą†žĚĄ Í≤įž†ēŪēėŽäĒ Žćį žěąžĖī FFRžĚĄ ŪÜĶŪēī žč¨Í∑ľ ŪóąŪėąžĚė ž†ēŽŹĄŽ•ľ Ž™ÖŪôēŪēėÍ≤Ć ŪĆźŽč®ŪēėÍ≥† FFRžĚĄ ÍłįŽįėžúľŽ°ú Ūēú ÍłįŽä•ž†Ā žôĄž†Ą žě¨ÍīÄŽ•ėžĚė ž§ĎžöĒžĄĪžĚī Žč§žčú Ūēú Ž≤ą Íįēž°įŽźėžóąŽč§[35,36].
žĻ®žäĶž†Ā ÍīÄžÉĀŽŹôŽß• ž°įžėĀžą†žóźžĄú ŪėąÍīÄ Žāī žėĀžÉĀ ÍłįŽ≤ē(intra-coronary imaging)žĚÄ ŪėąÍīÄ Žāī žīąžĚĆŪĆĆžôÄ ÍīĎÍįĄžĄ≠ Žč®žłĶžī¨žėĀ ŽďĪžúľŽ°ú ŽĆÄŪĎúŪē† žąė žěąŽč§[37]. žĚīŽü¨Ūēú ŪėąÍīÄ Žāī žėĀžÉĀ ÍłįŽ≤ēŽď§žĚÄ ÍīÄžÉĀŽŹôŽß• ž£ĹžÉĀÍ≤ĹŪôĒŽįėžĚė žĖĎžÉĀÍ≥ľ ŪėēŪÉúžóź ŽĆÄŪēú ž∂ĒÍįÄž†ĀžĚł žĄłžĄłŪēú ž†ēŽ≥īŽ•ľ ž†úÍ≥ĶŪēėÍłįŽŹĄ ŪēėžßÄŽßĆ žēąž†ēŪėē ŪėϞ訞¶Ě ŪôėžěźžóźÍ≤ĆžĄú FFRžĚĄ ŪÜĶŪēú ÍīÄžÉĀŽŹôŽß• Ž≥ĎŽ≥ÄžĚė ÍłįŽä•ž†Ā ŪŹČÍįÄ ŽįŹ žě¨ÍīÄŽ•ėžą† Í≤įž†ē žĚīŪõĄ žä§ŪÖźŪäł žĶúž†ĀŪôĒžóź Í∑ł žó≠Ūē†žĚī Žß§žöį ž§ĎžöĒŪēėŽ©į ŽßéžĚÄ žóįÍĶ¨Žď§žóźžĄú Žč®žąú ÍīÄžÉĀŽŹôŽß• ž°įžėĀžą† Í≤Äžā¨Ž•ľ ŪÜĶŪēú žä§ŪÖźŪäł žčúžą†Ž≥īŽč§ ŪėąÍīÄ Žāī žėĀžÉĀ ÍłįŽ≤ēžĚĄ Í∑ľÍĪįŪēú žä§ŪÖźŪäł žĶúž†ĀŪôĒžóźžĄú žěĄžÉĀž†Ā ÍįúžĄ†žĚĄ ž¶ĚŽ™ÖŪēėžėÄŽč§[38,39].
Í≤į Ž°†
žēąž†ēŪėē ŪėϞ訞¶Ě ŪôėžěźŽď§žĚĄ ž†ēŪôēŪēėÍ≤Ć žßĄŽč®Ūē† Í≤Ĺžöį žÉĚŪôú žäĶÍīĞ̥ ÍįúžĄ†žčúŪā§Í≥† Ūē©ŽčĻŪēú žēĹŽ¨ľ žĻėŽ£ĆÍįÄ žĚīŽ£®žĖīžßÄŽŹĄŽ°Ě ŪēúŽč§Ž©ī žĚīŽ•ľ ŪÜĶŪēī ž£ĹžÉĀÍ≤ĹŪôĒŽįėžĚė ž∂ĒÍįÄž†ĀžĚł ŪĆĆžóī ŽįŹ ŽĮłŽěÄžĚī ŽįúžÉĚŪēėžßÄ žē䎏ĄŽ°Ě ÍīÄžÉĀŽŹôŽß• Ž≥ĎŽ≥Ğ̥ žēąž†ēŪôĒžčúŪā¨ žąė žěąžĖī Í∂ĀÍ∑Ļž†ĀžúľŽ°úŽäĒ ͳȞĄĪ ÍīÄžÉĀŽŹôŽß• ž¶ĚŪõĄÍĶįžúľŽ°úžĚė žßĄŪĖȞ̥ Žį©žßÄŪēėžó¨ ŪôėžěźžĚė žā¨ŽßĚŽ•†žĚĄ ž§ĄžĚľ žąė žěąŽč§. žĚīŽü¨Ūēú žĚīžú†Ž°ú žēąž†ēŪėē ŪėϞ訞¶Ě ŪôėžěźžóźžĄú ž†ēŪôēŪēú Ž≥ĎŽ†• ž≤≠ž∑®žôÄ Ūē®ÍĽė ž†Āž†ąŪēú Í≤Äžā¨ ŽŹĄÍĶ¨Ž•ľ žĚīžö©Ūēėžó¨ žßĄŽč®žĚĄ Ž™ÖŪôēŪēėÍ≤Ć ŪēėŽäĒ Í≤ÉžĚī Žß§žöį ž§ĎžöĒŪēėŽč§Í≥† Ūē† žąė žěąÍ≤†Žč§.



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






