고형암에서 Molecular Residual Disease 추적 및 조기 재발 예측
Molecular Residual Disease Monitoring and Early Recurrence Prediction in Solid Tumors: Clinical Applications and Evidence
Article information
Trans Abstract
Recent advances in liquid biopsy technologies, particularly circulating tumor DNA (ctDNA) analysis, have enabled the sensitive and non-invasive detection of molecular residual disease (MRD) in solid tumors. This review summarizes the current clinical evidence and applications of MRD monitoring in solid cancers, focusing on colorectal cancer and non-small cell lung cancer (NSCLC). Tumor-informed and tumor-uninformed ctDNA assays are compared, highlighting their respective advantages and limitations. Landmark studies such as the DYNAMIC and GALAXY trials in colorectal cancer, and the TRACERx study in NSCLC, have demonstrated the prognostic value of ctDNAbased MRD detection for recurrence risk stratification and for guiding adjuvant therapy decisions. Ongoing research and standardization efforts are expected to further establish MRD assessment as an integral component of precision oncology.
서 론
최소 잔존 질환(minimal residual disease)은 근치적 치료 이후 체내에 미세하게 남아있는 암세포를 의미하며 기존 영상 검사로는 탐지되지 않는다. 이는 치료 후 생존 예후의 예측 지표이자 재발을 조기에 탐지할 수 있는 감시 도구로서 중요한 임상적 의미를 갖는다. 혈액암에서는 최소 잔존 질환이 예후 예측 및 치료 반응 평가의 핵심 바이오마커로 자리 잡고 있다. 고형암은 다양한 암 관련 바이오마커를 혈액 내에 방출하며 이러한 바이오마커의 검출 여부는 암의 종류, 병기, 발생 부위, 치료 반응 등 여러 요인에 따라 달라진다[1]. 따라서 고형암의 액체 생검(liquid biopsy)에서는 최소 잔존 질환이라는 용어 대신 질병의 분자적 지표로서의 바이오마커 존재를 의미하기 위하여 분자적 잔존 질환(molecular residual disease, MRD)이라는 용어를 사용하는 것이 필요하다(Fig. 1) [2]. 유럽종양학회(European Society for Medical Oncology, ESMO) [3] 및 미국 식품의약국(Food and Drug Administration, FDA)의 순환 종양 DNA 관련 가이드라인[4]에서도 동일하게 MRD 용어를 정의하고 있다.

Applications of liquid biopsy for ctDNA analysis across the continuum of patient status, treatment stage, and response [2]. Pretreatment ctDNA profiling in the neoadjuvant setting informs optimal presurgical therapy; postsurgical ctDNA detection enables MRD surveillance; and molecular assessment in advanced disease facilitates evaluation of treatment efficacy and response. Dx, diagnosis; Tx, treatment; ctDNA, circulating tumor DNA; MRD, molecular residual disease.
본고에서는 고형암에서의 MRD 추적 및 조기 재발 예측에 대한 최신 임상 근거와 임상 적용 가능성을 간략히 기술하고자 한다.
본 론
액체 생검
액체 생검(liquid biopsy)은 혈액, 소변, 타액 등의 생체액에 존재하는 순환 바이오마커를 분석함으로써 암 감시(cancer surveillance)를 위한 핵심적인 진단 기법으로 부상하고 있다[5]. 액체 생검을 통해 분석 가능한 주요 분석물에는 순환 종양 세포(circulating tumor cells, CTCs) [6], 세포 외 소포(extracellular vesicles, EVs) [7], 순환 종양 DNA(circulating tumor DNA, ctDNA) 등이 포함된다. CTCs는 원발암(primary tumor)에서 떨어져 나온 종양 세포로 혈류를 통해 순환하게 되며 EVs는 다양한 세포에서 분비되는 지질 이중층(lipid bilayer) 구조의 나노 크기 입자(nano-sized particles)로 구성된다. ctDNA는 종양 세포에서 유래되어 혈류 내로 방출된 소량의 DNA 조각을 의미한다. ctDNA는 매우 낮은 수준의 질병 상태를 특이적이고 비침습적으로 탐지할 수 있는 접근법을 제공함으로써 치료 반응의 평가, 잔존 질환의 존재 여부, 약제 내성의 발생 등을 모니터링하는 데 유리한 장점을 가진다[8].
CTCs는 혈장(plasma)이 아닌 세포 분획물(cellular fraction) 이 포함된 혈액(whole blood, buffy coat 등)에서 검출 및 분리되며[9] plasma는 세포가 제거된 혈액으로 EVs 및 ctDNA 검출에 적합하며 대부분의 MRD 검사, 특히 next generation sequencing (NGS) 기반 ctDNA 분석은 plasma를 표준 시료로 활용한다[10].
ctDNA 분석 방법
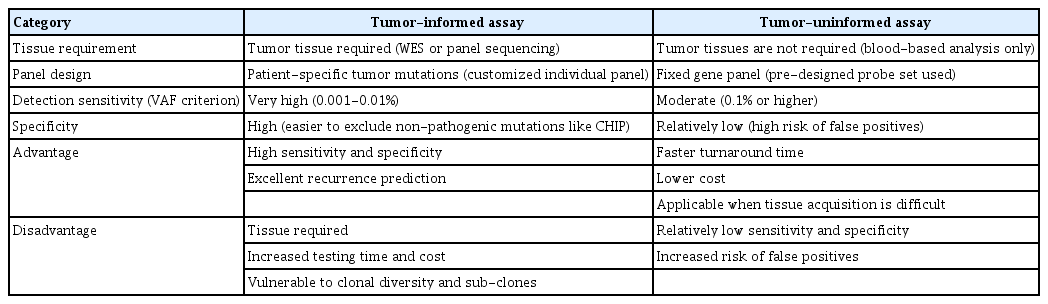
Tumor-informed assay (종양 맞춤형)는 환자의 종양 조직(biopsy 또는 수술 검체)을 먼저 시퀀싱하여 개인화된 돌연변이 정보를 확인한 후 이를 기반으로 환자 맞춤형 MRD 패널을 구성하여 혈액 내 ctDNA를 초심도, 초고감도로 분석하는 방식이다. Tumor-uninformed (종양 비의존형) 또는 tumor-agnostic assay는 종양 조직 정보 없이 고정된 유전자 패널을 사용하여 ctDNA를 분석하는 방식으로 사전 설계된 프로브를 이용하여 혈액 내 변이를 직접 검출하는 방식이다(Table 1) [11].
고형암에서의 ctDNA를 활용한 MRD 적용과 pivotal 연구
대장암(colorectal cancer)
DYNAMIC 연구는 총 455명의 2기 대장암 환자를 대상으로 진행되었다. 환자들은 2:1 비율로 ctDNA (tumor-informed assay) 기반 치료군과 기존 임상 병리학적 기준에 따른 표준 치료군에 무작위 배정되어 ctDNA 기반 치료군에서는 수술 후 4-7주에 ctDNA가 검출되면 항암 치료를 시행하였고 ctDNA가 음성이면 항암 치료를 시행하지 않았다. 연구 결과 ctDNA 기반 치료군에서 항암 치료 비율은 15%로 표준 치료군의 28%에 비해 유의하게 감소하였다. 2년 무재발 생존율(recurrence-free survival, RFS)은 ctDNA 기반 치료군 93.5%, 표준 치료군 92.4%로 ctDNA 기반 치료의 비열등성(non-inferiority)을 입증하였다[12]. 장기적인 추적 결과에서도 5년 RFS가 각각 88% vs. 87%, 5년 전체 생존율은 93.8% vs. 93.3%로 장기 생존에도 차이가 없음을 확인할 수 있었다[13].
GALAXY 연구는 일본 CIRCULATE-Japan 연구 관찰 코호트로 1,039명의 임상 2-4기 또는 재발성 대장암 환자를 포함하였으며 환자들은 수술 후 4주 시점에 ctDNA (tumor-informed assay) 검사를 진행하였고 이후 재발률, 보조 항암 치료의 효과, ctDNA 변화와 예후 간의 관계를 분 석한 연구이다. 수술 4주 후 ctDNA 양성으로 MRD 확인된 경우 병리학적 고위험 인자들보다 가장 강력한 재발의 위험 인자로 예후 예측이 가능함을 입증하였다. 또한 ctDNA 양성 환자에서 보조 항암 치료는 분명한 생존 이득이 있었던 반면 ctDNA 음성 환자는 치료 없이도 양호한 예후를 기대할 수 있어 치료 감량(de-escalation)의 근거가 될 수 있음을 밝혔다[14].
대장암에서의 이러한 연구들은 MRD의 예후 예측력뿐만 아니라 근치적 수술을 받은 환자에서 보조 치료 강화 또는 축소 전략의 근거를 제공하고 있고 이에 대한 여러 임상 연구들이 현재 진행 중이다.
비소세포폐암(non-small cell lung cancer)
LUNGCA-1는 다기관, 전향적 코호트 연구로 330명의 1-3기 비소세포폐암(non-small cell lung cancer, NSCLC) 환자를 대상으로 수술 전후(수술 3일 후, 수술 1개월 후) ctDNA 분석(tumor-informed assay)을 통한 MRD 검출이 수술 후 재발 예측 및 맞춤형 보조 요법 결정에 도움이 될 수 있는지를 평가한 연구이다. 수술 전 ctDNA 양성 환자는 재발 위험이 유의하게 높았고(hazard ratio [HR], 4.2; p< 0.001), 수술 후 MRD 양성(수술 후 ctDNA 검출) 환자는 재발 위험이 매우 높음(재발률 80.8% vs. 16.2%; HR, 11.1; p< 0.001)을 확인하여 다른 임상병리 변수보다 재발 예측력이 우수함을 증명하였다. 또한 MRD 양성 환자에서 보조 항암 요법을 받은 경우 RFS가 유의하게 연장됨(HR, 0.3; p= 0.008)을 확인하였다[15].
TRACERx 연구는 수술한 NSCLC 환자 197명에서 수술 전과 수술 후 3-6개월 간격으로 5년간 1,069개의 혈장 샘플을 수집하여 ctDNA (tumor-informed assay)를 분석하여 재발 위험과 생존율을 예측하였다. 폐선암(adenocarcinoma)에서 수술 전 ctDNA가 검출되지 않으면 종양의 악성도가 낮고 예후가 매우 좋았으며(2년 전체 생존율 90%) ctDNA가 검출된 환자는 재발 위험이 높고 생존율이 낮았다. 수술 후 ctDNA 분석 결과 수술 후 120일 이내 ctDNA 검출(landmark positive)은 재발 위험이 매우 높음을 의미하였고(93% 양성 예측도) 임상적 재발보다 평균 228일 먼저 ctDNA가 검출됨을 확인하였다. 이 연구는 수술한 NSCLC 환자에서 ctDNA를 활용한 MRD 추적의 예후 예측의 가능성을 보여주었는데 수술 후 ctDNA 양성은 영상 검사에서 재발 소견이 나타나기 전에 먼저 검출되는 경우가 많아 표준 영상 검사보다 더 빠른 재발 경고 신호를 제공할 수 있음을 알 수 있다[16].
유방암(breast cancer)
Neoadjuvant I-SPY 2 연구에서 고위험 조기 유방암 환자 84명으로부터 tumor-informed ctDNA를 분리하여 분석하였다. ctDNA 지속적으로 검출되는 것이 불량한 치료 반응과 재발의 강력한 예측인자인 반면 ctDNA 소실은 병리학적 완전관해를 달성하지 못한 환자에서도 생존 개선과 연관됨을 발견하였다[17].
ABCSG-34에 등록된 조기 유방암 환자에서 neoadjuvant chemotherapy 치료 기간에 tumor informed ctDNA의 존재 여부와 치료 반응 간 관계를 평가하기 위하여 수행된 연구에서 145명의 환자에서 ctDNA 검출율은 기저선 43.4%, 치료 중반 39.7%, 치료 종료 시점에 23.8%였다. 중간 평가 시점에서 ctDNA가 지속적으로 검출된 환자 31명 중 30명(96.8%)이 비반응군에 속했으며 ctDNA 검출은 높은 잔류암 부담과 유의하게 연관되었다. 반면 병리학적 완전 관해 환자군에서는 중간 평가 시점 ctDNA 검출이 거의 관찰되지 않았다[18].
c-TRAK TN 연구는 조기 삼중음성유방암(triple-negative breast cancer) 환자에서 ctDNA 기반 치료 전략의 임상적 유용성을 전향적으로 평가한 연구로 1년 내 ctDNA 검출률은 27.3%였으나 상당수 환자가 이미 전이성 질환 상태였다. 펨브롤리주맙 치료 중재군에서도 지속적인 ctDNA 음전은 확인되지 않았으며 이는 조기 개입과 고감도의 ctDNA 검사 전략의 중요성을 시사한다.[19]
결 론
현재까지 ctDNA 기반 MRD 연구는 고형암, 특히 대장암, 암, 유방암 등에서 연구가 활발히 진행 중이며 아직 표준 치료 의 일부로 사용되고 있는 것은 아니지만 축적되는 근거와 가이드라인은 MRD가 보조 항암 치료 맞춤화와 재발 조기 탐지에 있어 임상적으로 유의미한 도구가 될 수 있음을 뒷받침한다. 여러 연구에 따르면 고형암에서 근치적 치료 이후 ctDNA 기반의 MRD를 검출하는 것은 강력한 예후 인자이며 재발 위험을 예측하는 데 매우 높은 양성 예측도를 보이는 것으로 나타났다. 현재 여러 개의 중재적 임상시험이 ctDNA MRD를 기반으로 선행 또는 보조 치료(neoadjuvant/adjuvant therapy)를 개인 맞춤화하는 전략의 유용성을 평가하고 있으며 향후 다양한 MRD 분석 기법들의 기술 고도화 및 표준화를 통해 전향적 검증이 된다면 정밀의학 시대의 임상 진료에서 활용될 가능성이 있다.
MRD 검사는 높은 민감도와 특이도로 조직 생검에 비해 비침습적이고 영상의학적 재발 검출보다 수개월 앞서 MRD 검출을 통해 재발을 의심할 수 있으며 선행 또는 보조 치료 단계에서 환자의 맞춤형 치료 강도 조절(강화/약화)을 가능하게 하여 과잉 치료 및 부작용을 최소화할 수 있는 장점이 있다. 또한 단순 채혈로 검사할 수 있어 환자 편의성 및 순응도를 높이고 추적 관찰을 빈번히 할 수 있다. 하지만 현재까지 고형암에서의 MRD 검출에 대해서 다양한 플랫폼이 있고 향후 더 증가할 것으로 전망되며 다양한 플랫폼별 분석 민감도와 특이도 차이로 임상적 해석과 재현성 확보가 어렵고 표준화가 어렵다는 문제가 있다. 또한 NGS 기반 개인화 패널 MRD 및 tumor uninformed MRD의 검사 비용이 높아서 보험 급여가 제한적일 경우 환자 부담이 증가하게 되며 임상에서 보편적으로 시행되기는 어렵다.
최근 국내에서도 신의료기술 평가 대상으로 대장암 환자에서 수술 이후 MRD 확인을 위한 개인 맞춤형 유전자 패널 기반 액체 생검이 포함되었고 여러 MRD 검출 플랫폼으로 임상 도입 단계에 있다. 향후 전향적 임상 시험을 통해 고형암 종류에 따른 MRD 기준 및 MRD 기반의 치료 가이드라인에 대한 임상 근거를 축적하고 급여 확대를 위한 비용 효용성에 대한 평가도 진행되어야 할 것으로 전망한다.
Notes
CONFLICTS OF INTEREST
No potential conflict of interest relevant to this article was reported.
FUNDING
None.
AUTHOR CONTRIBUTIONS
Sung Hee Lim contributed to all aspects of the article: conception, literature review, writing, and approval of the final manuscript.
ACKNOWLEDGEMENTS
None.